Dolichodial – Wikipedia
| Formule structurelle | |
|---|---|
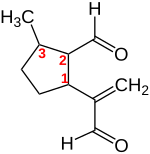 |
|
| Formule structurelle sans stéréochimie | |
| Général | |
| Nom | Dolichodial |
| Autres noms |
|
| Formule de purée | C dix H 14 O 2 |
| Identificateurs / bases de données externes | |
| Caractéristiques | |
| Masses molaires | 166,22 g · mol −1 |
| État global |
fluide [d’abord] |
| point d’ébullition |
96 ° C (à 2 mmHg) [d’abord] |
| consignes de sécurité | |
| Dans la mesure du possible et commun, des unités SI sont utilisées. Sauf indication contraire, les données fournies s’appliquent aux conditions standard. | |
Dolichodial (Grec Δολιχός Dolichos ‘Lang’) est un monoterpen monocyclique avec deux groupes aldéhyde, qui appartient au groupe d’iridoïdes.
Dolichodial et ses stéréoisomères peuvent être trouvés dans l’huile essentielle de certaines plantes, mais aussi dans les sécrétions de défense de certains types d’insectes.
Dolichodial a trois centres stéréo dans ses cinq. Quatre paires diastéréomères d’énantiomères sont donc possibles. Le (1 S , 2 R , 3 S ) – Connexion configurée et votre image d’image miroir avec (1 R , 2 S , 3 R ) Configuration.
Dolichodial ( UN ) a d’abord été composé des genres en 1960 Dolichoderus et Iridomyrmex isolé. [3] Ce n’est que seize ans plus tard qu’il a été trouvé dans une plante, le chat Gamander Teuorium Marum , comme partie essentielle de l’huile essentielle.
Les couples avec une stéréochimie qui s’écarte du dolichodial sont appelés anisomorphales et péruphasmaux.
| Isomères de l’anisomorphale et du péruphasme | ||||
| Nom | (d’abord S , 2 S , 3 S ) – (+) – anisomorphal (B) | (d’abord R , 2 R , 3 R ) – (-) – anisomorphal (B ‘) | (d’abord R , 2 R , 3 S – Peruphasmal (C) | (d’abord S , 2 S , 3 R – Peruphasmal (C ′) |
| Autres noms | trans – (+) – Dolichodial | |||
| Formule structurelle |  |
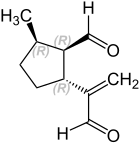 |
 |
 |
| Numero CAS | 3671-76-9 | – | 913835-25-3 | – |
| 1127-66-8 (Anisomorphal, unpec.) | 1127-67-9 (Peruphasmal, UNSEP.) | |||
| 864826-30-2 ( et -Dolichodial, Uspec.) | ||||
| Se publier | 76970747 | – | – | – |
| – (UNSEP.) | ||||
| wikidata | Q27259133 | – | – | – |
| Q97483975 (UNSEP.) | ||||
Dans la nature, cela vient souvent à des épimers c-2 dolichodiaux (+) – anisomorphale ( B ) avant, ainsi que trans – (+) – Dolichodial. UN’ jusqu’à D’ Sont-ils aussi UN jusqu’à D Connexions d’image miroir (énantiomères).
L’anisomorphale ( B ) a été décrit en 1962 comme le composant principal de la sécrétion de déverginage du cadre fantôme Anisomorpha buprestoides . En plus petites quantités, il peut également être trouvé dans le chat gamander. Le péruphasme ( C ) [4] A son nom du cadre fantôme Peruphasma Schulti Cela utilise ce stéréoisomère comme composant principal de votre sécrétion militaire. Des études récentes montrent que A. buprestoides En plus de l’anisomorphale, du péruphasme et du dolichodial également utilisé dans la sécrétion militaire. Selon l’origine géographique, l’âge des circonstances animales et individuelles, l’une des trois connexions peut dominer. Les animaux matures sexuels produisent presque exclusivement le péruphasme. Seul le dolichodial peut être trouvé dans les sécrétions de défense des larves de certains types de lacunes du genre Craesus . [5] L’aile frange Callococcithrips fuspipennis Utilisez un mélange comme sécrétion de défense, qui, en plus des alcanes et des esters, contient également dolichodial et une autre substance qui peut être le stéréoisomère D ou D’ du dolichodial, [6] qui n’ont pas encore été trouvés dans la nature.
-

(d’abord R , 2 S , 3 S ) -Sterreoisomère (D)
-

(d’abord S , 2 R , 3 R ) -Sterreoisomère (D’)
- ↑ un b Connolly / Hill: Dictionnaire des terpénoïdes . CRC Press, 1991, ISBN 978-0-412-2570-470-4, S. 47 ( books.google.de ).
- ↑ Cette substance n’a pas encore été classée en termes de danger, soit une source fiable et citée de cela n’a pas encore été trouvée.
- ↑ G. W. K. Cavill: Terpénoïdes d’insectes et nepétalactone. Dans: W. I. Taylor, A. R. Battersby (Hrsg.): Dérivés du terpène cyclopentanoïde. Covers, New York 1969, pp. 203–238.
- ↑ A. T. Dossey, S. Walse, A. S. Edison: Variation du développement et géographique de la défense chimique de l’insecte de cartes de marche Anisomorpha Buprestoides. Dans: Journal of Chemical Ecology. 34, 2008, S. 584–590, Deux: 10.1007 / s10886-008-9457-8 .
- ↑ J. L. Bové, J. C. Braekman, D. Daloze, M. Houart, J. M. Pasteels: Sécrétions défensives des larves de Nematinae (Symphyta – Tenthredinidae). Dans: Sciences de la vie cellulaire et moléculaire (CML). 40, 1984, S. 546–547, doi: 10.1007 / bf01982322 .
- ↑ G. Tschuch, P. Lindemann, G. Moritz: Un mélange inattendu de substances dans la sécrétion défensive des thrips tubuliferiens, Callococcus fuspipennis. Dans: Journal of Chemical Ecology. 34, 2008, S. 742–747, Deux: 10.1007 / s10886-008-9494-3 .
Recent Comments