Pentosephosphatweg – wikipedia
Le Pentosephosphatweg (Aussi cycle hexosémonophosphate, shunt hexosémonophosphate [d’abord] Ou le chemin du 6-phosphogluconate) est un métabolisme qui se produit dans la plupart des êtres vivants. Il représente une possibilité de recyclage des glucides, par exemple par le glucose, dans lequel la réduction signifie que NADPH est formé.
Il sert également à convertir divers glucides. Ces processus ont lieu dans le cytosol de la cellule et dans les plantes également dans les chloroplastes.
Le pentose phosphate peut être divisé en une section réversible irréversible et non oxydante (réductrice) oxydative. Cependant, les deux chemins n’ont pas à courir immédiatement l’un après l’autre. Par exemple, au cours du CO 2 -Sumilation dans les plantes (cycle Calvin) seulement la voie réductrice.
Dans le chemin du phosphate de pentose, im oxydatif Way ribulose 5-phosphate D -Glucose formé dans le profit de NADPH. La ribulose-5-phosphate (un phosphate de pentose) peut être convertie en métabolites de glycolyse ou servir de bloc de construction de base pour la biosynthèse des nucléotides (ADN, ARN) et coenzymen (ATP, coenzyme A, NAD, FAD). NADPH est utilisé comme agent de réduction de l’anabolisme et sert à maintenir un milieu réducteur dans le cytoplasme. Contrairement à NADH, NADPH ne sert pas la production d’énergie dans la chaîne respiratoire. Autres possibilités de synthèse NADPH, etc. La navette de citrate et les réactions de lumière dans la photosynthèse. [2]
Dans le non oxydant, réversible Différents glucides peuvent être convertis les uns dans les autres. Par exemple, la pentose créée à partir de la branche oxydative (c 5 -Seur) peut être transformé en métabolites de glycolyse. En tant que produits intermédiaires, C 3 -SUGAR (TRIOSE), C 4 -SUGAR (tétroses), C 5 -Zucker (pentosé), C 6 -S sucre (hexoses) et un C 7 -SUGAR (heptose).

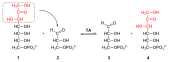
Comme dans la glycolyse, la réaction de glucokinase se produit comme première étape, dans le α- D -Glucose à α- D -Glucose-6-phosphat ( d’abord ) Phosphorylé sous la consommation d’ATP.
Le glucose-6 phosphate déshydrogénase (G6PDH) se forme avec la production de NADPH et H + 6-phosphoglucono-Δ-lacton ( 2 ), un ester intramoléculaire. Il est très spécifique au phosphate de glucose-6 et au NADP + , mais pas pour nad + . C’est une oxydation à C d’abord -Atome de glucose. L’équilibre de cette réaction est loin du côté des produits.
L’hexose 6-phosphate déshydrogénase (X6PDH) peut également catalyser cette réaction. Cependant, il montre une spécificité plus faible du glucose et peut également oxyder d’autres sorcières. Dans de nombreuses cellules, cependant, cela catalyse la première étape du chemin du phosphate de pentose. [3]
Ensuite, la 6-phosphogluconolactonase 6-phosphoglucono δ-lacton établit le 6-phosphogluconate ( 3 ) autour. Ceci est ensuite fabriqué via la 6-phosphogluconate déshydrogénase pour la ribulose-5-phosphate ( 4 ) oxydé et décarboxylé, où nadph, h + et Cie 2 développer. Une oxydation a donc lieu sur l’atome C3.
L’équilibre global de la partie oxydative du chemin du phosphate de pentose, à partir du glucose-6-phosphate, est donc:

Dans la partie réversible du chemin du phosphate de pentose, le C 4 -, C 5 -, C 6 – et un C 7 -Crugs transformés les uns envers les autres, il ne sert pas à générer d’autres équivalents de réduction. Ces réactions sont catalysées par deux enzymes. Une transcétolase transmet deux, les unités de carbone Transaldolase Three. La transmission des atomes de carbone par la transaldolase et la transcétolase ne consomme pas l’ATP et, dans le cas de la transcétolase, ne dépend que du pyrophosphate de thiamine (TPP, de la vitamine B1).
Dans un exemple, un sort possible de ribulose 5-phosphate est illustré sur la figure, qui a été créée dans le chemin oxydatif du chemin du phosphate de pentose.

Le ribulose-5-phosphate est isomérisé via la ribose 5-phosphate isomérase au ribose-5-phosphate, mais peut également être déplacé vers le xylose-5-phosphate (x5p) en utilisant la ribulosis phosphate-3-épimérase. Les deux produits participent aux réactions suivantes. Une transcétolase transfère alors un C 2 -Unit en xylose-5-phosphate sur le ribose 5-phosphate, de sorte que la première glycérinaldéhyde-3-phosphate (GAP), de la seconde séroheptulose-7-phosphate (S7P). Si un C à S7P 3 L’unité est transférée à GAP, l’érythrose-4-phosphate (E4P) et le fructose-6-phosphate sont créées. Cette réaction catalyse une transaldolase. Enfin, une kétolase transfère deux unités de carbone d’une autre molécule X5P à E4P, de sorte qu’une autre molécule de phosphate de fructose-6 et d’écart soit créée.
Bilan [ Modifier | Modifier le texte source ]]
Avec trois molécules ribulose-5-phosphate, l’équilibre suivant se produit dans le chemin réducteur du chemin du phosphate de pentose:
Si le chemin oxydatif est pris en compte, cela crée sous oxydation avec NADP + et décarboxylation composée de trois molécules de glucose-6-phosphate à deux molécules frucules-6-phosphate et une molécule glycererhyde-3-phosphate:
Chemin de phosphate de pentose réductrice [ Modifier | Modifier le texte source ]]
Au cours du cycle Calvin, le phosphate glycérinaldéhyde-3 est créé. Ici, cinq molécules, y compris les enzymes de la gluconéogenèse (tri-phosphatis, aldolase, fructose-1,6-bisphosphatase), sont converties en trois molécules ribulosis-5-phosphate. Dans l’illustration ci-dessus, cela correspond au chemin de droite à gauche.
Dans la littérature, cette régénération est également utilisée comme Chemin de phosphate de pentose réductrice désigné. [4]
Le phosphate de pentose crée des agents réducteurs sous forme de NADPH, tandis que le NADH est formé dans la glycolyse. Si, par exemple, le NADPH et les pentoses sont de plus en plus utilisés, le glucose s’écoule dans ce métabolisme. C’est particulièrement le cas dans les tissus dans lesquels la synthèse des acides gras ou des stéroïdes a lieu. Pour produire le NADH et l’ATP, les intermédiaires du chemin du phosphate de pentose peuvent revenir dans la glycolyse. Le chemin du phosphate de pentose peut ainsi être compris comme un concentrateur moléculaire dans lequel différents besoins des cellules de la cellule, des riboses, de l’ATP, du NADH et du Pyruvat sont traités. Il relie le métabolisme anabolique et catabolique du glucose. Divers cas sont discutés ci-dessous:
Beaucoup de NADPH doit être généré [ Modifier | Modifier le texte source ]]
Dans le cas où aussi de nombreuses molécules que possible sont utilisées, la variante suivante du chemin du phosphate de pentose peut être brisée (voir illustration):

Premièrement, six molécules glucose-6-phosphate sont décomposées à six molécules ribulose-5-phosphate via la partie oxydative du chemin PP. Il y a 12 molécules de NADPH. La ribulose-5-phosphate peut alors être montrée transformée via plusieurs versions intercon dans la partie réductrice du chemin vers cinq molécules frucules-6-phosphate. Cela se produit avec l’implication des enzymes de la gluconéogenèse. Comme ceux-ci sont en équilibre avec le phosphate de glucose-6, ils circulent à nouveau dans le cycle. En conséquence, l’équilibre est:
Dans le bilan global, un phosphate de glucose-6 molécule est oxydé total à six molécules CO 2 , Il y a 12 molécules nadph:
Cependant, cette variante du phosphate de pentose, dans laquelle seul le NADPH est généré, se produit dans les cellules de mammifères à des dimensions assez petites. [5] Dans la littérature, cette oxydation complète du glucose est également appelée “chemin pentosphosphate oxydatif” ou après ses découvreurs comme “Warburg-Dickens-Horecker-Baufweg”. [6]
Le phosphate ribose 5 est nécessaire [ Modifier | Modifier le texte source ]]

Les cellules de la moelle osseuse, de la peau, de la muqueuse intestinale et des cellules tumorales partagent rapidement et, par conséquent, ont besoin de beaucoup d’ADN et d’ARN. [4] La structure de l’ADN et de l’ARN nécessite de nombreuses riboses. Avec une alternative au chemin PP, la génération de phosphate ribose 5 peut être accentuée (voir illustration).
Dans l’exemple ci-dessus, six molécules de ribose-5-phosphate sont générées à partir de cinq molécules de glucose-6-phosphate. La partie oxydative du chemin PP est évitée ici, il n’y a que des conversions à partir de kétolases et d’aldolases. Cependant, une molécule ATP est également utilisée dans ce processus.
Équilibre:
NADH, NADPH et ATP sont nécessaires [ Modifier | Modifier le texte source ]]

Dans le cas où la cellule veut également générer de l’énergie à partir de la dégradation du glucose, une combinaison du chemin PP et de la glycolyse peut être rompue (voir illustration).
Dans la partie oxydative du chemin PP, trois molécules glucose-6-phosphate pour trois molécules ribulose-5-phosphate sont décomposées oxydativement, avec six molécules NADPH. La ribulose 5-phosphate est ensuite convertie en cinq molécules via diverses réactions. Deux molécules sont utilisées, mais GAP est métabolisé dans le nouvel épisode de glycolyse à Pyruvat. Cela crée deux molécules ATP et une molécule NADH par molécule de Pyruvat.
Dans le bilan global Résultats:
La disponibilité du substrat dans la partie non oxydante du chemin du phosphate de pentose est contrôlée via des dieux en flux et des besoins métaboliques de la cellule (voir les variations de la section). Dans la partie oxydative du chemin, le glucose-6 phosphate déshydrogénase comme enzyme clé est la principale régulation. [7] En revanche, le NADP est + Un activateur allostérique de la déshydrogénase. [5]
Les enzymes du chemin du phosphate de pentose sont disponibles dans le cytoplasme de presque toutes les cellules. Étant donné que NADPH est nécessaire pour la synthèse des acides gras et des stéroïdes, le chemin PP a lieu en particulier dans les cellules hépatiques (synthèse des acides gras et du cholestérol) et dans le tissu adipeux (synthèse d’acide gras). D’autres tissus dans lesquels les acides gras et les stéroïdes sont synthétisés nécessitent également le NADPH et donc le chemin du phosphate de pentose. Ce sont, par exemple, le sein féminin produisant du lait ( Glande mammaire ), les testicules, l’ovaire et le cortex surrénal (synthèse des stéroïdes). [8] [9]
Dans les cellules musculaires, cependant, les enzymes de ce métabolisme sont largement manquantes. En effet, le phosphate de glucose-6 dans la glycolyse et le cycle des citratz est métabolisé pour la production d’énergie.
Dépendance des érythrocytes sur le chemin du phosphate de pentose [ Modifier | Modifier le texte source ]]

Les érythrocytes représentent une caractéristique spéciale car elles dépendent complètement du chemin du phosphate de pentose. Pour eux, c’est la seule façon qui peut être utilisée pour créer des agents réducteurs sous la forme de NADPH.
Il existe un risque de dommages oxydatifs causés par les espèces réactives de l’oxygène (ROS). Les érythrocytes sont particulièrement à risque du transport de l’oxygène. ROS, par exemple le peroxyde d’hydrogène (h 2 O 2 ), Dommage les protéines, l’ADN et les lipides de la paroi cellulaire. [4] Soit c’est h 2 O 2 La division de l’eau et de l’oxygène par une catalase, ou des dommages oxydatifs sont minimisés en rendant les ROS de glutathion inoffensifs. Une glutathion peroxydase peut réduire les peroxydes (voir illustration) en oxydant deux molécules glutathion. NADPH sert d’agent réducteur protecteur car il régénère le glutathion. Ceci est catalysé par la glutathion réductase (GSR).
Chez les personnes atteintes d’un défaut dans le glucose 6-phosphate déshydrogénase (G6PDH), les érythrocytes d’un stress oxydatif accru sont exposés, car contrairement à d’autres tissus, ils n’expriment pas de phosphate déshydrogénase hexulose-6, de sorte qu’un défaut présente un chemin du pentosphate affect radicalement. Il y a trop peu de NADPH, de sorte que plus de dommages oxydatifs, par exemple dans la membrane, sont créés. La carence en G6PDH entraîne donc une anémie hémolytique. [3]
D’un autre côté, les personnes ayant un défaut G6PDH ont accru la protection contre le paludisme. Le germe Plasmodium falciparum augmente dans les érythrocytes, mais est très sensible au stress oxydatif. Cela conduit à un avantage de sélection: une carence en G6PDH est courante dans les zones, où le paludisme se produit souvent. [4]
Les érythrocytes n’ont pas de noyau cellulaire et pas de mitochondries. Cela signifie que vous ne pouvez ni faire fonctionner un cycle Citratz et vous n’avez pas besoin de phosphate ribose 5 pour créer de l’ADN et de l’ARN. Vous pouvez donc créer suffisamment d’antioxydants avec la branche oxydative seule. D’une part, cependant, cela prive le glucose, d’une part, d’autre part, d’autre part, un problème osmotique proviendrait bientôt de la pentose. La branche non oxydante, cependant, est mise en œuvre par deux molécules xylose-5-phosphate et une molécule ribose 5-phosphate dans la glycérinaldéhyde-3-phosphate et deux molécules frucules-phosphate. Ces produits peuvent utiliser les érythrocytes en glycolyse pour générer de l’énergie (voir la section ci-dessus).
- Reginald Garrett, Charles M. Grisham: Biochimie (International Student Edition). 3. Édition. Thomsom Learning, 2005, ISBN 0-534-41020-0, pp. 725–735
- Thomas M. Devlin (HRSG.): Manuel de biochimie avec corrélations cliniques . 6. Édition. Wiley & Sons, 2005, ISBN 978-0-471-67808-3, pp. 638–643
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn et Carsten Biele (traducteur): Biochimie . 4. Édition mise à jour. Pearson Studium, 2008, ISBN 978-3-8273-7312-0, pp. 490–496
- Werner Müller-Ender: Biochimie, une introduction aux médecins et aux scientifiques . Spectrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3, pp. 522–527.
- Albert Lehninger, Michael Cox, David L. Nelson: Principes de lehninger de la biochimie . 5e édition. W H Freeman & Co, 2008, ISBN 978-7167-7108-1, pp. 558–563
- ↑ Ici, dans le sens de «l’entrée transversale» des produits à la glycolyse.
- ↑ David Nelson, Michael Cox: Lehninger Biochemie . 4e, complet sur -Le -arb. u. Erw. Édition. Springer, Berlin 2009, ISBN 978-3-540-68637-8, p. 1076.
- ↑ un b c d H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn et Carsten Biele (traducteur): Biochimie . 4. Édition mise à jour. Pearson Studium, 2008, ISBN 978-3-8273-7312-0, pp. 490–496.
- ↑ un b c d Albert Lehninger, Michael Cox, David L. Nelson: Principes de lehninger de la biochimie . 5e édition. W H Freeman & Co, 2008, ISBN 978-7167-7108-1, pp. 558–563.
- ↑ un b c Werner Müller-Ender: Biochimie, une introduction aux médecins et aux scientifiques . Spectrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3, pp. 522–527.
- ↑ La biochimie et la pathobiochimie de Karlson . ISBN 978-3-13-357815-8, P. 258.
- ↑ Reginald Garrett, Charles M. Grisham: Biochimie (International Student Edition). 3. Édition. Thomsom Learning, 2005, ISBN 0-534-41020-0, pp. 725–735.
- ↑ Thomas M. Devlin (HRSG.): Manuel de biochimie avec corrélations cliniques . 6. Édition. Wiley & Sons, 2005, ISBN 978-0-471-67808-3, pp. 638–643.
- ↑ Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Biochimie . 6. Édition. Spectrum Akademischer Verlag, 2007, ISBN 978-3-8274-1800-5, p. 650.














Recent Comments