Bortezomib – Wikipedia
| Formule structurelle | |
|---|---|
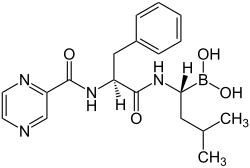 |
|
| Général | |
| Nom de frein | Bortézomib |
| Autres noms |
|
| Formule de purée | C 19 H 25 BN 4 O 4 |
| Identificateurs / bases de données externes | |
| Médicament | |
| Code ATC |
L01 Xg01 |
| Classe d’ingrédients active |
Inhibiteur du protéasom |
| Caractéristiques | |
| Masses molaires | 384.24 g · mol −1 |
| consignes de sécurité | |
| Dans la mesure du possible et commun, des unités SI sont utilisées. Sauf indication contraire, les données fournies s’appliquent aux conditions standard. | |
Bortézomib est un médicament approuvé pour la thérapie du myélome multiple (plasmocytome). Le bortezomib est le premier représentant d’une nouvelle classe d’ingrédients actifs, les inhibiteurs du protéasom, et est une préparation d’injection sous la marque Vecade Aux États-Unis de Millennium Pharmaceuticals, une filiale de Takeda Pharma, et en Allemagne par Janssen-Cilag, une filiale de Johnson & Johnson.
Bortezomib est dans l’UE depuis le 26 avril 2004 [2] Approuvé pour la monothérapie pour le traitement du myélome multiplem progressif chez les patients qui ont subi au moins une thérapie précédente et qui ont déjà subi une greffe de moelle osseuse ou qui ne conviennent pas à une greffe de moelle osseuse. [3] [4]
Depuis le 28 août 2008 [5] Est le bortézomib en combinaison avec le melphalan et la prednison pour le traitement des patients adultes atteints de myélome multiplem non traité qui ne conviennent pas à une chimiothérapie à haute dose avec greffe de moelle osseuse.
Le bortézomib peut également être utilisé avec d’autres médicaments pour traiter le myélome multiple non traité auparavant. En 2019, Piechotta et al. Présentation de Cochrane fonctionne avec une méta-analyse du réseau d’études contrôlées randomisées réalisées afin de comparer la sécurité et l’efficacité de plusieurs combinaisons de médicaments pour les adultes avec un myélome multiple nouvellement diagnostiqué et non traité. Les participants à l’étude devaient être âgés de plus de 65 ans ou n’étaient pas adaptés à la transplantation de cellules souches ou à un traitement à forte dose s’ils avaient entre 18 et 65 ans. Le bortézomib a été évalué dans les combinaisons suivantes: bortézomib plus melphalan et prednison et bortézomib plus entenalidomide plus dexaméthasone. Si possible, ces combinaisons ont été comparées à Melphalan plus Prednison, car cette combinaison représente une thérapie avec le risque médian. Les résultats suivants ont été montrés: l’administration continue de bortézomib plus lenalidomide plus dexaméthasone provoque probablement une augmentation de la survie globale. Le bortézomib plus le melphalan et la prednison peuvent provoquer une forte extension de la survie globale. Le bortézomib plus le melphalan et la prednison et l’administration continue de bortézomib plus lénalidomide plus dexaméthasone peuvent provoquer une forte extension de la survie sans progression. Le bortézomib plus le melphalan et la prednison conduisent probablement à une augmentation prononcée du risque de polyneuropathies. L’autre médicament n’a pas été comparé ici. L’administration de bortézomib plus melphalan et prednison provoque probablement une augmentation des événements sévères indésirables. L’autre médicament n’a pas été comparé ici. L’administration continue de bortézomib plus lenalidomide plus dexaméthasone provoque une augmentation prononcée de la démolition de l’étude de la part du patient en raison d’événements indésirables. L’administration de bortézomib plus melphalan et prednison provoque probablement une faible augmentation de la fin de l’étude par les patients en raison d’événements indésirables. [6]
Le bortézomib est testé dans des études cliniques pour d’autres indications, comme pour d’autres formes hématologiques de cancer et de tumeurs solides. Dans le même temps, l’efficacité du colon, du poumon, du pancréatique, du sein, du cancer de la prostate et de l’ovaire et du lymphome non hodgkinien est vérifiée. [7] De plus, le tissu est utilisé dans le traitement expérimental de l’encéphalite des récepteurs anti-NMDA.
L’ingrédient actif est disponible sous forme de poudre séchée au congélateur sous la forme d’un testeur d’un homme avec le groupe d’acide boronique et doit être dissous à des fins d’injection avant d’administrer dans une solution saline. Après la préparation, le Mannitolester est en équilibre avec son produit d’hydrolyse. [8]
Le bortézomib est injecté par voie intraveineuse ou par voie sous-cutanée, la dose recommandée est de 1,3 mg par m 2 Surface corporelle. Pour la prévention, un remède peut être administré pour les nausées puis rincé avec une solution saline (environ 50 ml). Un contrôle de la numération sanguine avant chaque injection est recommandé. Par exemple, le nombre de plaquettes, le nombre de leucocytes et la valeur de l’hémoglobine doivent être surveillés. Les trois valeurs peuvent diminuer pendant la thérapie. La durée du traitement dépend de la réponse de la maladie, plus de 8 cycles ne sont généralement pas donnés. Dans l’étude du sommet, tous les patients chez qui la maladie ne progressaient pas et qui n’ont eu aucun effet secondaire grave ont été traités avec 8 cycles. [2]
Les protéasomes jouent un rôle important dans la réduction des protéines qui régulent le cycle cellulaire et donc la croissance cellulaire. L’effet du bortézomib est basé sur le blocage des voies métaboliques des cellules cancéreuses, qui se caractérisent par une croissance incontrôlée. S’il y a un blocage du protéasome, les processus de protéolyse vitaux sont supprimés. [7]
Cela signifie que de nombreux signaux dans la cellule cancéreuse s’annulent ou se préagissent. En conséquence, cela conduit à
- Inhibition de la croissance tumorale
- Inhibition de l’angiogenèse (formation de nouveaux vaisseaux sanguins pour fournir la tumeur)
- Apoptose des cellules cancéreuses (mort cellulaire programmée des cellules cancéreuses précédemment “immortelles”)
- Inhibition de l’interaction avec les cellules du tissu conjonctif de la moelle osseuse. [2]
Les cellules saines sont également affectées par la thérapie. Cependant, il a été constaté que, contrairement aux cellules cancéreuses, ces cellules se régénèrent lorsque le traitement est interrompu pendant dix jours après 4 injections les jours 1, 4, 8 et 11. De toute évidence, les cellules cancéreuses dépendent particulièrement de la fonction des protéasomes et réagissent donc plus sensibles à leur inhibition que les cellules normales. [2] Le boratome du bortézomib se lie à la fonction catalytique du protéasome 26S avec une affinité élevée et une sélectivité en tant que ligand.
Une liaison hautement spécifique et vif de la bore à la zone catalytique du protéasome 26S, qui est inhibée. [9]
Le myélome multiple (plasmocytome) a jusqu’à présent été considéré comme traitable, mais en phase terminale. Le bortézomib ne peut pas provoquer de guérison, mais est une autre alternative pour les patients chez qui au moins une thérapie a déjà échoué.
Après une administration intraveineuse unique, les concentrations plasmatiques de bortézomib diminuent le biphasique. L’acceptation est caractérisée par une phase de distribution rapide, suivie d’une phase d’élimination terminale plus lente. Chez l’homme, la demi-vie de 5 à 15 heures est. In vitro Les enzymes du cytochrome CYP3A4 et CYP2C19 ont été identifiées comme les principales enzymes de métabolisation. Seule une petite proportion de la substance de départ non métabolisée a été détectée dans l’urine, tandis qu’aucun bortézomib intact n’a été trouvé dans la bile ou les fèces. [8]
L’effet secondaire le plus important, qui limite essentiellement le traitement par le bortézomib, est la neuropathie périphérique, un trouble nerveux avec douleur et engourdissement, en particulier sur les mains ou les pieds. Cet effet secondaire est difficile à influencer thérapeutiquement et peut affecter gravement le patient. Selon la littérature, jusqu’à 70% des patients sont affectés et l’expression peut être difficile à très difficile (degré III-IV selon l’OMS) et conduire à l’immobilité complète des patients. Dans ces cas, la qualité de vie des patients est très importante et limitée au cours des mois. En règle générale, la neuropathie se reflète [dix] Mais peut durer très longtemps.
Une étude a montré que la neuropathie périphérique s’est produite beaucoup moins fréquemment lorsque le bortézomib a été administré par voie sous-cutanée à la place par voie intraveineuse, [11] Par conséquent, cette forme de demande a été approuvée par la Commission de l’UE en septembre 2012.
D’autres effets secondaires, tels que l’humiliation des valeurs de cellules sanguines (voir ci-dessus), les nausées, la diarrhée et la fatigue (épuisement grave) peuvent survenir.
Au Royaume-Uni, le bortézomib provoque des coûts de thérapie de 18 000 GBP par an et les patients. Bien que le médicament en études cliniques a prolongé la vie de plusieurs mois, le State British Health Service (NHS) a rejeté un coût des coûts dans un premier projet. Le Institut national de santé et d’excellence clinique (Nice) vérifie la rentabilité des nouvelles thérapies pour le NHS. Un critère est les coûts qui sont en bonne qualité de vie pour gagner une année de vie ( Années de vie ajustées sur la qualité , Qaly). Une valeur inférieure à 30 000 GBP par QALY est souvent nécessaire.
Après plusieurs mois de négociations avec le fabricant, le NHS a ensuite fait la promesse suivante en 2007: lors d’une suggestion du fabricant, tous les patients, pour lesquels Bortezomibi sont indiqués, devraient initialement recevoir le médicament via un maximum de quatre cycles. Si une rémission du myélome multiple est obtenue pendant cette période, la thérapie se poursuit au détriment du NHS. Si aucune rémission n’est obtenue, la thérapie est annulée et le NHS n’a pas à payer le médicament utilisé. [douzième]
En fait, cela signifie que le NHS n’a qu’à payer pour la thérapie dans laquelle le médicament a fonctionné.
Le bortézomib est disponible en Allemagne, en Autriche et en Suisse sous le nom de Velcade.
- P. G. Richardson U. un.: Bortézomib ou dexaméthasone à forte dose pour le myélome multiple rechuté. Dans: Nejm. 352, 2005, S. 2546–2549. PMID 15958804
- P. G. Richardson U. un.: Bortézomib dans le traitement de première ligne du myélome multiple. Dans: Expert Rev Anticancer Ther. 8, 2008, S. 1053–1072. PMID 18588451
- P. G. Richardson U. un.: Suivi prolongé d’un essai de phase 3 dans le myélome multiple en rechute: résultats finaux de temps à événement de l’essai APEX. Dans: Sang. 110 (10), 15 novembre. Nov 2007, P. 3557-35660. EPUB 2007 9 août. PMID 17690257
- J. F. San Miguel U. pour.: Bortezomib plus melphalan et prednisone pour le traitement initial du myélome multiple. Dans: N Engl J avec. 359 (9), 28. août 2008, S. 906–917. Deux: 10.1056 / nejmoa0801479 . PMID 18753647
- J. F. San Miguel U. pour.: Le bénéfice de survie global persistant et aucun risque accru de seconde tumeurs malignes avec le bortézomib-melphalan-prédnisone contre le melphalan-prédnisone chez les patients présentant un myélome multiple non traité. Dans: Journal of Clinical Oncology. Band 31, numéro 4, février 2013, pp. 448–455, doi: 10.1200 / JCO.2012.41.6180 , PMID 23233713 .
- ↑ un b Fiche de données Bortézomib à Alfaaesar, consulté le 29 mai 2022 ( Pdf ) (JavaScript requis) .
- ↑ un b c d myelom.at: Velcade® – Bortezomib ingrédient actif. ( Mémento à partir du 8 août 2007 Archives Internet ) Consulté le 27 juin 2007.
- ↑ Medknowledge.de: Le bortézomib (Velcade®) a approuvé le myélome multiples (plasmocytome). ( Mémento du 5 septembre 2007 Archives Internet ) Consulté le 27 juin 2007.
- ↑ Vecade / bortezomib (PDF; 89 Ko). EMA (CHMP), Résumé de l’EPAR pour le public, consulté le 20 février 2013.
- ↑ ema.europa.eu: Velcade® – Bortezomib ingrédient actif. (PDF; 310 Ko). Consulté le 3 janvier 2013.
- ↑ Vanessa Piechotta, Tina Jakob, Peter Langer, Ina Monsef, Christof Scheid: Plusieurs combinaisons de médicaments de bortézomib, de lénalidomide et de thalidomide pour un traitement de première ligne chez les adultes atteints de myélome multiple inéligible en greffe: une méta-analyse du réseau . Dans: Base de données Cochrane des revues systématiques . 25 novembre 2019, doi: 10.1002 / 14651858.CD013487 ( wiley.com [Consulté le 16 juillet 2020]).
- ↑ un b Current Öaz: Bortezomib. ( Mémento du 20 février 2007 Archives Internet ) Consulté le 27 juin 2007.
- ↑ un b Nouveaux médicaments – Bortezomib. Dans: Journal pharmaceutique. Consulté le 27 juin 2007.
- ↑ P. Bonvini, E. Zorzi, G. Basso, A. Roselis: L’inhibition du protéasome médiée par le bortézomib provoque un arrêt du cycle cellulaire et induit l’apoptose dans le lymphome à grande cellule CD-30 + anaplasique Leukemia 2007, volume 21, numéro 4, pages 838–42, PMID 17268529 , Deux: 10.1038 / sj.leu.2404528 .
- ↑ P. G. Richardson, H. Briemberg, S. Jagannath, P. Y. Ya, B. Barlogie, J. Berenson, S. Singhal, D. S. Sieel, D. Irwin, M. Schuster, G. Srkalovic, R. V. AN, D. Esseltine, K. C. Anderson, A. A. Amato: Fréquence, caractéristiques et réversibilité de la neuropathie périphérique lors du traitement du myélome multiple avancé avec le bortézomib. Dans: Journal of Clinical Oncology. 24, 2006, S. 3113–3120, PMID 16754936 .
- ↑ P. Moreau, H. Pylypenko, S. Grosicki, I. Karamanesht, X. Leleu, M. Grishunina, G. Rekhtman, Z. Masliak, T. Robak, A. Shubina, B. Arnulf, M. Kropff, J … Administration sous-cutanée et intraveineuse de bortézomib chez les patients atteints de myélome multiple en rechute: une étude randomisée, de phase 3, non inférieure. Dans: Lancet Oncol. 12 (5), 2011, S. 431–440, Deux: 10.1016 / S1470-2045 (11) 70081-X , PMID 21507715 .
- ↑ Nice: le médicament contre le cancer ne doit être payé que si cela fonctionne. ( Mémento des Originaux à partir du 17 mars 2016 Archives Internet ) Info: Le lien d’archive a été utilisé automatiquement et non encore vérifié. Veuillez vérifier le lien d’origine et d’archiver en fonction des instructions, puis supprimez cette note. Dans: aerzteblatt.de , 5 juin 2007, consulté le 7 mai 2010.
Recent Comments