ADN-Polymerasen-Wikipedia
ADN-polymérasen sont des enzymes qui catalysent la synthèse de l’ADN à partir de desoxyribonucléotides comme polymérase. Les ADN polymérases jouent un rôle clé dans la réplication de l’ADN.
Activité polymérase [ Modifier | Modifier le texte source ]]
La polymérase permet la liaison chimique des molécules individuelles (monomères) à une chaîne (polymère). Dans le cas de l’ADN polymérase, le polymère formé est l’acide désoxyribonucléique (ADN), en tant que monomères, désoxyribonucléotides, plus précisément désoxy-nucléoside triphosphate (DNTP). L’ADN polymérase dépendante de l’ADN utilise toujours un brin individuel d’ADN existant comme matrice (matrice) pour la synthèse d’un nouveau brin complémentaire, dont la séquence nucléotidique est ainsi déterminée par la matrice. Cette préservation de la séquence d’ADN est cruciale pour la capacité de l’ADN polymérase à copier les informations génétiques codées dans l’ADN. La copie correcte de la matrice est réussie grâce à un appariement de base complémentaire des bases nucléotidiques intégrées avec les bases des matrices d’ADN, transmises par des ponts d’hydrogène. La synthèse du nouveau brin d’ADN se déroule du 5′- à l’extrémité 3 ‘. D’un point de vue chimique, une attaque nucléophile du groupe 3’-hydroxy terminal du brin d’ADN se déroule sur le α-phosphate des DNTP, le pyrophosphate étant libéré. Cette étape est catalysée par la polymérase.
Contrairement aux ARN polymérases, la synthèse du brin d’ADN complémentaire dans l’ADN polymérases ne peut être effectuée que si la polymérase est disponible une extrémité 3′-hydroxy libre. Le premier nucléotide est ensuite attaché à cela. Dans la réaction en chaîne par polymérase (PCR), vous utilisez un brin individuel d’ADN long d’ADN environ 15 à 20 (amorce), ce qui sert de point de départ de la réaction. Les ADN polymérases ont généralement besoin d’ions de magnésium en tant que co-facteur.
La catalyse de la formation de la liaison alimentaire est fonctionnellement analogue à la réaction correspondante des ARN polymérases. Le dernier nucléotide de la section déjà synthétisée et le nucléotide à placer sont coordonnés dans l’un des deux ions de magnésium dans le centre catalytique du tomana de polymères. Le premier groupe phosphate du nucléotide à placer est coordonné dans les deux ions magnésium. L’emplacement spatial permet une attaque par le groupe hydroxy du nucléotide précédent au groupe phosphate de celui. Un pyrophosphate est divisé.
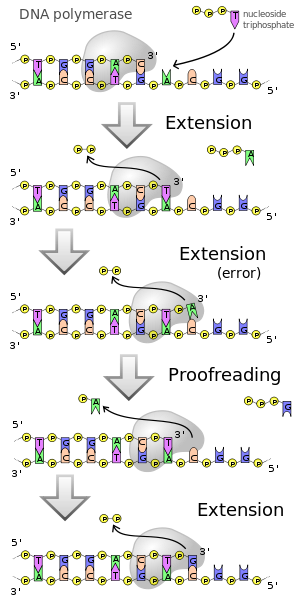
Activité d’exonucléase [ Modifier | Modifier le texte source ]]
De nombreux nez en polymère ont également d’autres fonctions enzymatiques. En présence de faibles concentrations sur les DNTP, le Activité de 3 ‘→ 5’-exonucléase pour éliminer les nucléotides. Certaines polymérases en ont également une Activité 5 ‘→ 3’-exonucléase . Afin de s’assurer qu’il n’y a pas d’erreurs lors de la lecture des matrices d’ADN, ils ont ceci Fonction de lecture de correction (Engl. lecture de preuve ), d. Autrement dit, ils sont capables d’identifier l’installation d’un nucléotide inapproprié, puis de le retirer de l’ADN par l’activité d’exonucléase. Cela permet le démantèlement d’un ADN ou d’un brin d’ARN existant, qui est déjà associé au brin de matriculation, tandis qu’un nouveau brin est formé. Il en résulte un échange de l’ancien brin contre un nouveau brin. Cette activité d’exonucléase est utilisée dans la méthode de Traduction de Nick exploité.
Dans les bactéries, comme Escherichia coli Il y en a trois différents ADN polymérases dépendantes de l’ADN . L’un d’eux qui ADN-polymérase I (Pole I) a été isolé par Arthur Kornberg en 1955 et a été la première polymérase jamais découverte. Cependant, ce n’est pas la polymérase la plus importante pour la réplication dans E. coli , car il ne catalyse qu’environ 20 étapes de synthèse (c’est-à-dire qu’elle n’a qu’une faible procédés). Cependant, il est responsable de la réplication de la construction des panneaux d’amorce à travers son activité d’exonucléase de 5 ‘→ 3’. ADN-polymérase II et ADN-polymérase III , les deux autres ADN polymérases en E. coli , seulement 15 ans après la découverte de l’ADN polymérase I a été isolée après E. coli -Mutant avec défaut dans la polymérase, je me suis néanmoins révélé être une réplication -Petente. Cependant, ces mutants étaient particulièrement sensibles au rayonnement UV et aux substances alkylants, c’est pourquoi il est supposé que l’ADN polymérase I prend principalement les tâches de réparation. La polymérase III, qui E. coli La réplication réelle effectue un total de sept sous-unités et ne se produit que dans très peu de copies par cellule bactérienne.
L’ADN polymérases eucaryotes est classée dans les familles suivantes:
- Famille A: ADN polymérases γ, θ et ν
- Familie B: DNA-PolymeraSen A, D, E und Z
- Familie X: ADN-polymérasen B, L, σ und M
- Famille Y: ADN polymérases η, ι et κ
La polymérase γ ne se produit que dans les mitochondries.
Seules cinq ADN polymérases se produisent dans les Mugars: α, β, γ, δ et ε. On pense que les polymérases Δ et ε qui sont décisives pour la réplication, qui sont dues à une fonction de lecture de procétivité et de correction élevée ( lecture de preuve ). Les polymérases α et β, en revanche, ne montrent que une faible processeur et aucune fonction de repeuplement.
Il existe en outre ADN polymérases dépendantes de l’ARN qui utilisent l’ARN comme matrice et y attachent DNTP. Ceux-ci s’appellent-eux-mêmes transcriptase inversée, qui comprend également la télomérase. Comme ADN polymérase indépendante est le seul connu de la désoxyribonucléotidyltransférase terminale.
Il existe des ADN polymérases stables dans les archébactéries, qui sont également utilisées pour la PCR.
Les complexes d’ADN polymérase ne sont pas connus dans les complexes de traitement de l’ADN polymérase 3 ‘→ 5’. Une extension du brin d’ADN dans ce sens nécessiterait l’hydrolyse du triphosphate nucléoside précédemment attaché. En principe, cela est possible, mais conduit à un problème en ce qui concerne une fonction de correction supplémentaire ( relecture ). Après la réaction d’une exonucléase, aucun groupe triphosphate ne resterait à la fin, mais seulement un simple groupe de phosphate, ce qui empêcherait l’extension supplémentaire du brin. Le mécanisme de réaction hypothétique suivant peut illustrer ceci: [d’abord] 
Les ADN polymérases sont d’une importance centrale pour la réplication de l’ADN. Ils permettent aux fidèles de copier les informations génétiques sous forme d’ADN, donc une étape décisive de l’augmentation et de la reproduction des êtres vivants. Les ADN polymérases jouent également un rôle important dans les processus associés à la réparation de l’ADN.
En laboratoire, les ADN polymérases sont souvent utilisées pour la réaction en chaîne par polymérase et les méthodes connexes (par exemple RT-PCR, qPCR), dans la traduction de Nick, l’amorçage aléatoire et dans le séquençage de l’ADN. Une variété de différentes ADN polymérases thermostables, partiellement modifiées par l’ingénierie des protéines, sont utilisées (par exemple Taq polymérase). En plus de la stabilité à haute température, l’origine thermostable de l’ADN polymérase archaei, telle que la PFU polymérase, apporte une fonction de lecture de correction ( lecture de preuve ) avec parce que la PCR ne doit pas modifier l’ADN généré. De plus, les ADN polymérases telles que l’ADN polymérase φ29 sont utilisées dans diverses méthodes d’amplification isotherme de l’ADN à température ambiante. Le précurseur des ADN polymérases utilisés aujourd’hui était l’ADN polymérase T4.
- Lehninger; David Nelson, Michael Cox: Lehninger Biochemie. 3e édition, Springer-Verlag, Berlin Heidelberg 2001, ISBN 3-540-41813-X
- Wilhelm Seyffert: Manuel de génétique. 2e édition, Spektrum Akademischer Verlag Heidelberg, Berlin 2003, ISBN 3-8274-1022-3
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochimie 6e édition, Springer-Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5
- ↑ Donald Voet: Biochimie . 4e édition édition. John Wiley & Sons, Hoboken, NJ 2011, ISBN 978-0-470-57095-1, S. 1201 .
Recent Comments