Azole – Wikipedia

Azole , familièrement aussi Pyrrole , sont un groupe de composés chimiques hétérocycliques. Il existe des composés hétéroaromatiques contenant cinq membres de l’azote, dont le connexion régulière est le pyrrol. L’hydrogénation formelle d’une double liaison donne à la pyrroline, l’hydrogénation formelle des deux doubles liaisons conduit aux pyrrolidines.
Les azole sont des composés aromatiques. Cinq structures de frontières mésomères peuvent être formulées. L’azole répond aux critères de Hückel par la participation de la paire d’électrons libres de l’atome d’azote. En ce qui concerne leur aromaticité, ils se trouvent entre les thiophistes les plus aromatiques et les oxols pratiquement plus aromatiques. [d’abord]

L’azole a un caractère de base en raison de la paire d’électrons libres de l’atome d’azote.
Des substitutions aromatiques électrophiles peuvent être effectuées sur des azoles. En raison de la meilleure stabilisation des stades intermédiaires de cette réaction, ceux-ci se produisent de préférence en 2 positions. Cependant, ils ne sont pas stables contre les acides Lewis. [d’abord] Ceux-ci coordonnent l’hétérootome et conduisent à l’ouverture de l’anneau.
Les azole sont parmi les inhibiteurs de la synthèse de l’ergostérine. Ils travaillent en inhibant la lanostérale microsomale déméthylase. Ceci est suivi d’une inhibition de la mise en œuvre de la lanostérale dans Ergoster. [2]
L’azole peut être produit par une synthèse de paal-knorr des dicarbonyles tels que les dikétons ou l’hydratation du dialan et l’ammoniac. [3]

Une autre option de synthèse est la synthèse de Knorr-Pyrrol, à laquelle l’aldéhyde et les α-aminocétones sont nécessaires. [4]

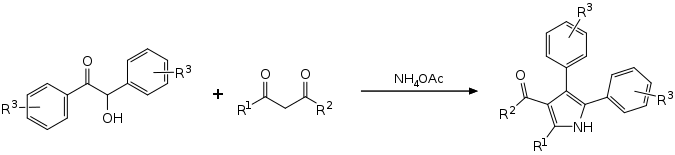
Une réaction au ragoût avec des benzoinins substitués, des composés de 1,3 dicarbonyle et de l’acétate d’ammonium conduit à des pyrroles substitués par tétras sans solvant et catalyseur. [5] [6]
Pyrrol représente non seulement la connexion régulière pour les azoles, d’autres groupes de tissus hétérocycliques sont également dérivés de cette structure. Cela comprend les pyrazoles et les imidazoles qui ont deux atomes d’azote. Avec trois atomes d’azote, le triazole et quatre sont connus du tétrazole. Les azoles avec différents types d’hétéroatomes incluent les oxazoles et le thiazole.
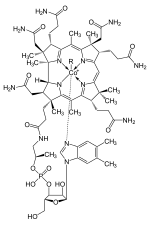
Comme la plupart des composés hétérocycliques, le pyrrole se produit dans de nombreuses substances naturelles. Ceux-ci incluent, par exemple, la porphyrine, qui forment la base de la malveillance. Ils apparaissent également dans d’autres composés macrocycliques naturels tels que Corrin.
Les azole sont contenus comme des fragments dans de nombreux ingrédients actifs. Dans les plastiques, par exemple, l’azole apparaît dans les polypyrroles. Les antifongiques plus jeunes du groupe d’inhibiteurs de la biosynthèse de l’ergostérale sont également parmi les azoles.
Azole a réalisé un tiers de tous les antifongiques vendus pour une utilisation dans le secteur agricole en 2013. L’utilisation massive des azoles dans l’agriculture est soupçonnée d’être responsable du développement d’un tronc résistant d’Aspergillus et peut-être aussi du développement de Candida Auris, qui était dangereux pour la première fois, pour la première fois. [7]
- ↑ un b D. T. Davies: Textes de base chimie: hétérocycles aromatiques , 1ère édition, pp. 10–34, Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6.
- ↑ Microbiologie médicale . 7e édition. Georg Thieme Verlag, Stuttgart 2019, ISBN 978-3-13-242355-8, doi: 10.1055 / B-006-163249 ( thieme.de [Consulté le 26 août 2020]).
- ↑ L. Knorr: Effet de l’ester d’acide de diacetbernstein sur l’ammoniac et les bases d’amin primaires , dans: Le Ber. DTSCH. Chem. Ges. 1885 , 18 , 299–311; est ce que je: 10.1002 / cber.18850180154
- ↑ L. Knorr: Synthèse de pyrrolérivats , dans Le Ber. DTSCH. Chem. Ges. 1884 , 17 , 1635–1642; est ce que je: 10.1002 / cber.18840170220 .
- ↑ Bhat, S.I.; Trivedi, D.R.: Une réaction à trois composants sans catalyseur et sans solvant pour l’accès régiosélectif à un pot aux pyrroles polyfonctionnalisées Dans Tetrahedron Lett. 54 (2013) 5577–5582, doi: 10.1016 / j.tetlet.2013.07.153 .
- ↑ E-EROS Encyclopedia of Reagents for Organic Synthesis, 1999-2013, John Wiley and Sons, Inc., entrée pour l’acétate d’ammonium, accessible sur 17 février 2018 .
- ↑ Matt Richtel und Andrew Jacobs: “Une infection mystérieuse, couvrant le globe dans un climat de secret” New York Times Vom 6. avril 2018.
Recent Comments