β-oxydation – Wikipedia

Quand β-oxydation L’un fait référence au mécanisme de dégradation biochimique des acides gras. Le nom fait référence aux oxydations qui se déroulent sur l’atome β-C de l’acide gras. La β-oxydation était autrefois Piral d’acide gras désigné.
La β-oxydation a été découverte par Franz Knoop à Freiburg en 1904. Ce n’est que 50 ans plus tard que le mécanisme exact de ce chemin métabolique a été informé. Dans les cellules animales, la β-oxydation est principalement dans les mitochondries, pour les cellules végétales dans les glyoxysomes.
Les protéines des gènes suivantes sont impliquées dans la β-oxydation: CPT1A, CPT1B, CPT1C, CPT2, HSD17B4, ECH1, HADHA, HADHB, ECHT1, EHHADH, ECI1, HADH, CROT. [d’abord]
Avant que la β-oxydation réelle ne puisse commencer, les lipides autrement réactionnels doivent d’abord être “activés” dans le cytosol puis transportés du cytosol à la matrice des mitochondries, où la β-oxydation a lieu.
Activation de l’acide gras [ Modifier | Modifier le texte source ]]
Le but de l’activation est la formation de l’acyl-CoA en transférant l’acide gras vers la coenzyme A. Cela crée une liaison thioester riche en énergie, ce qui permet les étapes de réaction supplémentaires.
Dans la première étape, l’ATP est divisé en pyrophosphate et AMP, qui est utilisé directement pour former l’AMP acyle (également: acyl-adénylate). Parallèlement à la division du pyrophosphate dans un phosphate simple par une pyrophosphatase, l’acide gras peut être estimé avec une coenzyme A avec une coenzyme en division de l’ampli.
La forme d’acide gras activé de cette manière est appelée acyl-CoA. Les deux réactions sont catalysées par une ligue COA d’acide gras.
Transport vers la matrice mitochondriale [ Modifier | Modifier le texte source ]]
Ensuite, le groupe acyle est transféré à la carnitine par le noyau confortable de la coenzyme A par l’enzyme carnitine-acyltransférase I et transportée activement vers la matrice des mitochondries. Ce processus est catalysé par le transporteur de carnitine acylcarnitine (CACT), qui dans l’antopold acyl carnitine dans la matrice mitochondriale et favorise en même temps la carnitine. Dans la matrice, le repos acyle est remplacé par la carnitine par la carnitine acyltransférase II et transféré à la coenzyme A. Bien que l’acide gras activé soit désormais disponible pour le démantèlement, la carnitine est à nouveau exportée vers le cytosol par le CACT. L’activation de l’acyl-CoA n’est pas réversible: un acide gras activé est décomposé.
Selon le type d’acide gras (nombre d’atomes C, l’emplacement et la configuration de toute double liaison), l’évolution de la dégradation peut différer de celle des acides gras saturés rigides, car des réactions supplémentaires peuvent être nécessaires pour créer des substrats appropriés pour les enzymes de la β-oxydation ou parce que d’autres sont considérés comme acétyl-CoA.
Réduction des beaux acides gras saturés [ Modifier | Modifier le texte source ]]
Le démantèlement réel peut être divisé en quatre étapes consécutives:
Oxydation dépendante de la mode [ Modifier | Modifier le texte source ]]

- Sur l’acyl-CoA, l’enzyme acyl coa déshydrogénase entre l’atome de carbone 2 (C est un ) et 3 (c b ) une double liaison trans trans. Ceci est inhabituel pour les acides gras insaturés, qui sont généralement disponibles dans la configuration CIS, mais nécessaire parce que l’enzyme de l’étape suivante, l’Enoyl-CoA hydratase, ne détecte que les acides gras dans la configuration trans. Ce processus devient également une fade de Fadh 2 réduit.
Hydratation [ Modifier | Modifier le texte source ]]
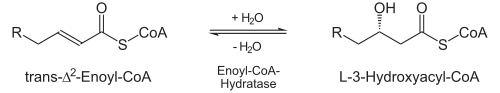
- L’enoyl-CoA hydratase ajoute de l’eau stéréo spécifique à la double liaison nouvellement créée, à savoir l’atome β-C. Cela crée du L-3-Hydroxyacyl COA (également: L-β-hydroxyacyl-CoA).
Ils + -Axydation [ Modifier | Modifier le texte source ]]

- Dans la réaction suivante, le C 3 -Groupe hydroxy à travers L -3 Hydroxyacyl CoA déshydrogénase (également: β-hydroxyacyl coa déshydrogénase) oxydée en groupe KET. Le cofacteur ici est NAD + qui absorbe les électrons émergents et donc au nadh + h + est réduite. Cette étape est l’éponyme de l’ensemble du mécanisme. Un exemple est la déshydratation du 2-hydroxystar au 2-oxostataret par la déshydrogénase d’acide gras 2-hydroxy.
Thiolyse [ Modifier | Modifier le texte source ]]

- Sous l’absorption d’une coenzyme A, l’enzyme 3-céto-thiolase divise l’acétyl-CoA (acide acétique activé), et une molécule d’acide gras raccourcie par deux atomes de carbone (sous forme d’acyl-CoA), qui peuvent être ramenés à la première étape.
- Cette séquence de réaction est répétée jusqu’à ce que deux acétyl-CoA restent.
Élimination des acides gras non repris [ Modifier | Modifier le texte source ]]

Le démantèlement de ces acides gras diffère de celui de la tige à compte du fait qu’à la fin, ce n’est pas de l’acétyl-CoA mais du propionyl-CoA. Ceci est maintenant en cours de reconstruction en plusieurs étapes pour succinyl-CoA, un métabolite du cycle des agrat.
À cette fin, le propionyl COA est initialement carboxylé sur l’atome α-C avec la division d’un ATP. Cette réaction est catalysée par la propionyl-CoA carboxylase, qui en tant que cofacteur biotine (vitamine B 7 ) contient. Il surgit ( S ) -Méthylmalmalonyl-coa, qui à l’étape suivante à travers la méthylmalonyl-coa racemase en ( R ) -Méthylmalmalonyl-CoA est converti. Enfin, le groupe carboxy est utilisé par la méthylmalononyl-coa mutase, la vitamine B douzième -To à base, transféré de l’atome α-C à l’atome de carbone du groupe méthyle, qui crée le succinyl-CoA, qui peut être fourni au cycle du citrate.
Élimination des acides gras insaturés [ Modifier | Modifier le texte source ]]
Étant donné que la plupart des doubles liaisons des acides gras insaturés naturels ont une configuration CIS, mais les enzymes de la β-oxydation n’acceptent que des substrats en configuration trans, ceux-ci doivent d’abord être convertis par des isomérases spécifiques.
Un autre problème est directement lié aux doubles liaisons suivantes (-ch = ch-ch = ch-). Celles-ci doivent être réduites de telle manière qu’une double liaison (-ch 2 -Ch = ch-ch 2 -) Il reste à reconnaître par les enzymes.
L’acétyl-CoA formé dans la β-oxydation peut être plus décomposé dans le cycle du citrate ou utilisé pour la synthèse des cétoculaires.
Dans le cas de l’exploitation minière, un FADH sera créé par tour de β-oxydation 2 Et un nadh + h + qui fournissent 1,5 ou 2,5 ATP via la chaîne respiratoire. Chaque acétyle COA qui est décomposé via le cycle des citrats permet également la synthèse de 10 ATP.
Par exemple, 106 molécules ATP peuvent être formées lorsqu’une molécule d’une molécule d’acide palmitique: l’acide palmitique contient 16 atomes de carbone et est donc décomposé en un total de huit acétyl-CoA, avec sept molécules fadh chacune 2 et nadh + h + être formé parce que le cycle est exécuté sept fois. Cependant, comme un ATP a été divisé sous hydrolyse de deux composés riches en énergie à AMP pour activer l’acide gras dans le cytosol, il en résulte un filet: 7 × 4 + 8 × 10 – 2 = 106 ATP. En comparaison, seules 32 molécules ATP surviennent lorsqu’une molécule de glucose est complètement dégradée.
Les acides gras ne sont pas seulement décomposés dans les mitochondries. Pour les plantes et les levures, par exemple, la réduction des acides gras n’est effectuée que dans les glyoxysomes ou les peroxysomes. [2] Chez l’homme, les acides gras à très longue chaîne (au moins 22 atomes C) sont initialement décomposés en produits à chaîne courte dans les peroxysomes. Les acides gras rares, rares et rares (26 à 28 atomes de carbone avec plusieurs doubles liaisons) sont également métabolisés par des peroxysomes des cellules cérébrales. [3] Ces acides gras raccourcis peuvent ensuite être métabolisés par β-oxydation mitochondriale comme décrit ci-dessus.
Pour le transport des acides gras à chaîne longue dans le peroxisome humain, la protéine ALD est utilisée à la place de la carnitine. Si cela est défectueux, cela conduit à l’expression d’une maladie, l’adréno-eukodystrophie X. [4] [5]
La rupture des acides gras dans les peroxysomes a certaines caractéristiques spéciales: [2] La première enzyme oxyde l’acide gras par l’acide gras activé par la coenzyme A à l’aide d’oxygène. Cela crée un trans -D 2 -Enoyl coa et peroxyde d’hydrogène (h 2 O 2 ). Cette réaction provient d’une acyl-coa oxydase (EC 1.3.3.6 ) Catalyse et contourne la transmission des électrons à fade (voir ci-dessus). H 2 O 2 est disproportionné à l’oxygène et à l’eau par une catalase. De plus, les activités des deux suivantes sont des enzymes (hydratase ENOYL COA; L -3-hydroxyacyl-coa-déshydrogénase) dans un Enzyme multifonctionnelle unie. Enfin, la peroxysomale thiolase ne divisait pas les acides gras, dont la longueur de la chaîne est plus courte que huit atomes C.
L’inversion de la β-oxydation ne se déroule pas dans la nature, bien qu’il n’y ait pas d’obstacle fondamental. Cette inversion serait même plus efficace que la synthèse des acides gras normale et, dans les micro-organismes appropriés, pourrait produire efficacement des biocarburants et des matières premières. Dans l’organisme modèle E. coli A réussi en 2011 à l’Université Rice de Houston et est un exemple de bio-ingénierie réussie. De plus, 1. Les chemins partiels devaient être déréglementés et composés pour des chaînes plus courtes et plus longues; 2. La fermentation concurrente du glucose peut être éteinte; 3. Fermant les enzymes des produits souhaités (acyl-CoA réductase, aldéhyde / alcools hydrogénase, thioestérase) sont insérés / surexprimés et 4. Les enzymes initiantes (thiolases) sont ajoutées pour l’eduke souhaité. [6]
- ↑ UniProt.org
- ↑ un b Donald Voet, Judith G. Voet: Biochimie. 3. Édition. Wiley & Sons, 2004, ISBN 0-471-19350-X, p. 927.
- ↑ Geoffrey Zubay: Biochimie. 4e édition. McGraw-Hill Professional, 1999, ISBN 3-89028-701-8, p. 488.
- ↑ S. Kemp, R. J. Wanders: Adrénoleukodystrophie liée à l’X: métabolisme des acides gras à longue chaîne, ABC à demi-transporteurs et la voie compliquée vers le traitement. Dans: Mol Genet Metab. 90 (3) 2007, S. 268-276. PMID 17092750 , doi: 10.1016 / j.ymgme.2006.10.001
- ↑ H. W. Moser U. un.: Adrénoleukodystrophie liée à l’X. Dans: NAT CLIN PRACT Neurol. 3 (3) 2007, S. 140–151. PMID 17342190 , Deux: 10.1038 / ncpneuro0421
- ↑ C. Dellomonaco, J. M. Clomburg U. un.: Inversion modifiée du cycle de β-oxydation pour la synthèse des carburants et des produits chimiques. Dans: Nature. Band 476, numéro 7360, août 2011, pp. 355–359. doi: 10.1038 / nature10333 . PMID 21832992 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochimie. 6. Édition. Spectrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducteur): Biochimie. 4e, édition mise à jour. Pearson Studies, 2008, ISBN 978-3-8273-7312-0, pp. 667ff.
- Joachim Rassow, Karin Haus, Roland Netzker, Rainer Deutzmann: Double série – Biochimie. 1ère édition. Thieme, 2006, ISBN 3-13-125351-7.
Recent Comments