Bromoforme – Wikipedia
| Formule structurelle | |
|---|---|
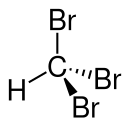 |
|
| Formule d’usure pour clarification de la géométrie | |
| Général | |
| Nom | Bromoforme |
| Autres noms |
|
| Formule de purée | Chbr 3 |
| Brève description |
Liquide de type liquide en forme de chloroforme incolore, de type chloroforme [d’abord] |
| Identificateurs / bases de données externes | |
| Caractéristiques | |
| Masses molaires | 252.75 g · mol −1 |
| État global |
fluide |
| densité |
2,89 g · cm −3 (20 ° C) [2] |
| Point de fusion |
9,2 ° C [2] |
| point d’ébullition |
149,5 ° C [2] |
| solubilité | |
| Indice de réfraction |
1 5948 (25 ° C) [3] |
| consignes de sécurité | |
| MME |
Suisse: 0,5 ml · m −3 ou 5 mg · m −3 [5] |
| Données toxicologiques |
1147 mg · kg −1 (LD 50 , Gears, partout) [d’abord] |
| Propriétés thermodynamiques | |
| ΔH F 0 |
-22.3 kJ / fois [6] |
| Dans la mesure du possible et commun, des unités SI sont utilisées. Sauf indication contraire, les données fournies s’appliquent aux conditions standard. Index de réfraction: ligne Na-D, 20 ° C | |
Bromoforme (Chbr 3 ) est un hydrocarbure halogéné. La connexion est le représentant triple-substitué du brommethane: brommethane, dibréthan, tribsethane et tétrabomméthane.
Avec sa structure (chx 3 ) Est-il homologue à la forme du fluoroforme, du chloroforme et de l’iodo et analogue.
Le bromoforme est créé dans la mer à partir de sa teneur en bromure naturel par des algues et d’autres organismes maritimes. C’est la source la plus forte de broms organiques dans l’atmosphère terrestre. [7]
Il crée également de l’eau à des fins de refroidissement, de bain et de consommation d’alcool et est contenu dans toute l’eau chlorée et ozonisée. Les centrales côtières qui utilisent l’eau de mer chlorée à des fins de refroidissement sont sa source la plus forte générée par les humains.
En laboratoire, la bromoforme peut être fabriquée à partir d’acétone (r = ch 3 ) et l’hypobromit sont fabriqués: [8]
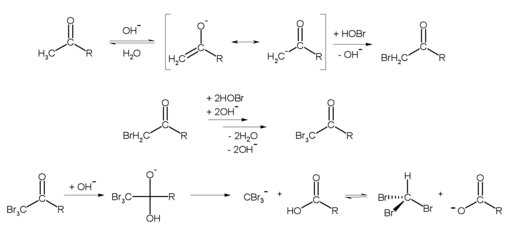
Bromoforme réagit avec de nombreux composés organiques, par lequel des composés de brome toxiques peuvent survenir. Il réagit de manière explosive avec des métaux alcalins. Les vapeurs sont plus lourdes que l’air. L’auto-killing a lieu lors du chauffage sur le point d’ébullition.
Les bromradicaux sont libérés de la connexion courte dans l’atmosphère, qui sont responsables des processus photochimiques dans la troposphère et la stratosphère. Entre autres choses, ils jouent un rôle dans le développement du trou d’ozone.
Le bromoforme a déjà été utilisé contre la coqueluche, un sédatif et pour séparer les mélanges minéraux. [8] Comme composante naturelle des algues rouges de l’espèce ( Asparagopsis taxiformis ) entraîne une réduction considérable des émissions de méthane chez les ruminants s’ils reçoivent des algues rouges ou des extraits d’algues rouges comme aliment. [9]
- ↑ un b c Saisir Dormant . Dans: Römppp en ligne. Georg Thieme Verlag, consulté le 12 novembre 2014.
- ↑ un b c d C’est F Saisir Tribrommétain Dans la base de données sur les tissus Gestis de l’IFA, consultée le 8 janvier 2018. (JavaScript requis)
- ↑ David R. Lide (éd.): CRC Handbook of Chemistry and Physics . 90. AUFLAGE. (Version Internet: 2010), CRC Press / Taylor et Francis, Boca Raton FL, Constantes physiques des composés organiques , S. 3-490.
- ↑ Saisir Bromoforme dans le Inventaire de classification et d’étiquetage L’Agence européenne chimique (ECHA), consultée le 1er février 2016. Le fabricant ou le charme traditionnel peut être la classification et l’étiquetage harmonisés développer .
- ↑ Institution d’assurance contre les accidents (SUVA): Valeurs limites – Valeurs de mak et de chauves-souris courantes (Rechercher 75-25-2 ou. Bromoforme ), consulté le 2 novembre 2015.
- ↑ David R. Lide (éd.): CRC Handbook of Chemistry and Physics . 90. AUFLAGE. (Version Internet: 2010), CRC Press / Taylor et Francis, Boca Raton FL, Propriétés thermodynamiques standard des substances chimiques , S. 5-19.
- ↑ Sanjeevi Rajagopal, Henner, Vayalam P. Venugopalan: Conséquences opérationnelles et environnementales des grands systèmes d’eau de refroidissement industriels . Springer Science & Business Media, 2012, ISBN 978-1-4614-1697-5, S. 211 ( Aperçu limité dans la recherche de livres Google).
- ↑ un b Jürgen Falbe, Manfred Regitz: Römpp Lexicon Chemistry, 10e édition, 1996-1999 Volume 1: A – Cl . Georg Thieme Publishe, 2014, ISBN 3-13-199951-9, S. 525 ( Aperçu limité dans la recherche de livres Google).
- ↑ Bioactifs d’algues et d’algues pour l’atténuation du méthane entérique: défis et opportunités . Consulté le 29 août 2022.
Recent Comments