Chiralité axiale – Wikipedia
-
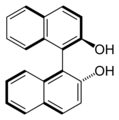
( R ) -Binol: l’axe de chiralité correspond à la liaison entre les deux systèmes naphtyles
-

-

( R ) – (-) – trans -Cycloocten
Autres noms:
( P ) – (-) – trans -Cycloocten et
(-) – ( ET ) -Cycloocten -

( S ) – (+) – trans -Cycloocten
Autres noms:
( M ) – (+) – trans -Cycloocten et
(+) – ( ET ) -Cycloocten -

-

-

( P ) – Hélicité d’un escalier en spirale au musée du Vatican
-

( M ) – Hélicité d’un reflet de l’original de l’escalier en spirale au musée du Vatican
Chiralité axiale est un cas particulier de chiralité en chimie, dans laquelle la molécule n’a pas de centre chiral, mais un axe de chiralité.
La chiralité axiale se produit dans les systèmes de biarel atropisomériques, dont la rotation est empêchée de liaison aryl-arylle, ainsi que des composés de dihydroanthracénone. [d’abord] L’apparition a été pour la première fois en 1922 dans l’acide dinitrodiphénique 6,6 ‘. [2]
De plus, tous les composés et cumulateurs avec un nombre droit de doubles liaisons cumulatives ont une chiralité axiale dans le cas de la substitution asymétrique (par exemple, les dérivés de propadium). Les composés en spiro peuvent également avoir une chiralité axiale. [3]
Aussi quelques-uns trans -Cycloalkene peut être chiral axial, par exemple il y a trans -Cycloocten deux énantiomères. [4] Cependant, la classification en tant que chiral axial est à trans -Cycloalkenen controversé. [5]
Les molécules hélicoïdales telles que l’hélicène sont chirales axiales. En raison de l’arrivée stérique, les anneaux de benzène condensés sont vissés autour d’un axe et ne peuvent pas passer dans leur réflexion. Ce type de chiralité axiale est également appelé hélicité.
Exemple de chiralité axiale dans les hydrocarbures polycycliques saturés est le Trinor Orborn.
Les connexions chirales axiales énantiomériques sont utilisées avec les descripteurs stéréochimiques ( R ) et ( S ), dans des cas plus compliqués aussi R un et S un Caractérisé, l’index “A” signifie “axial”. Aussi le plus ( P ) – / moins ( M ) -Notation est courante. [6]
Ligands chiraux axiaux avec c 2 – La symétrie telle que le binap [2,2 ‘-à (diphénylphosphino) -1,1’ -Binaphthyle] sont utilisées dans la catalyse homogène énantiosélective. Les effets stériques et électroniques peuvent être variés en utilisant des substituants annulaires appropriés. [7] [8]
- ↑ Melvyn Gill, Peter M. Morgan: Stéréochimie absolue des métabolites fongiques: Ictérinoidines A1 et B1, et atrovirines B1 et B2 . Dans: Archivage . Groupe 2004 , Non. dix , 8 juillet 2004, S. 152–165 , est ce que je: 10.3998 / ark.5550190.0005.A15 ( Arkat-usa.org ).
- ↑ James Kenner, Wilfrid Victor Stubbings: LXIV. – Une deuxième forme de l’acide 6: 6′-dinitrodiphène et sa conversion en nouveaux systèmes cycliques . Dans: Journal of the Chemical Society, Transactions . Groupe 119 , Non. 0 , 1921, S. 593–602 , est ce que je: 10.1039 / ct9211900593 .
- ↑ Bernhard Testa: Bases de la stéréochimie organique , Verlag Chemie, Weinheim, 1983, pp. 59–61, ISBN 3-527-25935-X.
- ↑ Bernhard Testa: Bases de la stéréochimie organique , Verlag Chemie, Weinheim, 1983, pp. 64–65, ISBN 3-527-25935-X.
- ↑ Erngest L. Elel, Samuel H. Will: Stéréochimie des composés organiques , John Wiles & Sons, 1994, S. 1172–1175, ISBN 0-471-05446-1.
- ↑ Saisir Chiralité axiale. Dans: IUPAC (éd.): Compendium de la terminologie chimique. Le «livre d’or». est ce que je: 10.1351 / Goldbook.A00547 – Version: 2.1.5.
- ↑ R. Noyori, Nobel Prize Lecture, 8 décembre 2001 .
- ↑ P. J. Walsh, M. C. Kozlowski: Fondamentaux de la catalyse asymétrique. Verlag University Science, S. 614 ( abstrait dans la recherche de livres Google).
Recent Comments