Enantiomère – Wikipedia

Liens: ( S )-Acide milchique, à droite: ( R )-Acide milchique
Énantimère sont des stéréoisomères des composés chimiques qui coïncident dans leur constitution et se comportent en un homologue dans les structures spatiales telles que sa réflexion (non-couverture). Ils sont aussi appelés ce fait à cause de ce fait Image miroir . La dénomination grecque montre ce sens: ἐνάντιος, homologue et μέρος, partie ou zone. La formule de somme et liant les formations atomiques respectives correspondent. Il s’agit d’une forme d’isomère de configuration; Contrairement aux isomères de conformation, les énantiomères ne peuvent pas être couverts par des liaisons atomiques rotatives. Étant donné que les énantiomères dans tous les centres stéréo ont chacun la configuration opposée, il y a toujours un (-) – et un (+) – énantiomère, dont il n’y en a souvent qu’un dans la nature.
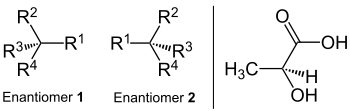
Ce type d’isoméria est appelé chiralité (orienté la main). Pour illustrer l’image miroir des énantiomères, les parties du corps telles que les objets gauche et main droite ou quotidienne tels que les chaussures gauche et droite ainsi que des vis gauche et à droite ou des écrous peuvent être utilisés. Un exemple de molécule qui se produit dans deux variantes spatiales est l’acide lactique dans le yaourt. Les énantiomères ont toujours la configuration opposée dans tous les centres stéréo. En revanche, les diastéréomères, dans lesquels au moins un centre stéréo de plusieurs est toujours configuré et au moins un différemment (voir là-bas).
À l’exception de l’activité optique, les énantiomères ont les mêmes propriétés physiques telles que la fusion et les points d’ébullition, la densité, la solubilité, les spectres IR, les rayons X, etc. Ils sont optiquement actifs, c’est-à-dire tirer le niveau de polarisation de la lumière linéaire polarisée dans le sens horaire (forme de droite, également (+) – forme précédente ou antérieure d -Form appelé) ou dans le sens horaire (formulaire de gauche, (-) – forme ou antérieure l -Form appelé). Le sentiment de rotation doit être compris en termes de direction de l’œil de l’observateur, et non en ce qui concerne la direction du rayonnement. Les énantiomères tournent le niveau de polarisation de la lumière polarisée linéaire de la même quantité dans la direction opposée.
Les deux énantiomères d’un éduct réagissent dans les réactions chimiques dans lesquelles une autre enantiomérinréner Le partenaire de réaction est impliqué. Les états de transition de réaction sont alors un diastéréomère. Même lorsqu’ils sont utilisés comme médicament dans les organismes, les substances énantiomères provoquent des effets différents. Cela peut être illustré par un exemple de la vie quotidienne, la pansement des chaussures: il est clair que seule la bonne chaussure s’adapte au bon pied. Si vous essayez de tirer la chaussure droite sur votre pied gauche, vous échouerez ou n’atteindrez qu’un très mauvais résultat. Ainsi, au lieu d’un effet souhaité, vous obtenez un résultat inutile ou nocif et donc indésirable.
De nombreuses substances biologiquement importantes sont chirales, non seulement les plus petites molécules des acides aminés et du sucre, mais aussi des macromolécules biologiques telles que les enzymes ou les récepteurs.
Pour certaines classes de substances, un énantiomère prévaut souvent, par exemple, presque tous les acides aminés naturels sont dans le L -Form avant. Le D -Leform est avec le sucre naturel (par exemple D -Glucose) extrêmement dominant, L -Les crânes sont rares exotiques.
La chiralité à la suite du bâtiment spatial des molécules est d’une importance cruciale pour le fonctionnement des systèmes biologiques, tous chiraux eux-mêmes. De nombreuses réactions enzymatiques sur un énantiomère, soit le tour de gauche ou le virage à droite, se spécialisent: la vitesse de réaction avec l’énantiomère réfléchissant en tant que substrat est significativement plus faible ou elle n’est pas mise en œuvre du tout, car le centre actif d’un principe enzyme peut souvent absorber un énantiomère plus facilement que l’autre (clé et de verrouillage, spécifiquement spécifique).

La spécificité du substrat peut être illustrée par le concept d’interaction à trois points pour les énantiomères, comme il est montré dans le schéma visuel: l’énantiomère chirale A est congruent dans un récepteur. Cependant, le reflet de l’énantiomère A ne convient pas à l’énantiomère B, ce qui peut entraîner des problèmes de liaison et affecte ainsi l’effet d’une substance (par exemple d’un médicament). Des différences de pharmacodynamique ou de pharmacocinétique peuvent se produire. L’énantiomère avec l’activité ou l’affinité plus élevée est appelée eutomère et celle avec l’activité ou l’affinité plus faible du distomère. [d’abord]


Pas si rarement, l’énantiomère “faux” a également un effet biologique complètement différent. Exemples:
- Goût: l’acide aminé ( S ) -Valin a un goût amer, ( R ) -Valin a un goût sucré,
- Odeur: le terpen ( S ) – (+) – les odeurs de carvon des graines de carvi, dont l’énantiomère ( R ) – (-) – Carvon odeurs de menthe. [2]
- Effet pharmacologique des bêta-bloquants: dans le cas des bêta-bloquants, cela fonctionne ( S ) -Enantiomer sélectivement sur le cœur qui ( R ) -Enantiomer, en revanche, sur les membranes cellulaires de l’œil. Par conséquent, une unité énantiomérique élevée est d’une grande importance pour de nombreux médicaments. [3]
- Effets pharmacologiques de la thalidomide: Le public a pris conscience de l’effet endommageant les fruits du thalidomide par le scandale des contre-organismes. Au début, cela était associé aux différents effets des deux énantiomères et de la même substance, puisque le ( S ) -Enantiomère du thalidomide a un effet tératogène (endommageant les fruits) que ( R ) -Enantiomer non.
Cependant, les énantiomères de thalidomide ont la propriété qu’ils sont dans le corps en huit heures environ [4] convertir (racémique). [5] L’admission exclusivement ( R ) – Le thalidomide condamné reste dénué de sens dans la pratique. [6]
Dans la fabrication synthétique d’ingrédients énantiomériques agitant différents, par exemple en pharmacologie, vous essayez de produire l’énantiomère avec l’effet souhaité dès le départ et d’utiliser comme ingrédient actif pharmaceutique, tandis que l’asturéytiomère avec sa synthèse énantiodiosélique). Alternativement, un racemat (1: 1 de deux énantiomères) de la fission racémate peut être soumis à un ingrédient pharmaceutique uniforme (= énantiomérique pur), qui peut alors devenir pharmacologiquement efficace que le racémat.
L’odeur ou le goût des tissus peut également être différent en fonction de l’énantiomère, car les récepteurs correspondants du corps sont toujours chiraux (plus précisément: énantiomériques).
Les énantiomères sont généralement métabolisés différemment dans les systèmes biologiques.
Un mélange 1: 1 de (+) – et (-) forme d’un tissu dans lequel l’activité optique des substances individuelles est équilibrée, un racémat est appelé. B. (±) -methionine [synonymes: Dl -Méthionine et ( Rs ) -Methionine].
Il n’est pas optiquement actif et a un angle de virage un de 0 °, car les actions soulèvent simplement la forme droite-ling-fard et la forme gauche. Du quotient de l’angle rotatif mesuré à l’angle rotatif maximal de l’énantiomère pur multiplié par 100 pureté optique (%) du mélange énantiomérique. En supposant un comportement idéal (pas d’interaction entre les deux énantiomères et la validité de la loi Lambert-Beer), la pureté optique est égale à l’excédent énantiomérique de .
Le point de fusion d’un racemat s’écarte généralement du point de fusion des énantiomères purs. [7] Le point de fusion du racémat peut être inférieur ou supérieur à celui des énantiomères purs. Ce phénomène peut être expliqué à première vue: si le racemat cristallise comme un mélange racémique (conglomérat), les cristaux de la forme (+) et (-) sont séparés côte à côte, i. Autrement dit, l’énantiomère (+) – a une affinité plus élevée pour les molécules (+) et l’énantiomère (-) – a une affinité plus élevée (-) -. Ainsi, “côte à côte” survient (+) et (-) – cristallines lors de la cristallisation. Le point de fusion du “mélange racémique” est significativement inférieur au point de fusion des énantiomères purs. Exemple: à la fois pur (+) – et (-) – les énantiomères du médicament fondent le gluthimide à 102-103 ° C. D’un autre côté, (±)-glutthimide, c’est-à-dire le mélange racémique, a un point de fusion de 84 ° C.
La situation est différente si les (+) – énantiomères lors du cristallisation préfèrent les énantiomères (-) -. Ensuite, “chaque” cristal contient le même nombre de molécules “à la fois” énantiomères. Ce cas est appelé une connexion racémique. La connexion racémique diffère dans ses propriétés physiques des énantiomères purs. Le point de fusion peut être plus élevé, le même ou inférieur à celui des énantiomères purs. Exemple: Les énantiomères purs de l’ibuprofène médicament ont un point de fusion à 50–52 ° C, l’ibuprofène racémique a un point de fusion à 75–77,5 ° C. L’ibuprofène racémique cristallise donc comme une connexion racémique.

- Les énantiomères sont classés en fonction de la règle de séquence R et S.
- Pour savoir si un énantiomère ( R )- ou ( S ) -Configuration, vous devez organiser tous les substituants en fonction de leur priorité: 1> 2> 3> 4. Le substituant par la priorité la plus basse (4) est tourné sous le niveau du papier. Maintenant, vous passez de 1 à 2 à 3.
- Quand la direction dans laquelle vous vous déplacez avec Le sens horaire est l’énantiomère ( R ) configuré (à partir de lat. direct «Légal, à droite, droite») [8]
- Quand la direction dans laquelle vous vous déplacez contre est dans le sens horaire, l’énantiomère ( S ) configuré (à partir de lat. sinistre ,liens’)
- Voir aussi: Convention de Cahn-Ingold-prélog pour une explication de la façon d’ordonner les substituants en fonction des priorités.
À partir du sens dans le sens horaire des priorités des substituants pour déterminer la configuration [(((((((((((((( R ) ou ( S )]]] pas Fermé automatiquement à l’angle de rotation α ou dans la direction de rotation [(+) ou (-)] du niveau de polarisation de la lumière polarisée linéaire. Exemples:
- ( S ) -Lanine a un angle de rotation α de +13,0 ° (c = 2 en 5 N d’acide chlorhydrique) [9]
- ( R ) -Cystéine a un angle de rotation α de +7,9 ° (c = 2 en 5 N d’acide chlorhydrique) [9]
La convention CIP (convention CAHN-Ingold-prélog, également la nomenclature R-S) est utilisée pour différencier les énantiomères, avec lesquels la disposition spatiale des substituants est décrite. Pour certaines classes de substances (sucre, limité à la biochimie même dans les acides aminés), la projection de pêche plus ancienne est toujours en cours ( D , L -NomenkLatur) utilisé, ce qui a l’avantage que les noms des connexions connexes sont les mêmes. Au nom d’une connexion, la direction de rotation de la lumière peut être clairement indiquée par “(+) -” pour la droite ou “(-) -” pour la gauche; Z B. (-) – acide vitilique ou (+) – acide lactique, mais cette description n’est pas toujours claire car le solvant utilisé peut influencer la rotation de la rotation dans certains cas et peut donc changer.
Souvent le pré-Pilote Gauche- ou Loué- (gauche) pour la gauche et Dex- ou. Dextro- (à droite) Utilisé pour les substances à droite.
Exemples:
- Levodopa, levothyroxine, levonorgestrel, la lévofloxacine, le levobupivacain, le levétiracétam, la lévopetirizine
- Dextrose, dexamfétamine, dexibuprofène, dexketoprofène, dextrométhorphane, dexrazoxan, dexchlorphéniramine
Peut être dérivé de la nomenclature CIP ( S ) -Enantiomères de médicaments Est- et ( R ) -Enantiomère le pré-pilote Avec- Portez s’il y a déjà un nom Frein pour la substance racémique. Inversement, le préfixe Rac- précédé.
Exemples:
En 1848, Louis Pasteur a géré la fission Racemats pour les énantiomères d’un sel du D – et L -Wine Acid. Pour lui, ils différaient seulement dans le fait que leurs cristaux ont été construits dans une image miroir. Après une cristallisation minutieuse, il a pu séparer les différents cristaux dans un travail manuel minutieux et a ainsi initié les recherches de l’énantiomery.
L’acide du veau a également joué un rôle important dans la fusion de l’activité optique d’une substance et la configuration absolue des molécules par Johannes Martin Bijvoet. Le sodium-rubidium-tartrat (un sel de viticulture) a joué un rôle central dans la clarification fiable de la configuration absolue des molécules pures énantiomères. Les découvreurs ont reçu le prix Nobel de chimie.
La chimie synthétique a récemment eu des méthodes pour la production directe d’un isomère d’ingrédient actif pur à travers des synthèses énantiosélectives ou même des énantios basées sur le modèle de la nature.
Synthèse asymétrique [ Modifier | Modifier le texte source ]]
Dans les synthèses chimiques des tissus chiraux, les deux énantiomères sont généralement créés dans le même rapport. Ils doivent être séparés pour obtenir les énantiomères comme une substance pure. La synthèse des molécules énantiomères est l’un des domaines les plus difficiles de la chimie organique préparative. De nombreuses méthodes de synthèse plus récentes offrent une issue, dont certaines ont de très grandes énantiosélectivités. Diverses méthodes ont été développées pour rendre une molécule chirale accessible à partir d’Edukten non chiral:
- Utilisation de réactifs et catalyseurs auxiliaires chiraux (par exemple le phosphane chirale)
- Implémentation avec enzymes
- Attacher un auxiliar qui peut être retiré après la réaction
- Transfert dans les diastéréomères [en attachant un substituant pur énantiomérique tel que (-) – strychnin] et leur séparation (par exemple la cristallisation, la chromatographie de la colonne, etc.)
L’unité énantiomérienne obtenue ici est souvent différente. Le surplus énantiomérique est spécifié comme une mesure du succès de la synthèse / cristallisation asymétrique:
De plus, la synthèse des ingrédients énantiomères des substances naturelles chirales (exemples: acides aminés, glucides, terpen, alcaloïdes, stéroïdes) reste une méthode importante et efficace.
Synthèse de médicament [ Modifier | Modifier le texte source ]]
Le pharmacologue Everhardus Ariëns est considéré comme un pionnier important pour la synthèse du dysfonctionnement énantiomérique ciblé, qui s’est déjà plaint dans les années 1980 dans les années 1980 en tant qu’énantiomère. Avec le développement ultérieur de la chimie synthétique, la production stéréosélective complète complète d’énantiomères purs avec quelques centres de chiralalité est souvent possible sans plus d’efforts aujourd’hui. Les médicaments avec de nombreux centres d’asymétrie, en revanche, sont fabriqués partiellement synthétiquement basés sur des substances naturelles. [dix]
Parmi les médicaments monochiraux, une tendance vers la synthèse de substances pures énantiomères peut être observée. Déjà 15 éantiomères purs ont été trouvés parmi un total de 24 nouvelles introductions de 1999 à 2003, le nombre de la période 2004 à 2008 a atteint 20 énantiomères purs de moins de 25 nouvelles introductions. La plupart d’entre eux sont des tissus complètement nouveaux, c’est-à-dire des énantiomères qui n’ont pas de prédécesseurs Racemat. [dix] Au cours des deux périodes de 5 ans suivantes, la proportion d’énantiomériens était encore élevée. [11] [douzième]
Cependant, certains médicaments énantiomères ont été développés pour remplacer fortement les ventes en tant qu’Eutoma. Cependant, un tissu énantiomérique n’offre pas toujours un véritable avantage thérapeutique sur le Racemat. [13] Il est donc douteux que le dexibuprofène pharmacologiquement actif en 2001 S ) -Enantiomer de l’ibuprofène racémique] est un réel progrès car le ( R ) -Enantiomère de l’ibuprofène après l’absorption de toute façon rapidement enzymatiquement dans l’efficacité ( S ) – La forme est convertie. Selon la recommandation du fabricant, le médicament énantiomérique Pure et le médicament racémique doivent être dosés. La supériorité thérapeutique par rapport à l’utilisation du racémat est également discutable pour le bloqueur de toux Levodropica introduit en 2000, car aucune distinction claire n’est connue dans un énantiomère efficace et inefficace et les deux sont dosés de la même manière. L’ésoméprazole de la pompe à pompe à protons, qui a également été introduit en 2000, n’agit pas plus fort que le ( R ) – Forme de l’oméprazole, mais est mieux biodisponible en raison d’un métabolisme enzymatique plus lent. Néanmoins, la pertinence thérapeutique a été remise en question en raison du mécanisme d’action des inhibiteurs de la pompe à protons. [13]
D’un autre côté, les substances Escitalopram, LevoCetirizi, Levobupivacain et Dexrazoxan sont considérées comme des progrès thérapeutiques par rapport à l’efficacité du racémate précédent.
Pour certaines substances, le centre de chiralité n’est pas dans la zone moléculaire pharmacologiquement active, comme les inhibiteurs de la gyrase gatloxacine ou la nadifloxacine. L’utilisation du Racemat doit alors être justifiable. [13]
- E. J. Ariëns: Stéréochimie, base de non-sens sophistiqué en pharmacocinétique et pharmacologie clinique . Dans: Journal européen de pharmacologie clinique . Groupe 26 , Non. 6 , 1984, S. 663–668 , est ce que je: 10.1007 / bf00541922 .
- Adam Sobanski, Roland Schmieder, Fritz Vögtle: Stéréochimie topologique et chiralité . Dans: Chimie à notre époque . Groupe 34 , Non. 3 , 2000, S. 160–169 , est ce que je: 10.1002 / 1521-3781 (200006) 34: 3 <160 :: AID-CIUZ160> 3.0.co; 2-6 .
- Klaus Roth: Une histoire chimique infinie . Dans: Chimie à notre époque . Groupe 39 , Non. 3 , 2005, S. 212–217 , est ce que je: 10.1002 / ciuz.200590038 .
- Bernard Testa: Bases de la stéréochimie organique . Wiley-VCH, 1983, ISBN 3-527-25935-X.
- Uwe meierhenrich: Acides aminés et asymétrie de la vie . Springs-Publiser, 2008, ISBN 978-3-540-76885-2.
- ↑ H. J. Roth, C. E. Müller, G. Folkers (éd.): Stéréochimie et médicaments: Basics – Consistance – Impact, Scientific Publishing Company MBH, Stuttgart, pp. 80, 81, 1998.
- ↑ Wolfgang Legrum: Riech Fabrics, entre la puanteur et le parfum , Vieweg + Teubner Verlag (2011) pp. 33–35, ISBN 978-3-8348-1245-2.
- ↑ Everhardus Ariëns: Stéréochimie, base de non-sens sophistiqué en pharmacocinétique et pharmacologie clinique , European Journal of Clinical Pharmacology 26 (1984) 663-668, doi: 10.1007 / bf00541922 .
- ↑ Nature (Londres) 385, 303 (1997).
- ↑ M. Reist, P. Areruppp, E. Franotto, B. Chef: Inversion chirale et hydrolyse du thalidomide: mécanismes et catalyse par les bases et l’albumine sérique, et la stabilité chirale des métabolites tératogènes . Dans: Recherche chimique en toxicologie . 11e année, Non. douzième , 1998, S. 1521–8 , est ce que je: 10.1021 / tx9801817 , PMID 9860497 .
- ↑ Bernd Engels, Carsten Schmuck, Tanja Schirmeister, Reinhold Fink: Chimie pour les médecins . ( Google.de ).
- ↑ Hermann J. Roth, Christa E. Müller et Gerd Folkers: Stéréochimie et médicaments , Scientific Publishing Company Stuttgart, 1998, ISBN 3-8047-1485-4, pp. 161–162.
- ↑ Duden: direct .
- ↑ un b Hans-Dieter Jakubke, Hans Jeschkeit: Acides aminés, peptides, protéines , Verlag Chemie, Weinheim, pp. 30, 1982, ISBN 3-527-25892-2.
- ↑ un b H. J. Roth: Dex, Lev-, Ar-, Es-, Rac, New Drugs-Record des cinq dernières années . Dans: Journal de pharmacien allemand . Groupe 149 , Non. 28 , 2009, S. 3182-6 .
- ↑ H.J. Roth: Nouveaux chiraux médicaments – un équilibre de 2009 à 2013 . Dans: Journal de pharmacien allemand . Non. 4 , 2014 ( Deutsche-atother-iitung.de ).
- ↑ H. J. Roth: Chirale contre médicaments Achirale . Dans: Journal de pharmacien allemand . Non. 6 , 2019 ( Deutsche-atother-iitung.de ).
- ↑ un b c H. J. Roth: Dex, Lev-, Es-, un record des cinq dernières années: tendance vers l’application d’énantiomères purs . Dans: Journal de pharmacien allemand . Groupe 144 , Non. 4 , 2004, S. 2309 .

Recent Comments