Pankreasplipase – Wikipedia
Le Pankreaslipase (Lipase, PL) Est l’une des deux enzymes qui divisent les graisses (triglycérides) absorbées par la nourriture dans l’intestin grêle des mammifères. Cette réaction est indispensable pour la digestion des graisses; Environ 80% des triglycérides sont déjà divisés de la nourriture lorsqu’ils atteignent le duodénum moyen. Le PL appartient aux lipases et est produit dans le pancréas (pancréas). La protéine colipase kofactor est requise pour la fonction. [d’abord]
La lipase pancréatique est également responsable de l’hydrolyse des esters de rétinyle vers le rétinol et les acides gras, ce qui permet une partie de l’enregistrement de la vitamine A par la nourriture (la vitamine A est également ajoutée et enregistrée en tant que provitamine ou rétinol). [2]
La lipase pancréatique est cible dans le contrôle du médicament du surpoids. L’inhibiteur du PL Orlistat est commercialisé avec cette indication depuis 1998.
La lipase est d’une importance centrale dans la thérapie de substitution enzymatique lorsque le pancréas (insuffisance pancréatique) est réduit.
En particulier dans le cas de la fibrose kystique, l’administration de préparations enzymatiques avec de la poudre pancréatique du porc, qui sont standardisées à une certaine teneur en lipase, est la norme thérapeutique. Ces médicaments sont proposés pour protéger les enzymes contenues avec des résistants gastro-intestinaux.
Dans certains cas, la lipase provient également de sources non animales (rhizolipase des cultures de riz-dollar japonais Rhizopus oryzae , Les noms de marques: Non-base ) Pour une utilisation, qui se caractérise par une stabilité naturelle par rapport à l’acide gastrique humain.
Dans le diagnostic de laboratoire, l’activité de la lipase faite de plasma d’héparine ou de sérum sanguin lors de la clarification des douleurs abdominales supérieures est mesurée, en particulier pour le diagnostic de pancréatite aiguë.
Plage de référence pour les mesures à 37 ° C (test de couleur): sérum, plasma <60 U / L
Avec une pancréatite aiguë, la lipase augmente et est déjà 5 heures après l’insertion de la douleur au-dessus de la plage de référence de 60 U / L. Dans la plupart des cas, la valeur augmente plus de 180 U / L et reste augmentée pendant trois à six jours.
En général, la méthode de détermination de la lipase est moins standardisée et plus sensible aux facteurs perturbateurs que l’amylase pancréatique. En médecine humaine, la lipase pancréatique est principalement déterminée en cas de pancréatite aiguë suspectée, car cela a une spécificité plus élevée pour l’inflammation, en particulier dans la pancréatite liée à l’alcool. [3] La détermination simultanée de l’amylase et de la lipase n’augmente pas la sensibilité du test. [4] La détermination de la lipase est particulièrement utile si, pour des raisons techniques, seule l’amylase globale peut être mesurée ou si le patient a été traité avec une expansion du plasma (épaisseur d’hydroxyäthyl ou dextrane 70). [5] En médecine vétérinaire, la concentration globale de la lipase pancréatique dans le sérum pour diagnostiquer la pancréatite aiguë est déterminée en médecine vétérinaire en tant qu’immunoractivité pancréatique lipase. [6]
La lipase est filtrée glomérulairement dans le rein, mais n’est pas excrétée, mais réorganisée et démantelée. Il n’apparaît donc pas dans l’urine, mais est néanmoins augmenté dans l’insuffisance rénale.
Dans l’examen endoscopique du pancréas (ERCP = cholangiopankreeticographie rétrograde endoscopique), la lipase augmente immédiatement, atteint des valeurs allant jusqu’à 720 U / L après six heures et reste jusqu’à trois jours au-dessus de la plage de référence de 60 U / L.
Une autre cause d’augmenter la lipase sans valeur de maladie peut être le syndrome de Gullo.
La lipase pancréatique se sépare dans les triglycérides-E.G. B. d’abord -Un les résidus d’acide gras α-industriel. [7] Les acides gras libres se forment 2A et 2B ainsi que le monoglycéride 3 : [8]
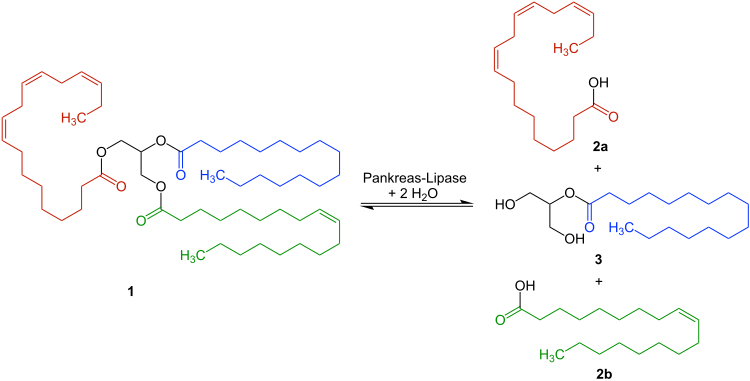
Dans son centre actif, la lipase a une triade catalytique de l’acide asparagique des acides aminés, de l’histidine et de la sérine. L’acide asparagique prive l’histidine un proton et l’active. L’histidine catalytiquement active retire à son tour un proton de la sérine, ce qui augmente la nucléophilie du SelDrest. Cela peut désormais attaquer le carbone carbonyle d’un testeur de substrat qui est déjà localisé dans le centre actif. Il y a un intermédiaire tétradrique à partir duquel un complexe acyl-enge-Engy est créé. La désacétylation dans une conduite d’hydrolyse est libre d’obtenir des acides gras et l’enzyme d’origine.
- Birgid Neumeister, Ingo Besenthal, Hartmut Liebich (éd.): Guide de la clinique de diagnostic de laboratoire. 3. Édition. Urban & Fischer, Munich U. 2003, ISBN 3-437-22231-7.
- Lothar Thomas (éd.): Laboratoire et diagnostic. Indication et évaluation des résultats de laboratoire pour les diagnostics médicaux. 6. Édition. TH-Books, Frankfurt AM Main 2005, ISBN 3-9805215-5-9.
- ↑ Uniprot P16233
- ↑ A. M. Van Bennekum, E. A. Fisher, W. S. Blaner, E. H. Harrison: Hydrolyse des esters de rétinyle par les triglycérides pancréatiques lipase . Dans: Biochimie . Groupe 39 . Ancien, Non. 16 , Avril 2000, S. 4900–4906 , PMID 10769148 .
- ↑ Vivek Gumaste, Pradyuman Dave, George Sereny: Lipase sérique: un meilleur test pour diagnostiquer la pancréatite alcoolique aiguë . Dans: The American Journal of Medicine . Groupe 92 , Non. 3 , Mars 1992, S. 239–242 , est ce que je: 10.1016 / 0002-9343 (92) 90070-R ( Elsevier.com [Consulté le 10 décembre 2021]).
- ↑ John Treacy, Anthony Williams, Renz Bais, Krysten Willson, Christopher Worthley: Évaluation de l’amylase et de la lipase dans le diagnostic de la pancréatite aiguë: amylase et lipase dans une pancréatite aiguë . Dans: ANZ Journal of Surgery . Groupe 71 , Non. dix , Octobre 2001, S. 577–582 , est ce que je: 10.1046 / j.1445-2197.2001.02220.x ( wiley.com [Consulté le 10 décembre 2021]).
- ↑ Ross C. Smith, James Southwell-Keely, Douglas Chesher: La lipase pancréatique sérique devrait-elle remplacer l’amylase sérique en tant que biomarqueur de la pancréatite aiguë? Dans: ANZ Journal of Surgery . Groupe 75 . Ancien, Non. 6 , Juin 2005, S. 399–404 , est ce que je: 10.1111 / j.1445-2197.2005.03391.x , PMID 15943725 .
- ↑ Jörg M. Steiner (éd.): Gastro-entérologie des petits animaux. Schlütersche, Hanover 2008, ISBN 978-3-89993-027-6.
- ↑ Otto-Albrecht Neumüller (éditeur): Römps Chemie Lexikon , Frank’s Publishing House, Stuttgart, 1983, 8th Edition, pp. 2377, ISBN 3-440-04513-7.
- ↑ Peter Nuhn: Chimie de substance naturelle , S. Hirzel Scientific Verlagsgesellschaft, Stuttgart, 2e édition, 1990, pp. 308–309, ISBN 3-7776-0473-9.
Recent Comments