Phosphortroxide – wikipedia
| Formule structurelle | |
|---|---|
 |
|
| Général | |
| Nom | Phosphortrooxide |
| Autres noms |
|
| Formule de purée | P 4 O 6 |
| Brève description |
Cire – cristaux de monocline en cire, incolore [d’abord] |
| Identificateurs / bases de données externes | |
| Caractéristiques | |
| Masses molaires | 109,96 g · mol −1 ou 219.92 g · mol −1 |
| État global |
festival |
| densité |
2,13 g · cm −3 [2] |
| Point de fusion |
23,8 ° C [2] |
| point d’ébullition |
175,3 ° C [2] |
| solubilité |
Bon en benzène et en carbone de soufre [2] |
| Indice de réfraction |
1 540 (27 ° C) [3] |
| consignes de sécurité | |
| Dans la mesure du possible et commun, des unités SI sont utilisées. Sauf indication contraire, les données fournies s’appliquent aux conditions standard. Index de réfraction: ligne Na-D, 20 ° C | |
Phosphortrooxide est un oxyde de l’élément phosphore. Cette connexion chimique est également sous le nom Diphosphortrioxide connu. La masse moléculaire déterminée dans l’état fondu, dissous et en forme de vapeur correspond à la formule de somme P 4 O 6 . Les cristaux de cire et incolores sont très toxiques.
Le trioxyde phosphorique se produit lorsque le phosphore blanc est brûlé à basse température. [5] On observe un fort développement de la chaleur:
- Le phosphore blanc réagit avec l’oxygène au trioxyde phosphorique.
Propriétés physiques [ Modifier | Modifier le texte source ]]
Le trioxyde de phosphore est l’anhydride de l’acide phosphonique. Le phosphore est disponible dans le niveau d’oxydation +3. Les cristaux de cette connexion ont une densité de 2,14 g · cm −3 . Le point de fusion est de 24 ° C, le point d’ébullition à 175 ° C sous une atmosphère d’azote. Le trioxyde de phosphore se dissout dans le benzène et le carbone. [d’abord]
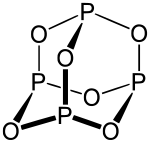
La structure du trioxyde de phosphore est guidée par le phosphormolécule tétraédrien 4 loin. Si vous remplacez les six liaisons P-P – les bords du tétraèdre-each par des liaisons P-O-P, vous pouvez atteindre la structure moléculaire illustrée ci-dessus. La longueur de liaison des liaisons P-O pour la molécule dans la condition de gaz est 164 pm. Pour l’angle de liaison, il y a 126,4 ° pour le groupe POP et 99,8 ° pour le groupe OPO. [5]
La structure a une symétrie élevée. En plus de la disposition tétraedrique des atomes de phosphore, une disposition octaèdre peut être déterminée pour les atomes d’oxygène. Les quatre zones de la structure tétraedrie de base sont utilisées par quatre p lien symétrique 3 O 3 -Sechrings encadrés. Cette structure peut également être trouvée dans l’arsenic (comme 4 O 6 ) ainsi qu’à l’urotropine (n 4 (Ch 2 ) 6 ).
Le trioxyde phosphorique cristallise dans une structure cristalline de monocline dans le groupe de la salle P 2 d’abord / / m (Groupe de chambre n ° 11) et les paramètres de la grille A = 6,43, b = 7,887, c = 6,183 Å et β = 106,01 °. [6]
Propriétés chimiques [ Modifier | Modifier le texte source ]]
Le trioxyde de phosphore continue de s’oxyder en pentoxyde de phosphore dans l’air:
- Le trioxyde de phosphore s’oxyde au pentoxyde de phosphore.
La chimiluminescence est observée sous une pression réduite au cours de ce processus.
Au-dessus de 210 ° C, une décomposition du phosphore et du phosphortetroxyde a lieu:
- Le trioxyde de phosphore disproportionné au phosphore et au phosphortetroxyde.
Dans l’eau froide, le trioxyde de phosphore est converti en acide phosphonique [5] :
- Le trioxyde de phosphore réagit à l’acide phosphonique avec de l’eau.
Dans l’eau chaude, la disproportionnement de l’acide phosphonique est pertinente, de sorte que l’acide phosphorique, le phosphine et le phosphore sont obtenus sous forme de produits de réaction. [5]
La réaction avec le chlore d’hydrogène conduit à la formation d’acide phosphonique et de trichlorure de phosphore:
- Le trioxyde de phosphore et le chlore d’hydrogène réagissent à l’acide phosphonique et au trichlorure de phosphore.
Avec le chlore halogénique et le brom, le trioxyde de phosphore réagit aux phosphorylhalogénides, avec de l’iode en diphosphortetraiodide. La mise en œuvre avec Ozone mène à l’ozonid P 4 O 18 , qui se décompose lentement en pentoxyde de phosphore au-dessus de -35 ° C. [5]
- ↑ un b Saisir Phosphoroxyde . Dans: Römppp en ligne. Georg Thieme Verlag, consulté le 30 avril 2014.
- ↑ un b c d A. F. Holleman, E. Wiberg, N. Wiberg: Manuel de chimie inorganique. 102. Édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, p. 786.
- ↑ David R. Lide (éd.): CRC Handbook of Chemistry and Physics . 90. AUFLAGE. (Version Internet: 2010), CRC Press / Taylor et Francis, Boca Raton FL, Indice de réfraction des liquides inorganiques , S. 4-140.
- ↑ Cette substance n’a pas encore été classée en termes de danger, soit une source fiable et citée de cela n’a pas encore été trouvée.
- ↑ un b c d C’est Ralf Steudel: Chimie des non-métaux, synthèses – Structures – liaison – utilisation , 4e édition, 2014 Walter de Gruyter GmbH & Co. KG, Berlin / Boston, ISBN 978-3-11-030439-8, pp. 407–408, (consulté en ligne).
- ↑ M. Jansen, M. Voss, H.J. Deiseroth: Propriétés structurelles des phosphoroxydes dans un état fixe d’agrégation . Dans: chimie appliquée , 1981 , 93 , S. 1023–1024, deux: 10.1002 / ange.19810931127 .






Recent Comments