Thioketone – wikipedia
| Thiokétone |
|---|
 symétrisches thioketon |
 Thiokétone unymétrique |
| Le groupe thicoarbonyle est bleu marqué. Le reste R , R d’abord et R 2 sont des restes organiques (alkyle, aryle ou similaires). |
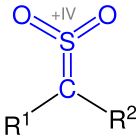
Thiokétone (Thione) sont des composés organiques et chimiques. Ils représentent les analogues de Sulphur des cétones et appartiennent aux composés thiocarbonyle. [d’abord]
Leur groupe fonctionnel se compose d’un atome de carbone et de soufre, qui sont reliés par une double liaison. Les restes sur l’atome de carbone du groupe thiocarbonyle sont des résidus organiques (résidents alkyle, résidents d’Aryl, etc.). Les thiokétons sont des substances exceptionnellement colorées et se caractérisent par une odeur intensive typique des composés de soufre organiques. [2] Étant donné que leurs monomères aliphatiques sont souvent instables, ils ont tendance à polymériser. Les produits de trimérisation sont préférés. [3] La synthèse et les réactions des thiocétons se réfèrent donc souvent souvent à des thiocétons aromatiques plus stables. [4] Néanmoins, des thiokétons de toutes sortes peuvent être produits ces jours-ci. [5]
Le préfixe devient le préfixe pour nommer des thiocétons s’il n’y a pas de groupes fonctionnels de priorité supérieure Thioxo – Fourni avant les noms triviaux (par ex. Thioxo Acéton, Thioxo Benzophénon). Le préfixe Thio – est obsolète selon la dernière nomenclature IUPAC, mais est encore souvent utilisée (par ex. Thio Acéton, Thio Benzophénon). S’il y a un groupe fonctionnel avec une priorité plus élevée, le suffixe – venir Attaché (par exemple Cyclohexan venir ). C’est pourquoi les thiokétons sont également appelés thione. [d’abord]


Propriétés physiques [ Modifier | Modifier le texte source ]]
Les thiokétones sont exceptionnellement colorées, avec les couleurs qui semblent différentes. [3] Alors que les thiocétones aliphatiques faibles étaient souvent observés sous forme d’huiles rouges, les thiocétons aromatiques semblent bleus au violet (par exemple le thiobenzophénon bleu). Dans la trimérisation de z. B. Aliphates – Les thiocétones substituées, en revanche, surgissent des dérivés incolores de Trithian. [2] Les thiokétons sont en équilibre à leurs enntivats (cf. kéto-enol-tautomérie), le décalage d’équilibre est à la fois dépendant de la température et dépend du solvant et a une influence sur l’intensité des couleurs (thermochrome). Différentes thiocétons ont des tendances différentes pour la dégradation. [5] L’odeur des thiocetons est souvent décrite comme particulièrement inconfortable. Ils se dissolvent bien dans les solvants non polaires. [7] La stabilité des thiocétons dépend des restes liés et diffère considérablement: tandis que les thiocétones monomérones sont instables et donc légèrement polymérisantes, les thiocétones aromatiques sont stabilisés par leurs restes. C’est pourquoi les thiocétons diaryliques et iciocycliques sont plus stables, faciles à cristallisables et n’ont aucune tendance à polymériser. Votre odeur est un peu moins inconfortable. [2] [7] De plus, la stabilité et donc sa réactivité sont liées à la réaction photométrique. [8]
Propriétés chimiques [ Modifier | Modifier le texte source ]]
Bien que le carbone et le soufre dans la double liaison caractéristique C = S aient la même électronégativité et la double liaison pourrait donc être comprise comme une faible polaire, il est facile à polarisable. [9] Cela est évident dans leur capacité à réagir sous forme de dipolarophiles dans les réactions de cycloaddition. [dix] Fondamentalement, les composés thiocarbonyle réagissent beaucoup plus rapidement dans les cycloadditions par rapport aux composés carbonyle. [11] La structure à l’état solide peut également être fondée par des réactions intramoléculaires Diels-Alder. [douzième] Dans l’ensemble, ce sont des connexions réactionnaires qui peuvent être facilement mises en œuvre avec des réactifs nucléophiles et électrophiles. [5] La tautomérie Thioketo Entheliol décrite ci-dessus a un impact significatif sur les propriétés chimiques des thiocetons. Certains sont presque complètement contenus, en particulier dans les solvants protiques. D’autres préfèrent la condition comme thiokétone. Cela permet une large gamme de réactions avec les réactifs nucléophiles et électrophiles (chapitre: réactions). [7] De plus, la thiokétone peut former des connexions complexes avec les métaux du sixième groupe de branche. [13] Les propriétés chimiques des thiocétones de type α-β diffèrent des propriétés des thiocétones saturés. D’une part, cela est dû aux doubles liaisons conjuguées C = C et C = S, ce qui fait des thiokétons de ce type de service particulièrement amoureux de la réaction dans les réactions de Diels-Alder. D’un autre côté, la tautomérisation est exclue. Cet effet est favorisé par les substituants à glissement d’électrons en position β (effet mésomer). [5]
La synthèse des thiokétons provoque souvent des difficultés en raison de l’instabilité des monomères et de la forte odeur des scientifiques. Il a d’abord été supposé que les thiokétons pouvaient être obtenus par pyrolyse du trimère ou par l’action du sulfure d’hydrogène sur des cétones dans le milieu acide. [14] [15] Cette dernière méthode n’a fait ses preuves que dans des cas individuels. De nombreuses méthodes citées dans la littérature ont l’inconvénient que les produits sont impurs et, au lieu de thiokétons, des dithiole geminaux ont été créés. Roland Mayer a ensuite proposé une synthèse de thiocétons à partir de dithioles géminaux: [7]

Deux équivalents du dithiol sont mis en œuvre avec un dinitrile d’acide malonique, par lequel la thiokétone correspondante est formée lors de la division d’un thioamide. [5] Les dichlorures géminaux (cétochlorures) – substitués par les aryles peuvent également être utilisés. Cet educt, qui est facilement accessible à partir de cétones, est mis en œuvre avec du dithiocarbonate de ditthyle de potassium-o-éthyle. L’intermédiaire résultant réagit à la thiokétone correspondante tout en divisant le chloroéthane et le sulfure carbonyle. [3] [5] [16]

Le thiobenzophénon est un exemple classique d’une thiokétone. Les deux restes sont des résidus aryle qui stabilisent la connexion. Cette stabilité rend la thiokétone. Il peut être synthétisé de différentes manières, par exemple B. en mettant en œuvre de la benzophénone avec du sulfure d’hydrogène et de l’acide chlorhydrique (chemin UN ), ou à travers une variante de soufre de la Friedel-Crafts-acylation du benzène avec un échlorure d’acide thiosique (chemin B ): [17] [5]
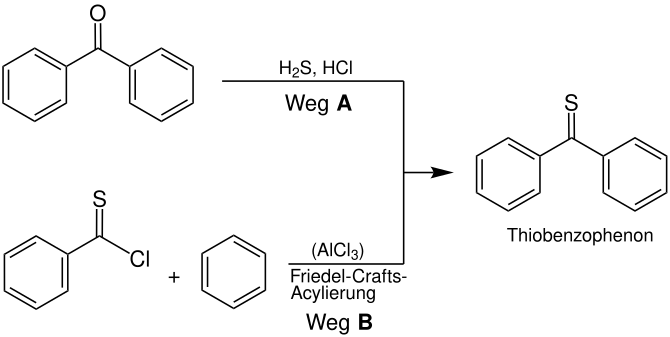
Alternativement, l’acide thioessigique peut être mis en œuvre avec des kétochlorures, par laquelle le thiobenzophénon se forme également lors de la division d’acide chlorhydrique. L’avantage de cette variante est qu’il ne se produit pas dans le milieu alcoolique, de sorte que les réactions secondaires (qui sont basées sur la réaction entre les kétochchlorures et les alcools) sont exclues. [7] De même à la synthèse de Michler’s Keton, le thioketon de Michler peut être impliqué dans la réaction de Thiophosgen N , N -Les diméthylanilines sont formées. Le chlorure de zinc agit comme un catalyseur Lewis. [11]
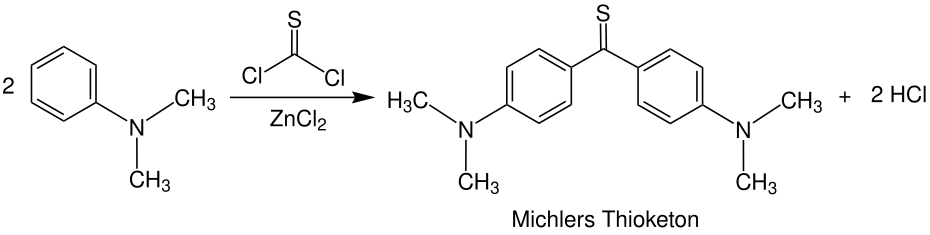
De nos jours, cependant, il existe des méthodes plus efficaces pour la thionisation. Ceux-ci contiennent souvent la mise en œuvre des cétones avec le réactif de Lawesson. D’autres variantes convertissent des cétones avec du pentasulfure phosphorérent, avec de l’oxyde d’aluminium agissant comme catalyseur.

L’idée d’utiliser le phosphorentasulfure comme réactif pour la synthèse de la thiocetone a été suggérée tôt et souvent décrite comme un bon moyen de sulfurisation de cétones. [5] L’ajout d’oxyde d’aluminium est une variante moderne qui accélère énormément la réaction et augmente les rendements. [18] De plus, d’autres méthodes de production de thiocétons ont été décrites. [19] Cela comprend la synthèse faite d’alkins avec du sulfure d’hydrogène sous l’exposition à la lumière, la réaction des cétohydrazons avec dischwefeldichlorure ou par le [3,3] Sigmatrope thio-Claisen-MachtentAntamtion de tout vinyle-ehern. [5]
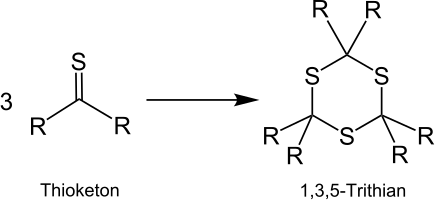
Les thiocétones aliphatiques en particulier ont tendance à trimériser en raison de leur réactivité. [2] Les Trithiens substitués sont substitués. Les dérivés de 1.3.5-trithian peuvent représenter des produits intermédiaires utiles dans les synthèses organiques. [20]
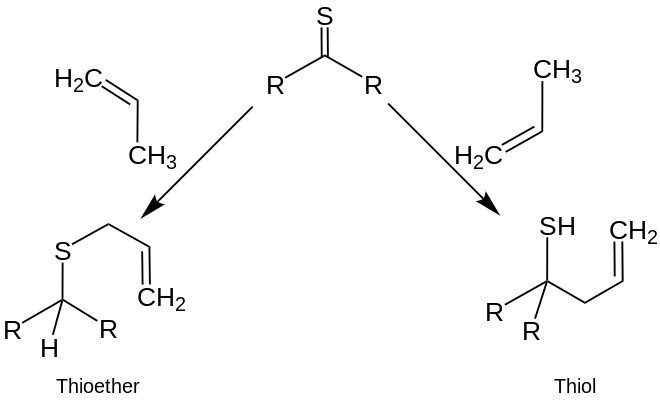
Les plus grandes différences entre les réactions des thiocétons et des cétones ont été observées dans la réaction avec des services nucléophiles, oléfines et conjugués. Alors que les attaques nucléophiles sont effectuées sur du carbonyle à l’atome de carbone du groupe carbonyle, vous pouvez se produire avec des composés thiocarbonyle à la fois sur l’atome de carbone et de soufre. [11] Avec les monooléfines, les thiokétons peuvent réagir en réactions en composés acycliques tels que les thioéthers ou les thiols:
Les produits cycliques peuvent être synthétisés par la réaction Diels-Alder par par ex. B. Un service conjugué est mis en réaction avec une thiocétone, avec la double liaison C = S représentant le diénophil:

De cette façon, les connexions hétérocycliques peuvent être synthétisées. Les réactions de cycloaddition fonctionnent beaucoup plus rapidement avec les thiocetons qu’avec des cétones. [11] Cette réaction peut également être fabriquée par le dihydrothiopyran. [21]
| Produits d’oxydation des thiokétons [9] |
|---|
 Thioket sur |
 Thioketon oxyde (Soufre dans ) |
 Thioketon dioxyde (Soufre dans ) |
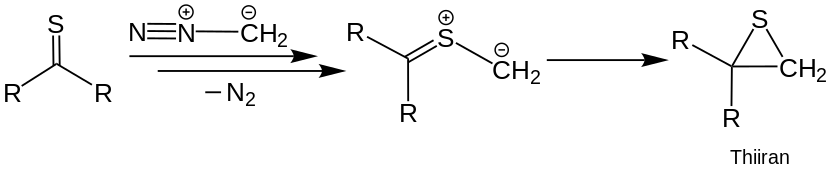
Les composés hétérocycliques peuvent également être obtenus en mettant en œuvre des thiocétons avec du diazométhane. La division de l’azote (n 2 ) a formé un intermédiaire dipolaire. Cela peut être mis en œuvre à nouveau avec une thiocetone, par laquelle les composés hétérocycliques sont obtenus par dimérisation. Cependant, l’intermédiaire peut également entrer dans une cycloaddition intramoléculaire irréversible et former du thiirane. [22] Ceux-ci peuvent être transférés à Alcène à une nouvelle étape de réaction. [9] [23] [24]
De plus, les thiokétons peuvent être oxydés. Une telle oxydation conduit à des sulfines qui S -Xides des thiokétons, et enfin au sulfène, le S , S -Dioxydes des thioketons. [9] La désignation Sulfine a été façonné par Sheppard et Diekmann à la relation structurelle avec Sulféène exprimer. [25] Cela a été introduit, en revanche, pour souligner leurs proches avec Ketensen. [26] Les deux noms sont utilisés pour des raisons traditionnelles. L’IUPAC et la littérature moderne recommandent les noms de l’oxyde de thiokétone ou du thiokétonioxyde. [27] Alors que le sulfine a été présenté tôt comme des connexions stables, cela était relativement tard avec des sulfates. [28] [29] Ce dernier est justifié dans la réactivité des sulfènes, car les charges partielles des atomes individuels sont plus prononcées que dans les sulfines, de sorte que les attaques électrophiles contre l’atome de carbone peuvent être rendues beaucoup plus faciles. Le peroxyde d’hydrogène ou les acides carboxyliques peroxy agissent principalement comme des agents oxydants, par laquelle l’oxygène d’ozone ou du chanteur a également été utilisé dans des cas individuels. Cependant, il est important que l’émetteur d’oxygène ne soit pas utilisé dans le surplus car les sulfines sont sensibles à l’oxydation et peuvent donc facilement réagir aux composés carbonyle correspondants avec la livraison de dioxyde de soufre. [4] Les thiokétons peuvent également être mis en œuvre avec des acides organiques, l’imine étant formée comme produits intermédiaires. S’ils sont divisés hydrolytiquement, les cétones et les amines primaires peuvent être préservées. [3]

Les tableaux suivants montrent un aperçu des réactions des thiokétons avec certains réactifs nucléophiles et électrophiles. Les thiocétones aliphatiques réagissent largement de manière analogue aux cétones avec des cétones avec des cétones nucléophiles sous élimination du sulfure d’hydrogène. Avec les réactifs électrophiles, presque tous les thiocétons de l’atome de soufre réagissent aux dérivés des abolies, ce qui ouvre certaines possibilités préparatoires. Les réactions sur l’atome de carbone α sont également parfois possibles. Le tableau est exemplaire lié aux thiocétones aliphatiques symétriques, les réactions peuvent également être effectuées avec des thiocétons asymétriques. [7]
Les thiokétons ont principalement une signification préparative pour les synthèses en chimie organique. [2] [trente et un] Les composés de soufre organiques offrent non seulement des possibilités de synthèse diverses, mais ils jouent également un rôle important dans les processus biologiques. Ils ont déjà été utilisés pour produire des produits pharmaceutiques, des polymères, des pesticides et des herbicides. [18] Les thiokétons conviennent particulièrement à l’introduction des atomes de soufre dans les hétérocycles. [11]
- ↑ un b Saisir Thiokétone . Dans: Römppp en ligne. Georg Thieme Verlag, consulté le 4 juin 2020.
- ↑ un b c d C’est Kracher, R. et al. (2007): Lexique de la chimie . 3. Band (perf to Cy), Jokers Edition. Héréditaire Luxembourg: Valum Publimmer. S. 342. ISBN 978-3-8274-1909-5.
- ↑ un b c d Schönberg, A. & Wagner, A. (1955): Méthodes pour la production et la conversion des thioaldhydes et des thiokétons. Dans Müller, E. (éd.): Méthodes de chimie organique . Volume IX: Soufre, sélénium, composés de caissier. Stuttgart: Thieme Verlag. Pp. 699–740.
- ↑ un b Campagne, E.: Thiones et Thials . Revues chimiques, 1946 , 39 (1) , S. 1–77. [d’abord] .
- ↑ un b c d C’est F g H je Voss, J. (1985): Thioaldhyde ou thiokétone. Dans Klamann, D. (éd.): Méthodes de chimie organique . Volume E11: composés de soufre organiques. Stuttgart: Thieme Verlag. Pp. 195–231. ISBN 3-13-218 104-8
- ↑ Verani, G. & Garau, A. (2013): Chalcogénone C = E Composés (E = S, SE, TE). À Devillanova, F. A. & Du Mont, W.-W. (Éd.): Handbook of Chalcogène Chemistry: New Perspektives in Sulphur, Selenium et Tellurium. 1. bande. Dorchester: La Royal Society of Chemistry. S. 118–149.
- ↑ un b c d C’est F g H Mayer, R. et al .: Aliphatische thioketone . Chimie appliquée, 1964 , 76 (4) , S. 157–167. Deux: 10.1002 / ange.19640760402 .
- ↑ Lewis, G.N. & Kasha, N.: Phosphorescence dans les milieux fluides et le processus inverse de l’absorption des triplettes . Journal de l’American Chemical Society, 1945 , 67 (6) , S. 994–1003. doi: 10.1021 / JA01222AA032 .
- ↑ un b c d OPITZ, G.: Sulfine et sulfues-le s-oxyde et S, s-dioxyde du thioaldhyde et thiokétones . Chimie appliquée, 1967 , 79 (4) , S. 161–177. Deux: 10.1002 / ange.19670790402
- ↑ Fišera, L. et al .: Nouvelle chimie Thione . Chimie pure et appliquée, 1996 , 68 (4) , S. 789–798. doi: 10.1351 / pac199668040789 .
- ↑ un b c d C’est McGregor, W. M. et Sherrington, D.C.: Quelques routes synthétiques récentes des thiokétones et thioaldéhydes . Revues de la société chimique, 1993 , 22 (3) , S. 199-204. doi: 10.1039 / cs9932200199 .
- ↑ Jutzi, P. et al .: À (pentaméthylcyclopentadyenyl) cétone et thiocetone: composés en carbone avec géométrie Diels-Alder préformée . Rapports chimiques, 1993 , 126 (2) , S. 415–420. Deux: 10.1002 / cber.19931260219 .
- ↑ Fischer, H. & Märkl, R.: Complexes de thiokétone par insertion du soufre des organylisothiocyanates dans la liaison au carbone en carbone métallique . Rapports chimiques, 1982 , 115 (4) , S. 1349–1354. Deux: 10.1002 / cber.19821150411 .
- ↑ Von Ettinghausen, O.G.: Polythioacétone . Polymère, 1966 , 7 (9) , S. 469–474. Deux: 10.1016 / 0032-3861 (66) 90005-X .
- ↑ Mayer, Roland, et al .: La base de la base de la mise en œuvre de cétones avec du sulfure d’hydrogène . Chimie appliquée, 1963 , 75 (21) , S. 1011–1014. Deux: 10.1002 / ange.19630752103 .
- ↑ Transporté C. (1978) Réactions de synthèse organique: 2700 réactions de fabrication et de conversion techniques et préparatoires . Stuttgart: Thieme. S. 490f. ISBN 3-13-487401-6.
- ↑ Viola, H. et al .: Réactions de friedel-arrafts avec les échlorures d’acide thiosique . Polymère, 1968 , 101 (10) , S. 3517–3529. Deux: 10.1002 / cber.19681011024 .
- ↑ un b Polshettiwar, V. & Kaushik, M.P.: Une nouvelle méthode efficace et simple pour la thionation des cétones aux thiokétones en utilisant p 4 S dix /Al 2 O 3 . Lettres de tétraèdre, 2004 , 45 (33) , S. 6255–6257. doi: 10.1016 / j.tetlet.2004.06.091 .
- ↑ Mloston, G. & Heimgartner, H. ( 2002 ): Dr.Boponylyly se verrouille. À Penson, W.H (HRS.): La chimie des composés hétérocycliques: applications synthétiques de la chimie de cycloaddition 1,3-dipolaire vers les hétérocycles et les produits naturels . New York: Wiley. S. 315–360. Deux: 10.1021 / JA025264V .
- ↑ Saisir Trithiane . Dans: Römppp en ligne. Georg Thieme Verlag, consulté le 4 juin 2020.
- ↑ König, B. et al .: Composés de soufre organiques, 8. Communication: Formation de thiophhénes par pyrolyse de dihydrothiopyranes, réactions des adduits de Diels-Alder du thiodeon et du 1,3-butdia dans la chaleur et sous un choc électronique . Rapports chimiques, 1974 , Bd. 107. S. 2931–2937, Deux: 10.1002 / cber.19741070916 .
- ↑ Kellogg, Richard M.: Les molécules r2cxcr2 y compris l’azométhine, le carbonyle et le thiocarbonyl ylides. Leurs synthèses, leurs propriétés et leurs réactions. Tétraèdre, 1976 , 32 (18) , S. 2165–2184. doi: 10.1016 / 0040-4020 (76) 85131-9 .
- ↑ Sustmann, R. et al .: Une étude informatique des cycloadditions de la thiobenzophénone s-méthylide au thiobenzophénon . Journal de l’American Chemical Society, 2003 , 125 (47) , S. 314425–14434. Deux: 10.1021 / JA0377551 .
- ↑ Huisgen, R., et al .: Développements récents de la chimie du thiocarbonyl ylides . Bulletin des Sociétés Chimiques Belges, 1984 , 93 (7) , S. 511–532. Deux: 10.1002 / bscb.19840930701 .
- ↑ Sheppard, W.A. & Diekmann, J.: Sulfines . Journal de l’American Chemical Society, 1964 , 86 (9) , S. 1891–1892. Deux: 10.1021 / ja01063a075 .
- ↑ Wedekind, E. & Schenk, D.: Sur le comportement des sulfochlorures contre de fortes bases tertiaires . Rapports de la Société chimique allemande, 1911 , 44 (1) , S. 198-202. Deux: 10.1002 / cber.19110440129 .
- ↑ Hellwinkel, D. (2006): La nomenclature systématique de la chimie organique: instructions pour une utilisation . 5e édition. Berlin: Springer. Pp. 113–146. ISBN 3-540-26411-6.
- ↑ King, J. F., Marty, R. A., De Mayo, P., et Verdun, D. L.: Mécanismes de soufre organiques. Xi. Thermolyse flash. Vii. Réactivité et spectre infrarouge du sulfène . Journal de l’American Chemical Society, 1971 , 93 (23) , S. 6304–6305. [2] .
- ↑ Sander, W., Kirschfeld, A. & Halupka, M.: Isolement matriciel de diphénylsulfène et de diphényl-α-élong . Journal de l’American Chemical Society, 1997 , 119 (5) , S. 981–986. Doi: 10.1021 / ja962949k .
- ↑ Mayer, R., Scheithauer, S. & Kunz, D.: Réduction de Clemmensen et potentiel de demi-niveau de certains acides et descendants thiocarboniques . Rapports chimiques, 1966 , 99 (4) , S. 1393–1413. Deux: 10.1002 / cber.19660990449
- ↑ Metzner, P. (1999): composés thiocarbonyle comme outils spécifiques pour la synthèse organique. Dans Page, P.C.B (éd.): Organosulfur Chemistry I. Berlin: Springer. S. 127–181, ISBN 3-540-65787-8.
Recent Comments