Enantiomerie – Wikipedia
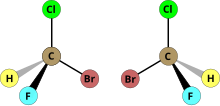
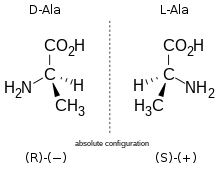
L ’ Enantimerry jest właściwością niektórych cząsteczek stereoizomerów, z których dwa są wzajemnym obrazem w lustrze planowym, ale nie są nakładane. Mówi się, że cząsteczka z dwoma enancjomerami jest chiralna. Z drugiej strony, jeśli cząsteczka jest identyczna z własnym obrazem w lustrze, mówi się, że jest achiralna. Chiralność może być należna:
W przypadku centrum stereogenicznego konfiguracja wokół tego centrum jest wskazywana przez litery R Lub S , zgodnie z zasadami nomenklatury Cahn-Ingold-Prelog. W przypadku spiralnej chiralności, nomenclatyre d, l jest często używany.
W chemii [[[ modyfikator |. Modyfikator i kod ]
Chemicznie dwa enancjomery mają identyczną reaktywność z innymi cząsteczkami niechirusowymi. Mają te same właściwości fizyczne i przeciwną moc obrotową.
I biologia [[[ modyfikator |. Modyfikator i kod ]
Na poziomie biologicznym dwa enancjomery cząsteczki, na przykład leku, mogą mieć różne działanie fizjologiczne, nawet antagoniczne. Wyjaśnia to fakt, że układy biologiczne zależą bezpośrednio od kształtu cząsteczki. Sami są enancjopurami i oddziałują inaczej z dwoma enancjomerami zewnętrznego centrum chiralnego, w którym interakcje są diastereomeryczne.
Związki między działaniami biologicznymi każdego czystego stereoizomeru a aktywnościami ich mieszanin są często bardzo złożone, a ich analiza wymaga w badaniach i szczegółowych badaniach. Zdarza się jednak, że dwa enancjomery mają podobne działania na poziomie biologicznym.
Tragicznym przykładem różnych efektów dwóch enancjomerów jest talidomid. Ta substancja stosowana w różnych lekach ma dwa enancjomery. Konfiguracja (r) cząsteczki ma efekty uspokajające i anty-nuzy (szczególnie w osobie w ciąży), podczas gdy konfiguracja (konfiguracja) ma działanie teratogenne. Zastosowanie talidomidu spowodowało istotny skandal zdrowotny na początku lat 60. XX wieku. Rzeczywiście jest od 10 000 do 20 000 ofiar [[[ Pierwszy ] .
W farmaceutyce [[[ modyfikator |. Modyfikator i kod ]
Analiza i rozdzielenie enancjomerów (które tworzą strukturę przestrzenną i funkcjonalną naszego środowiska biotycznego i abiotycznego) jest niezbędna do postępu badań w większości dziedzin naukowych.
Prawie 2/3 biologicznie aktywnych cząsteczek chiralnych z klasycznej syntezy (nie -enantioselektywne) pochodzi z duplikacji (separacja enancjomerów), które reprezentują jedną z głównych dróg dostępu do enancjomerycznie czystych. Produkcja produktów enantiopurów reprezentowanych w Stanach Zjednoczonych, w 1995 r. Kolosalna suma prawie 60 miliardów Dolary.
W przypadku tych cząsteczek najbardziej aktywny enancjomer nazywa się słownictwem farmaceutycznym „Eutomère” „eutomerem” co do efektu, a drugi nazywany jest „Distomer”. Ten ostatni może być mniej aktywny, nieaktywny lub mieć zupełnie inny efekt, być może niepożądany [[[ 2 ] . W najlepszych przypadkach jest to opłata, którą wątroba będzie musiała metabolizować oprócz składnika aktywnego. Czasami zdarza się, że każdy enancjomer ma zainteresowanie farmaceutyczne: na przykład propoksyfen- (R) jest przeciwbólowym, sprzedawanym pod nazwą Darvon, a jego enancjomer jest przeciwnikiem, sprzedawanym pod nazwą w Mirror of Novrad. [[[ 3 ] .
Nomenklatura [[[ modyfikator |. Modyfikator i kod ]
Istnieją trzy rodzaje nomenklatury, które różnicują enancjomery: R/S, D/L i +/- .
Zasady pojawiają się na stronie chiralności.
Ilość [[[ modyfikator |. Modyfikator i kod ]
Dla danej cząsteczki jest maksymalnie 2 N Izomery optyczne dla związku z n centrami stereogenicznymi, ponieważ należy również wziąć pod uwagę fakt, że podczas poszukiwania izomerów optycznych można znaleźć dwa, trzy, nawet czterokrotnie ten sam stereoizomer.
Pierwszym przykładem rozdzielczości chiralnej (oddzielenia enancjomerów) jest Louis Pasteur, który w 1848 r. Izola Isolę dwa enancjomery kwasu tartarowego przez ręczne sortowanie kryształów enancjomorfów.
Od tego czasu pojawiły się nowe techniki i metody przeprowadzające powielanie ras
Metody chemiczne [[[ modyfikator |. Modyfikator i kod ]
Metody te wymagają diastereoizomerów, przygotowanych z ras przez trening soli lub wyprowadzenie związków enancjopurów, a następnie oddzielone krystalizacją lub chromatografią lub transformacjami stereoselektywnymi.
Do chiralnego oddzielenia szerokiej gamy związków stosuje się kilka metod chromatograficznych. W tym procesie pozycje równowagi między stanami powiązanymi i niepowiązanymi są różne dla dwóch enancjomerów. To jest podstawa separacji.
Zastosowanie kolumny z chiralną fazą stacjonarną lub chiralnym dodatkami w fazie ruchomej jest bardziej „elegancką” drogą rozdziału enancjomerów niż przez syntezę związków diastereoizomerów przy użyciu optycznie czystego odczynnika. Wśród podejść do uzyskiwania optycznie czystej substancji, chromatografia fazowa nadkrytyczna (SFC) jest zdecydowanie najczęściej stosowaną metodą dyskryminacji enancjomerów [[[ 4 ] . W szczególności cyklodekstryny są chiralnymi fazami stacjonarnymi stosowanymi również w separacji enancjomerycznej innymi metodami, takimi jak elektroforeza kapilarna, CPG i HPLC. Są one również stosowane w jądrowym rezonansie magnetycznym (RMN) jako chiralne pomocnicze do określenia nadmiaru enancjomerycznego. Powstawanie związków włączenia i ich stosowanie chiralnego separacji są stosowane w terenie, ale także w przemyśle chemicznym i agrifood (przypadki balsamu mentolowego lub cytrynowego). [nie jasne]
Metody biologiczne [[[ modyfikator |. Modyfikator i kod ]
Metody te polegają na stosowaniu enzymów, które są związkami, które katalizują stereospecyficzne transformacje. Na przykład w celu oddzielenia dwóch enancjomerów od 1,1′-bi-2-naftol, metodą jest reagowanie z chlorkiem pentanoyle, chlorkiem kwasu pentanowego (CH 3 (Ch 2 ) 3 COCL), aby utworzyć Di-Est. Estérase cholesterolu enzym jest następnie wprowadzany w postaci aliconicznej trzustki bydlęcej, który jest w stanie zhydrolizować Di-Ester ( S ), Ale nie Di-Ester ( R ) [[[ 5 ] . Dipropanoan (R) jest hydrolizowany w drugim etapie z metodoksydem sodu (CH 3 Następnie) [[[ 6 ] .
- Jérôme Janicki, Dramat talidomidu: narkotyk bez granic, 1956-2009 , Paris, L’ArmaTatan Editions, coll. „Aktorzy nauki”, , 280 P. (ISBN 978-2-296-08968-6 , OCLC 497004808 , Bnf 41494914 W Czytaj online ) W P. 8-9 .
- Słownictwo chemii farmaceutycznej W Oficjalny dziennik Republiki Francuskiej .
- Paul Warehouse, Bajeczna historia współczesnych budowniczych chemii , Bruksela, Boeck Editions, W 2 To jest wyd. , 170 P. (ISBN 978-2-8041-7564-1 ) W P. 70 .
- Syem Kaher, Racjonalizacja procedur separacji związków chiraux z celami farmaceutycznymi i kosmetycznymi , Analytical Chemistry, University of Orleans, 2014, NNT: 2014RLE2060.
- Dongwei Cai, David L. Hughes, Thomas R. Dravene It Paul J. Ride, Rozdzielczość 1,1′-bi-2-naftol W Synteza organiczne , Coll. tom. 10, s. 1 93, t. 76, s. 1 1.
- Romas J. Kazlauskas, (S)-(-)-i (r)-(+)-1,1′-bi-2-naftol W Synteza organiczne , Coll. tom. 9, str. 77, t. 70, s. 1 60.
Powiązane artykuły [[[ modyfikator |. Modyfikator i kod ]
Linki zewnętrzne [[[ modyfikator |. Modyfikator i kod ]
- (Historia nauki) Artykuł z 1822 r. Fresnela na temat chiralności, online i skomentowany na stronie Bibnum
- (Historia nauki) Artykuł z 1848 r Bibnum
Recent Comments