Takan Josewe Lochmoncade – Wikipétia
Yeshan Josef Losch , urodzony w Počerny, wiosce Bohemia w pobliżu słynnej stacji termicznej Carlsbad lub Karlovy różnią się i zmarła W Wiedniu był austriackim fizykiem i chemikiem. Jesteśmy mu winni pierwsze modele molekularne z okazji, w której wprowadza symbole podwójnych i potrójnych wiązań, a także możliwość istnienia cząsteczek cyklicznych i heterocyklicznych. Przeprowadził pierwszą determinację liczby Avogadro, która zostanie dopracowana przez Jamesa Clerka Maxwella, a następnie Jeana Perrina. Dzięki intelektualnej rygorystycznej i przez ludzkie cechy miał decydujący wpływ na Ludwiga Boltzmanna, jego młodego kolegi-nauczyciela-badacza w Institute of Physics of University of Vienna.
Josef Loschmidt (użyje tylko drugiego imienia) pochodzi z regionu Southet, który był częścią imperium austro-węgierskiego i który obecnie stanowi region Karlovy różnią się w Republice Czech. Urodził się w rodzinie biednych rolników. Na zalecenie ojca Adalberta Czecha był wykształcony w latach 1833–1837 w klasztorze Piariste w Schlackenwerth (Ostrov nada Ohří, na czesku), niedaleko Pradze. Następnie może zarejestrować się na Uniwersytecie Charlesa de Pradze w 1839 roku, aby studiować filozofię i matematykę. Przybywa na ten uniwersytet w tym samym czasie, co jego nauczyciel filozofii, Franz Serafin Exner, który będzie jego drugim mentorem. Ten ostatni sugeruje, aby zastosował metody matematyczne do problemów psychologicznych. Chociaż ten projekt się nie powiedzie, Loschmidt staje się dobrym matematykiem. W 1841 r [[[ Pierwszy ] .
Nie był w stanie uzyskać stanowiska uniwersyteckiego, założył wraz z przyjacielem, firmą produkcyjną azotanów potasu w Wiedniu. Ale społeczeństwo zbankrutowało w 1849 roku. Przed powrotem do Wiednia dokonał różnych transakcji w stylu, Czechach i Morawie. W 1856 r. Został profesorem w wiedeńskiej szkole średniej, w której uczył matematyki, fizyki, chemii i rachunkowości, rozpoczynając badania nad chemią. W 1866 r. Josef Stefan, postrzegając znaczenie swoich projektów, otworzył dla niego drzwi Instytutu Fizyki.
To w Institute of Physics on Rue Erdberg, kierowany przez Josefa Stefana na uniwersytecie w Wiedniu, który poznał, w latach 1866–1869, jego młody kolega Ludwig Boltzmann, który został jego przyjacielem i na którym wywiera duży wpływ. Loschmidt został mianowany profesorem-asystentem w 1868 r. W 1869 r. Podano mu doktorat honorowy, co pozwoliło mu uzyskać dostęp do przewodniczącego chemii fizycznej w 1872 r. I podjąć kierunek laboratorium chemii fizycznej w 1875 r. W 1877 r. Został wybrany Dean wydziału. Został wybrany członkiem Austriackiej Akademii Nauk [[[ 2 ] .
W 1887 r., W wieku 66 lat, Josef Loschmidt poślubił Karoline Mayr (1846–1930), jego wieloletnią kobietę sprzątającą. Niedługo potem urodził się Josef, „nasze jedyne dziecko” (napis na nagrobku), zmarł w 1898 r., Trzy lata po jego ojcu. Jednak czwarte i nazwisko pojawiające się w nagrobku to nazwisko Karoline Mayr (1885–1950), która dlatego urodziła się dwa lata przed ich synem Josefem. Grób rodziny Loschmidt znajduje się na centralnym cmentarzu Wiednia.
Josef Loschmidt przeszedł na emeryturę jako nauczyciel w 1891 r. Zmarł w Wiedniu w 1895 roku. Ludwig Boltzmann ogłosił swoją pochwałę pogrzebową przed Akademią Nauk. Przywołuje swoich dwóch mentorów: Josef Stefan i Josef Loschmidt [[[ 3 ] :
„Ponieważ byli bezpretensjonalni, dzięki swojej prostocie i skromności wyglądali bardzo podobni. Nigdy nie próbowali pokazywać swojej intelektualnej wyższości. Przez długie lata spędziłem z nimi, najpierw jako student, a następnie jako asystent, zawsze traktowali mnie jak przyjaciela. Ich olimpijczyka i świetny humor, który sprawił, że największe dyskusje były zabawną rozrywką dla uczniów, oznaczyły mnie do tego stopnia, że wpłynęło na mój sposób bycia. »»
W 1861 roku Loschmidt opublikował na swój koszt Mała książka zatytułowana Badania chemiczne . Książka zawiera dwie części: pierwsza zatytułowana Graficzna reprezentacja konstytucyjnych formuł chemii organicznej , drugi O prawie Mariotte . Po tekście następuje siedem złożonych arkuszy, na których rysowane są modele cząsteczek, niektóre znane, inne tylko możliwe. Książka została przedrukowana w 1912 r. Z liczbami zintegrowanymi z tekstem. Prace te wykazują dwa postępy rewolucyjne: opis struktury cząsteczek chemicznych i pierwsze podejście do określenia liczby Avogadro [[[ 4 ] .
Reprezentacja struktury cząsteczek [[[ modyfikator |. Modyfikator i kod ]
Kontekst publikacji Badania chemiczne (1861) [[[ modyfikator |. Modyfikator i kod ]

W pierwszej części swojej pracy Loschmidt opisuje 368 cząsteczek (w tym 121 aromatów) za pomocą swojego Formuły konstytucyjne , Wciąż bardzo dobrze zrozumiane przez chemicy, pokazując przestrzenny układ atomów [[[ 5 ] , co oznacza, że niektórzy uważają to za za ojciec modelowania molekularnego [[[ 2 ] . Inni mówią, że napisał pierwszy ilustrowany traktat chemii organicznej [[[ 4 ] . Jednak kiedy publikuje swoją pracę, Loschmidt jest tylko małym nauczycielem edukacji średniej, który nie jest lekarzem, którego nikt nie wie. Dlatego nie ma szans na opublikowanie swojej pracy w dobrym czasopiśmie naukowym. Ale fakt, że nie jest to akademickie zaletę: nie podlega dominującej filozofii dotyczącej znaczenia formuł chemicznych wprowadzonych przez Berzeliusa. Ten sam rok Badania chemiczne , August Kekule, punkt odniesienia dla europejskiej chemii (następnie uczy na University of Ghent), opublikował swój Traktat chemii organicznej w którym pisze [[[ 6 ] :
„Musimy pamiętać, że racjonalne formuły są tylko formułami, a nie formułami konstytucyjnymi … w żaden sposób nie opisują pozycji atomów … należy to wyraźnie podkreślić, ponieważ niestety, niestety, niektórzy chemicy nadal wierzą w to Te wzory opisują pozycje atomowe. »»
Loschmidt jest zatem jednym z heterodoksyjnych chemików, którzy nie przylegają do tezy Kekule’a. Trudno wiedzieć, który wpływ miał jego książkę, ale opublikowano jeszcze z renomowanym wydawcą. Loschmidt wyraźnie odwołuje się do pracy innych chemików, ale w przeciwieństwie do zastosowań akademickich nie wspomina o żadnej publikacji w swojej pracy. W zamian jego koledzy udają, że go ignorują, nawet jeśli przeczytali jego prezentację. Jeśli zatytułował swoją książkę Badania chemiczne , dzieje się tak, ponieważ zamierza opublikować drugi tom, być może na temat izomerii. Wydaje się jednak, że pogardliwa krytyka jego pracy Kekule’a doprowadziła go do definitywnego odwrócenia się od chemii i poświęcenia się problemom fizyki [[[ 2 ] .
Wartościowość i reprezentacja podwójnych i potrójnych linków [[[ modyfikator |. Modyfikator i kod ]
W 1852 roku angielski chemik Edward Frankland wprowadził koncepcję atomowość Aby wyrazić zdolność atomów różnych elementów do przesyłania wodoru. Atomowość tlenu wynosi 2 (OH 2 ), azot wynosi 3 (NH 3 ), a węgiel wynosi 4 (CH 4 ). W 1857 r. Kekulé rozpoznał, że atomy węgla były w stanie utworzyć łańcuch (CCCC), który Archibald Cour proponuje napisać (-C-C-C-), wprowadzając cechy reprezentujące łącza. Ale jak napisać cząsteczkę etylenu C 2 H 4 ? Tutaj pojawia się Loschmidt.
Po pierwsze, aby uwzględnić zdolność atomów do tworzenia linków, Loschmidt zastępuje koncepcję atomowość przez Walencję, którą nazywa Pollenz i kto nie zostanie wyznaczony wartościowość Hermann Wichelhaus, który w 1868 r. Ta koncepcja pozwoliła mu symbolizować po raz pierwszy podwójne lub potrójne połączenia z dwoma lub trzema równolegle, ponieważ często je reprezentuje ich dzisiaj [[[ 7 ] .
Reprezentuje węgiel przez proste okrąg, tlen przez dwa koncentryczne kółka i azot przez trzy koncentryczne kółka. Te trzy atomy są reprezentowane o tym samym rozmiarze. Wodór jest reprezentowany przez mniejszy okrąg i siarkę go przez większe koło. W prostych połączeniach koła są zestawione. W wielu linkach kółka nakładają się na siebie, a co ważniejsze dla potrójnych połączeń niż dla podwójnych linków. Dlatego uważa, że odległość międzyatomowa jest różna i że atomy są w stanie podzielić się swoją czystą przestrzenią z sąsiadami w sposób ważniejszy, ponieważ liczba zaangażowanych linków jest większa.
Reprezentacja cyklicznych cząsteczek [[[ modyfikator |. Modyfikator i kod ]

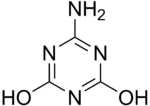
Loschmidt wprowadza innowacje, odważając się reprezentować cykliczne cząsteczki. Rysuje ozon jako cząsteczka utworzona przez trzy atomy tlenu połączone dwa z dwoma prostymi połączeniami, czego nie pozwalają ograniczenia kąta walencyjności. Opisuje także strukturę cyklopropanu, która zostanie odkryta dopiero 21 lat później do sierpnia Freund. Opisuje również około dwudziestu lub bardziej złożonych cząsteczek wprowadzających cykle 1.3.5-triazyny, takie jak kwas cyjanurowy, melaminę lub ammelid.
Pisze, że prawdopodobne jest, że rodniki fenylowe mają konstytucję podobną do konstytucji cyklopropanu. Dlatego proponuje model benzenu złożonego z dwóch nałożonych grup sojuszniczych, przyjmując strukturę w arkuszach wspomnianych wcześniej przez Kekule’a. Nie znajdując zadowalającego roztworu, opisuje związki aromatyczne, reprezentując jądro fenylowe dużym kołem, rodzaj super atomu walencji 6.
Kto odkrył cykliczną strukturę benzenu? [[[ modyfikator |. Modyfikator i kod ]
Istnieje kontrowersja dotycząca autorstwa odkrycia cyklicznej struktury benzenu: czy to August Kekule, kto jest autorem, czy też zdecydowanie zainspirował idee Loschmidta?
Kekule [[[ modyfikator |. Modyfikator i kod ]

August Kekule, wynalazca tetratomiczności węgla, rozróżnienia między korpusami tłuszczowymi, złożonymi z liniowych sekwencji atomów węgla i ciał aromatycznych, najpierw zaproponował liniową strukturę benzenu w 1859 r. [[[ 8 ] , potem regularny sześciokąt w 1866 roku [[[ 9 ] , przed sukcesem, w 1872 r., Do cyklicznej struktury, w której podwójne obligacje są mobilne [[[ dziesięć ] . Liczby związków aromatycznych, które opublikował w 1865 r., Nie są modelem molekularnymi, podobnie jak Loschmidt. Są to wzorce zasad, w których reprezentuje atomy przez patyki (to, co jego współcześni nazywają Kekulé Sausages ). Zapewnia: „Utrzymuję formularz, który przyjąłem w 1859 r. … Ten formularz wydaje mi się lepszy niż modyfikacje zaproponowane przez MM. Loschmidt i Cross-Brown (przypis 2). »» W liście do Emil Erlenmeyer Kekule leczy modele Loschmidt z CHWUSIONSFORMELN , to znaczy Formuły zamieszania zamiast Formuły konstytucyjne.
Można jednak zauważyć, że używa reprezentacji podwójnych wiązań wprowadzonych przez Loschmidt i że to nawet reprezentacja prostych i podwójnych alternatywnych wiązań, które stanowią serce jej reprezentacji [[[ 8 ] :
„Kiedy kilka atomów węgla łączy się ze sobą, mogą się spotkać w taki sposób A z czterech powinowactw każdego atomu nasyconego A Powinowactwo sąsiedniego atomu. W ten sposób wyjaśniłem homologię i ogólnie konstytucję substancji tłuszczowych.
Możemy jednak przyznać, że kilka atomów węgla spotyka się, łącząc dwa powinowactwo przeciwko dwa . Możemy również przyznać, że są one naprzemiennie połączone przez A i przez dwa powinowactwo.
Jeśli pierwszy tryb wyjaśnia skład substancji tłuszczowych, drugie doniesienia o konstytucji substancji aromatycznych lub przynajmniej jądra wspólnego. Rzeczywiście, sześć atomów węgla, łącząc się zgodnie z tym prawem symetria, da grupę, która uważa się za a Otwarty łańcuch , nadal będzie miał osiem Nietrutowane powinowactwa (ryc. 1). Jeśli przyznamy, wręcz przeciwnie, dwa atomy, które kończą ten łańcuch, łączą się ze sobą, będziemy mieli zamknięty łańcuch nadal sześć Nietrutowane powinowactwa (ryc. 2). »»
„Muszę zauważyć, że dla zamkniętego łańcucha C 6 A 6 , Wolałem zachować linię poziomą i którą reprezentowałem przez strzałki powinowactwa (terminale), które mają się nasycić. Punkty pierwszych dwóch formuł wskazują nienasycone powinowactwo (przypis 2). »»
Łańcuch jest zamknięty, może być możliwe tylko w planie prostopadłym do planu strony. Kekule nie wskazuje, w jaki sposób łańcuch, który reprezentuje złożony z patyków, może zginać. Roth proponuje, aby dwie pary atomów znajdują się na każdym końcu rozprysku łańcucha wokół prostych linków B i powinowactwo bezpłatnie ‘i łączyć się w (ryc. 4) [[[ 11 ] .

To odkrycie ma znaczny zakres rozwoju chemii organicznej. W 1890 r. Niemiecka firma chemii zorganizowała sympozjum na cześć Kekulele z okazji 25 To jest rocznica jego publikacji na temat Benzene. Ten Kongres jest znany jako Benzolfest . Przy tej okazji Kekulele oświadcza, że idea benzenu w miarę pierścieniowej cząsteczki przyszedł do niego po śnie, w którym wąż został zjedzony w ogonie, który odpowiada starożytnej symbolu znanym jako Ouroboros [[[ 2 ] . Biorąc pod uwagę anegdoty i okoliczności cytowane przez Kekule’a, ten sen miałby miejsce w 1862 roku [[[ dwunasty ] .
Kekule nabyłby zatem cykliczną formułę benzenu w snach, w tym samym roku, w którym dowiedział się o pracy Loschmidta, w której ten ostatni reprezentuje jądro fenylowe jako koło. Alfred Bader widzi tutaj zgodność, którą Sigmund Freud mógł przeanalizować znaczenie: czy Kekule nieświadomie ukrył prawdziwe pochodzenie swojego pomysłu pod okładką snu? Bader podkreśla również, że niemieckiemu profesorowi sławne było uznanie najmniejszej wartości nieznanego austriackiego i uznanego za pretensjonalnego, w kontekście rosnącej wrogości między Prusami a Austrią, która zakończyła się wojną austro-pruską od 1866 roku [[[ 2 ] .
Kwestionowanie oryginalności odkrycia Kekule pochodzi z początku Xx To jest Century, gdy Richard Anschütz, publikując dzieła Kekule, odkrywa ważny wkład Loschmidt, który stał się (lub pozostał) całkowicie nieznany, i postanawia opublikować zaktualizowaną i zmodernizowaną wersję Badania chemiczne [[[ 13 ] . W 1987 roku F. Kirchof écrit to „Idea, że związek może mieć okrągłą strukturę, był całkowicie nieznany chemikom tamtych czasów. Krąg był symbolem niepodzielnego atomu i zasługą przedstawienia Corm C 6 MY Ponieważ okrąg bezsprzecznie powraca do Loschmidt ” [[[ 2 ] . Georges Kauffman subskrybuje niniejszą Deklaracja [[[ 4 ] . Od tego czasu pewna liczba historyków i chemików uważała, że Kekule zainspirował pracę Loschmidta, przynajmniej do budowy cyklu benzenicznego.
Loschmidt i formuła benzenu [[[ modyfikator |. Modyfikator i kod ]

Loschmidt nie opisuje i nie rysuje w swojej książce sześciokątnej struktury benzenu Badania chemiczne . Po prostu zauważa, o cyklopropanie, że struktura pierścienia „Jak zobaczymy później o fenylach, w niektórych przypadkach pojawia się w niektórych przypadkach jako najbardziej akceptowalne z założeń” . Dlatego rozważył to, ale nie wie, jak narysować to z taką samą precyzją jak jego inne modele. Proponuje symboliczne reprezentowanie jądra fenylowego dużego koła, jak atom sześciowartościowy. To pozwala mu poprawnie przedstawić kilka aromatycznych cząsteczek: benzen, toluen, kwas benzoesowy, itp. Ale ta reprezentacja prowadzi również do aberracji takich jak to, co nazywa indygo. Model ten oznaczałby, że atom węgla jest pentalalentny (pozycja 4), że dwa atomy są białkowe (pozycje 3 i 5) i że dwa atomy są trójwartościowe (pozycje 2 i 6). Loschmidt oczywiście nie ma pojęcia o tym, co reprezentuje jego koło [[[ 11 ] .
Podsumowując, August Kekule Ojciec Benzene . Zaproponował strukturę, której Loschmidt nie konceptualizował. Istnieją jednak dwie zaskakujące rzeczy w historii tego odkrycia. Pierwszym z nich jest to, że Loschmidt, szczegółowo narysowany i dokładnie duża liczba cząsteczek zawierających cykl 1,3.5-triazyd, nie zdawał sobie sprawy, wymieniając atomy azotu za pomocą węgla atomów, uzyskałby bardzo obronną cząsteczkę benzeniczną. Po drugie, Kekule, obsesja na punkcie struktury benzenu, nie od razu, patrząc na modele Badania chemiczne , odkrycie, które Loschmidt powinien był dokonać. Jego pogarda dla jego austriackiego kolegi uniemożliwiła mu przeczytanie i przyznanie najmniejszego uznania konstytucyjnymi formułami Loschmidt, ale widział je. Umożliwiło mu to uświadomienie sobie czterech lat po opublikowaniu Loschmidt, formuły benzenu, który silnie przypomina wzór 1,3,5-triazydów.
Nazwa Loschmidt [[[ modyfikator |. Modyfikator i kod ]
W 1811 r. Amedeo Avogadro wydało pomysł, że objętość pewnej ilości gazu miała być proporcjonalna do liczby cząsteczek zawartych w tym tomie. W 1865 roku, w drugiej części jego pracy Badania chemiczne , Josef Loschmidt oblicza pierwsze przybliżenie liczby cząsteczek powietrza na jednostkę objętości. Szacuje, że jest 1,81 × 10 24 Cząsteczki przez m 3 powietrze. Ta liczba jest ponownie ustalona na 1,9 × 10 25 Maxwell, który do niego dzwoni Loschmidt stała [[[ 14 ] . W 1909 roku Jean Perrin [[[ 15 ] obliczył liczbę cząsteczek zawartych w mole gazu i nazywał to Nazwa d’Avogadro : N A = 6,02 × 10 23 . Wiedząc, że kret gazu zajmuje 22.4 L W normalnych warunkach temperatury i ciśnienia stała Loschmidt jest równa L = 269 × 10 25 M −3 . To odkrycie Loschmidta było bardzo ważne dla młodego Boltzmanna. Skonsolidowała swoje koncepcje atomistyczne i jej probabilistyczne podejście do jej teorii ciepła.
Rozmiar cząsteczek powietrza [[[ modyfikator |. Modyfikator i kod ]
W 1866 r. Określił wielkość cząsteczek stanowiących powietrze. Opiera się na poprzednich miarach i obliczeniach Rudolfa Clausiusa i Jamesa Clerka Maxwella. Prowadzi do rządu wielkości średnicy cząsteczek powietrza 10 −9 M . Jest to niezwykłe obliczenia, ponieważ wiemy dzisiaj, że średnica molekularna dwoksygen wynosi 0,29 × 10 −9 M i że Diazote wynosi 0,31 × 10 −9 M .
- (z) Josef Loasmi, Studien I, A. A. Party Formoln der w grafice Darstellung; B. Das Marotot’sche Gesetz (badania chemiczne; A. Graficzna reprezentacja formuł konstytucyjnych chemii organicznej; prawo B. Mariotte) , Vienne, Carl Rollder’s South, , 53 P. ( Czytaj online ) .
- (z) Richard Aschütz, ‘ Josef Loschmidt, Chemical Studies I, A. Formuły konstytucji chemii organicznej w reprezentacji graficznej; B. Prawo Maryi » W Ber. Deut. Chem. Ges., Vol. 45 W W P. 539-600 .
- (z) Josef Loasmi, ‘ Zur Grösse der LuftMolecüle (o wielkości cząsteczek powietrza) » W Spotkanie raportów z Imperial Academy of Science Vienna, 52, t. II, W W P. 395-413 ( Czytaj online ) .
- (W) Josef Lishemidt, Traducers, William Porterfield i Walter Kruse, ‘ O wielkości cząsteczek powietrza » W Journal of Chemical Education, 72 (10) W W P. 870-875 ( Czytaj online ) .

- Nagroda Josepha Loschmidta podane przez Royal Society of Chemistry [[[ 16 ] .
- Medal Josef Loschnmidt Przypisane przez Gesellschaft Österreichischer Chemiker (Göch), austriacka firma chemii [[[ 17 ] .
- Sympozjum na cześć Josefa Loschmidta, które odbył się w Wiedniu w Austrii [[[ 18 ] .
- W 1995 r. Przez Austrian Austrian Post został wydany pamiątkowy pieczęć w stulecie śmierci Josefa Loschmidta.
- Pamiątkowa tablica i czyste kamienne popiersie na University of Wiedeń.
- Pamiątkowa tablica w swoim miejscu urodzenia w Pocerny.
- Brązowa tablica z portretem (zaprojektowanym przez profesora Ferdynanda Welza) w ostatnim domu zamieszkałym przez Loschmidta w Wiedniu, Lacknergasse 79, w latach 1890–1895.
- 2003, brązowa tablica z portretem, stworzona przez Mikosa Armulidisa w starym klasztorze Ostrov nada Ohří (w języku niemieckim: Schlackenwerth), gdzie był w szkole w latach 1833–1837.
- (z) Robert Knott, ‘ Loschmidt, Johann Joseph » , W Ogólna niemiecka biografia (ADB) W tom. 52, Lipsk, Duncker & Humblot, W P. 82-84
- Franziska Seidl, Loschmidt, Johann Joseph Dans Austriacki leksykon biograficzny 1815–1950 (Lexique Biographique Autrichien 1815-1950) Vol.5 , Lipsk, Austriacka Akademia Nauk, ( Czytaj online ) W P. 326-327 .
- (z) Claus Priesner, ‘ Loschmidt, Johann Joseph » , W Nowa niemiecka biografia (NDB) W tom. 15, Berlin, Duncker & Humblot, W P. 195–196 ( Oryginalne zdigitalizowane ).
- Peter M. Schuster, Od ciekawości po pasję: trasa Loschmidta od filozofii do nauki przyrodniczej w [[[ 18 ] .
- (W) S. Ramsesha, ‘ Eksperymentalne określenie stałej Avogadro » W Rezonans W W P. 79-87 ( Czytaj online ) .
- Seidl, Lachmided Jeszant Jofef , W Austriacki leksykon biograficzny 1815-1950 (Öbl), tom 5, opublikowany przez Austriacki Akademię Nauk, Vienne 1972, strona 326 i nast. (Bezpośrednie linki na stronie 326, s. 327).
- Peter M. Schuster, Od ciekawości do pasji: trasa Loschmidta od filozofii do nauki przyrodniczej , Dans W. Fleischhacker i T. Schönfeld (redaktorzy), Pionierskie pomysły na nauki fizyczne i chemiczne W Materiały z sympozjum Josefa Loschmidta, które odbyło się w Wiedniu, Austria, 25–27 czerwca 1995 r. , Plenum Press, 1997, Nowy Jork, (ISBN 0-306-45684-2 ) .
- (W) Alfred Bader i Leonard Parker, ‘ Joseph Loschmidt, Physiscist and Chemist » W Fizyka dzisiaj 54 (3) W W P. 45 ( Czytaj online ) .
- (W) Alfred Bader, ‘ Josef Loschmidt, ojciec modelowania molekularnego » W Royal Institution Proceedings, t. 64, , 1995?, P. 197-205 ( Czytaj online ) .
- (z) Ludwig Boltzmann, Popularne pisma , Lipsk, 1905, J. A. Barth, przedruk przez Friedra. Vieweg & Sohn, Wiesbaden. ,, W Ku pamięci Josefa Loschmidta (K. .
- (W) George B. Kauffman, ‘ Konstytucyjne formuły chemii organicznej J. Loschmidta w reprezentacji graficznej » W J. Chem. Edukacja. 66 (11) W , A281 ( Czytaj online ) .
- (W) ‘ Josef Loschmidt. Formuły strukturalne. 1861 » , NA www.ch.ic.ac.uk W (skonsultuję się z ) .
- (z) August Kekulé, Lerbuch of Organic Chemistry (Traité de Chimie Organique) , Erlangue, ferdinand wdowa, .
- Jean-Claude Coud d’ts, Historia chemii , Louvain-La-Neuve, de Boeck Supérieur, , 354 P. (ISBN 978-2-8073-0692-9 W Czytaj online ) W P. 172 .
- August Kekulé, « O konstytucji substancji aromatycznych », Byk. Soc. Chim. Paris, vol.3 W W P. 98-110 ( Czytaj online ) .
- (z) August Kekulule, ‘ Badania nad połączeniami aromatycznymi » W Ann. Chem. Pharm. Vol.137 W W P. 129-136 ( Czytaj online ) .
- (z) August Kekulule, ‘ O niektórych produktach kondensacyjnych aldhyd » W Liebigs Ann. Chem. 162 (1) W W P. 77–124 ( Czytaj online ) .
- (W) Heinz D. Roth, ‘ 150 lat po ich pojawieniu się: nowe spojrzenie na reprezentacje Benzenu Loschmidta » W Biuletyn dla historii chemii W tom. 38, N O 1, W P. 29-36 ( Czytaj online [PDF] ) .
- Jean Gillis, « Auguste Kekule i jego praca, wyprodukowane w Gandawie w latach 1858–1867 », Wspomnienia Royal Academy of Belgium W tom. 37, N O 1, W P. 1–40 .
- (z) Richard Aschütz, ‘ Josef Loschmidt, Chemical Studies I, A. Formuły konstytucji chemii organicznej w reprezentacji graficznej; B. Prawo Maryi » W Ber. Deut. Chem. Ges., Vol. 45 W W P. 539-600? .
- Eduardo Arroyo Pérez, Boltzmann i entropia , Paryż, RBA France, , 159 P. (ISBN 978-2-8237-0235-4 ) W P. 45 .
- Jean Perrin ” Ruch Browna i rzeczywistość molekularna », Annals of Chemistry and Physics Ser.8, 18 W W P. 5-114 .
- (W) ‘ Nagroda Josef Loasmidt » , NA www.rsc.org W (skonsultuję się z ) .
- (W) ‘ Autrian Chemical Society » , NA www.goech.at W (skonsultuję się z ) .
- (W) Fleischhacker i T. Schönfeld (redaktorzy), Pionierskie pomysły na nauki fizyczne i chemiczne, postępowanie w sympozjum Josefa Loschmidta, które odbyło się w Wiedniu, Austria, 25–27 czerwca 1995 r. , New York, Plenum Press, , 320 P. (ISBN 0-306-45684-2 W Czytaj online ) .
Linki zewnętrzne [[[ modyfikator |. Modyfikator i kod ]
- Zasób badawczy :
-
Uwagi w słownikach ogólnych lub encyklopediach :
Recent Comments