Mobol -enzymes mononuklearny – Wikipedia
Z Wikipedii, Liberade Libera.
I Molybd-Eenzymes Są to duża klasa enzymów o atomie molibdenu zawartym w głównym kofaktorze. Ta klasa enzymów wykonuje funkcję katalityczną, która ogólnie można opisać jako przeniesienie atomu tlenu do lub przez fizjologiczny akceptor cząsteczki lub dawcy.
Wszystkie te enzymy posiadają atom molibdenu koordynowany przez organiczny piranopterinowy kofaktor organiczny za pomocą dwóch podstawników do tolentnych.
Kofaktor jest często wywoływany w literaturze Molibdopterina , ponieważ pierwotnie uznano go za wykluczenie enzymów molibd. Następnie stwierdzono, że ta sama forma jest również obecna w enzymach tunikowych. Wolfram jest niezbędnym elementem tylko dla niektórych bakterii, głównie termofilowych [Pierwszy] . Enzymy tunikowe, takie jak format dehydrogenazy Desulfovibrio gigas , należą do rodziny reduktazy DMSO i są wysoce zatwierdzone do korespondentnych enzymów molibdo.
Obecnie istnieje ponad 50 enzymów molibd zaangażowanych w reakcje katalityczne na cykle węgla, siarki i azotu podzielone na dwie podstawowe postacie.
Z wyjątkiem MOFE CENTURA MULICEAROWE 7 obecne w azoterie [2] [3] , Molybdenu znajduje się we wszystkich molibd-enzymach znanych w postaci jednojądrzastych.
Molybdenum jest elementem niezbędnych śladów dla zwierząt, roślin i mikroorganizmów i jest jedynym metalem przejściowym drugiej linii o znaczeniu biologicznym. Jest powszechnie dostępny w naturze systemów biologicznych dla wysokiej wód rozpuszczalności tlenków o wysokiej wartości. Molybdenum jest najliczniejszym metalem przejściowym w wodzie morskiej (110 nm).
Do klasyfikacji tych białek w rodzinach stosuje się CO -CO -CO Russ Hille w 1996 roku [4] . Molybdenum Cofat wywodzi się z cery między molibdopteriną a jonem molibdenu. Molybdopterina jest prawdopodobnie zaangażowana w pośredniczenie w transferie elektronicznym z centrum molibdenu do innych centrów i odpowiedzialna za modulację potencjału utleniania połączonego metalu. Na podstawie jego struktury istnieją trzy rodziny enzymów o ich nazwie od ich najbardziej reprezentatywnych członków, Xantina Ossidation W Sulfito oksydaza To jest DMSO Reduttasi .
Z wielkich rodzin molibdenu tylko tych zwykłej oksydazy i oksydazy ksantynowej znajdują się we wszystkich żywych królestwach [5] .
Rodzina oksydazy Xantina [[[ zmiana |. Modifica Wikitesto ]
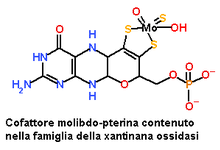
W tej rodzinie, która bierze swoją nazwę od najbardziej reprezentatywnego członka, oksydazy ksantynowej, centrum katalityczne składa się z pojedynczej zwykłej uprawy koordynowanej przez most Ditiolenic do Molybdenum.
Członkowie katalizują oksydacyjną hydroksylację różnorodnego zakresu aldehydów i aromatycznych heterocykli w reakcjach obejmujących pęknięcie wiązania C-H.
Główni członkowie:
Rodzina oksydazy siarczkowej [[[ zmiana |. Modifica Wikitesto ]

Ta druga rodzina enzymów molibus jest nazywana przez oksydazę progenitorową.
Zazwyczaj katalizuje prawidłowe przeniesienie atomu tlenu do lub przez podłoże z dostępnym elektronicznym aparatem ortodontycznym. Enzymy te pełnią funkcje fizjologiczne, takie jak detoksykacja i/lub asymilacja siarczanów i azotanów.
Centrum katalityczne ma również pojedynczy pteridinowy kofaktor koordynowany przez most ditiolenowy do metalu, który uzupełnia koornacje z cysteiną.
Główni członkowie:
.
DMSO Reduttasi Family [[[ zmiana |. Modifica Wikitesto ]

Ta ostatnia rodzina, podobna do poprzedniej funkcji katalitycznej, składa się z enzymów bakteryjnych, takich jak reduktaza DMSO, od której bierze swoją nazwę. Te enzymy znajdują się w peryplazmie lub związane z błoną komórkową, które działają jako końcowa oksydaz oddechowy.
Członkowie tej rodziny przedstawiają podwójny pteridinowy kofaktor koordynowany z molibdenem, a także o większej różnorodności strukturalnej niż inne rodziny. Z jednej strony centrum metalowe może być również koordynowane przez tlen, siarkę lub selen, a z drugiej seryny, cysteiny lub selenocyistyny.
Główni członkowie:
- ^ Michael K. Johnson, Douglas C. Rees, Michael W. W. Adams, Tungsstonesymates , W Recenzje chemiczne , tom. 96, n. 7, 7 listopada 1996, s. 2817-2840, ISSN 1520-6890 .
- ^ Barbara K. Burgess, David J. Lowe, Mechanizm azotu molibdenu , W Recenzje chemiczne , tom. 96, n. 7, s. 2983-3012, ISSN 1520-6890 .
- ^ James B. Howard, Douglas C. Rees, Strukturalne podstawy biologicznej fiksacji azotu , W Recenzje chemiczne , tom. 96, n. 7, 7 listopada 1996, s. 2965-2982, ISSN 1520-6890 .
- ^ R. Hille, Jednojądrowe enzymy molibdenu , W Recenzje chemiczne , t. 96, 1996, s. 2757-2816, dwa: 10.1021/CR950061T .
- ^ Yan Zhang, Vadim n Gladyshev, Molibdoproteomy i ewolucja wykorzystania molibdenu , W Journal of Molecular Biology , tom. 379, n. 4, 13 czerwca 2008 r., S. 881-899, doi: 10.1016/j.jmb.2008.03.051 , ISSN 1089-8638 . URL skonsultowano się z 7 marca 2012 r. .
Recent Comments