Neural Crest – Wikipedia
. Neuralny herb Lub płyta dachowa Wyznacza, w zarodku Notches, populacji komórek przejściowych i wielofunkcyjnych wygenerowanych z najbardziej grzbietowego obszaru rurki nerwowej. Komórki te migrują przez zarodek podczas rozwoju i powodują szeroką gamę typów komórek u dorosłych. Grzebień nerwowy jest pochodzący z melanocytów (z wyjątkiem komórek pigmentowych oka), z dużą częścią kości i chrząstek szkieletu twarzowego i szyi, kilku komórek hormonalnych i rodzi wszystkie glejowe Komórki i większość neuronów obwodowego układu nerwowego [[[ Pierwszy ] .
Pojawienie się grzebienia neuronowego w kręgowcach prawdopodobnie odegrało kluczową rolę w ich ewolucji [[[ 2 ] , pozwalając im w szczególności zostać drapieżnikiem (żuchwa wywodzi się z grzebienia nerwowego) i zwiększenie wielkości ich mózgu. Mogło się to rozwinąć, łatwiej niż u innych gatunków, wewnątrz ochrony utworzonej przez kości czaszki pochodzącej z grzebienia nerwowego.
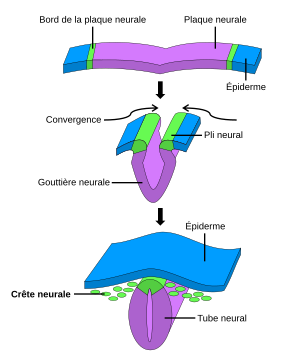
Grzbiet nerwowy zaczyna tworzyć się po gastrulacji, na granicy między płytą nerwową a sąsiednim ektodermą. Podczas neurulowania krawędzie płyty lub perełki nerwowe zbiegają się na środku linii grzbietowej, aby zamknąć rurkę nerwową. Komórki grzebienia nerwowego, następnie znajdujące się na dachu rurki, ulegają przejściu stanu, przechodząc z komórek nabłonkowych do mezenchymalnego i rozcieńczającego neuroepitelium (przejście nabłonka-mezenchymalne). DIAPLE to proces, który polega na oderwaniu i migracji populacji komórek obecnych w ramach wcześniej jednorodnego nabłonka. Komórki te migrują następnie na peryferie i różnią się różnymi typami komórek w zależności od ich lokalizacji w zarodku i sygnałach, które otrzymują [[[ Pierwszy ] .
W ramach tego rozwoju ukrywa sieć genów regulacyjnych, w tym sygnały molekularne, czynniki transkrypcyjne i geny skuteczne. Ta sieć genów reguluje wszystkie cechy tych komórek, takie jak ich potencjał różnicowania i zdolność migracji [[[ 3 ] . Zrozumienie mechanizmów molekularnych tworzenia się grzebienia nerwowego jest ważne, aby lepiej zrozumieć patologie związane z ich dysfunkcją u ludzi [[[ Pierwszy ] . Geny zaangażowane w dołek i migrację grzbietów nerwowych są często wyrażane w guzach i dają inwazyjny potencjał komórek nowotworów. W związku z tym analiza roli tych genów w zarodku umożliwia lepsze zrozumienie, w jaki sposób wpływa on na zachowanie komórek nowotworowych podczas raka.
Komórki grzbietu nerwowego są początkowo multipotencyjne komórki macierzyste, ale ich potencjał różnicowania jest ograniczony w miarę rozwoju. Stanowią one model wyboru do badania migracji i różnicowania komórkowego. Podczas ich migracji i różnicowania powodują, że pośrednie i przejściowe typy komórkowe, takie jak prekursory komórek Schwanna lub komórki kapsułek granicznych. Niektóre z tych komórek mogą zachować swoje cechy i ustalić się jako komórki macierzyste u dorosłych.
Grzbiet neuralny został opisany po raz pierwszy w zarodku z kurczaka przez Wilhelma, w 1868 r., Jako „Cordes Entre-Deux” ( Stosunek płciowy ; [[[ Pierwszy ] . Nazwał tę strukturę „grzbietem węzłów chłonnych”, ponieważ rodzi ją rdzeniowe węzły chłonne po bocznych stronach rurki nerwowej [[[ 4 ] . W pierwszej połowie Xx To jest Century, większość badań na grzbiecie neuronowym przeprowadzono na zarodkach płazów i zostały podsumowane w uznanej monografii Hörstadius (1950) [[[ 5 ] .
Techniki oznaczania komórek przyniosły wiele do zbadania grzbietu nerwowego, ponieważ pozwalają na migrację tkanek przez zarodek rozwojowy. W latach 70. Weston i Chibon zastosowali oznaczenie z radioaktywnymi izotopami z jądra z trójtopową tymidyną u kurczaka i płazów. Jednak ilość radioaktywności obecnej w komórkach, a następnie o połowę przez każdy podział komórek, co czyni tę technikę bezużyteczną przez długi czas. Bardziej nowoczesne techniki oznaczania komórek, takie jak dekstran rodaminy-lizyny lub ważny barwnik DII, pozwalają na skuteczne i przejściowe oznaczenie linii komórkowych z grzebienia nerwowego. [[[ 4 ] .
System przeszczepu Caille-Poulet ( Przepiórka w języku angielskim), opracowany przez Nicole Le Douarin w 1969 roku, również przyniósł wiele do badania migracji nerwowych komórek grzebienia [[[ 6 ] W [[[ 7 ] . Ta metoda umożliwia możliwe monitorowanie komórek, umożliwiła wyjaśnienie pochodnych grzebienia nerwowego. System ten polega na wszczepieniu japońskich komórek przepiórczych w kurczaka i po ich przyszłości w zarodku. Komórki przepiórcze można łatwo zidentyfikować ze względu na szczególny kształt ich jąder, po zabarwieniu feulgen-rossenbecka lub dzięki zastosowaniu przeciwciał QCPN, które rozpoznają antygeny w komórkach przepiórczych, ale nie w kurczakach. Przeszczep Caille-Poulet tworzy zarodek chimeryczny (2 gatunki obecne u tej samej osoby) i zakłada, że komórki przepiórcze spełniają te same sygnały, co komórki kurczaka. Ta technika umożliwiła szerokiej generacji naukowców szczegółowe badanie ontogenezy grzebienia nerwowego.
Migracja i charakterystyka komórek wielowarstwowych grzebienia nerwowego podlegają kaskadzie zdarzeń molekularnych. Zdarzenia te można podzielić na cztery rodzaje sygnalizacji i powiązanych sieci genetycznych.
Sygnały indukcyjne [[[ modyfikator |. Modyfikator i kod ]
Płytka nerwowa nabywa swoją tożsamość poprzez wykrywanie zewnątrzkomórkowych cząsteczek sygnalizacyjnych (w szczególności cząsteczki rodzin Wnt, BMP i FGF), które rozproszyły się z sąsiednich naskórków i różnicują nieneuralną ekodermę płyty nerwowej, fenomen zwany indukcją neuronową [[[ Pierwszy ] W [[[ 2 ] .
Zaangażowanie sygnalizacji Wnt w indukcję grzebienia nerwowego wykazano u wielu gatunków przez doświadczenia zysku lub utraty funkcji. Zgodnie z tymi wynikami, region promotora genu ślimaka (gen specyficzny dla grzebienia nerwowego) zawiera miejsce łącznikowe z czynnikami transkrypcyjnymi zwykle zaangażowanymi w sygnalizację zależną od Wnt [[[ 8 ] .
BMP ( Białka morfogenetyczne kości ) biorą udział w indukcji płyty nerwowej, a następnie w tworzeniu grzbietu nerwowego. Antagoniści BMP generują gradient aktywności BMP w płycie nerwowej. Zatem komórki, które mają wysoki wskaźnik BMP, wybierają trasę różnicowania naskórka, podczas gdy komórki BMP o niskim wębie stają się plakietką nerwową. Komórki otrzymujące pośrednie szybkość nabywają tożsamość komórkową w grzebieniu nerwowym [[[ Pierwszy ] .
FGF (dla Współczynnik wzrostu fibroblastów ) wydaje się być źródłem konkretnych induktorów grzbietu nerwowego [[[ 9 ] .
Dokładne role BMP, FGF i WNT w rozwoju grzbietu nerwowego są nadal słabo poznane i wykonują intensywne badania.
Sygnały specyfikacji krawędzi płyty nerwowej [[[ modyfikator |. Modyfikator i kod ]
Zdarzenia sygnalizacyjne, które wyznaczają krawędzie płyty nerwowej, indukują ekspresję zestawu czynników transkrypcyjnych, co wyraźnie ustali tożsamość komórek obecnych na tej granicy. Cząsteczki te obejmują między innymi czynniki ZIC, PAX3/7, DLX5, MSX1/2 i są przekaźnikami wpływu sygnalizacji Wnt, BMP i FGF. Geny te są wyrażane masowo w regionie na krawędzi płyty nerwowej i poprzedzają ekspresję markerów grzebienia nerwowego [[[ 2 ] .
Rzeczywiście, dowody eksperymentalne umieszczają te czynniki transkrypcyjne powyżej określonych genów grzebienia nerwowego. Na przykład w Xenopus MSX1 jest konieczne i wystarczające do wyrażenia ślimaka, ślimaka i foxd3 [[[ dziesięć ] . Co więcej, Pax3 jest dla niego niezbędny dla wyrażenia Foxd3, w zarodku myszy [[[ 11 ] .
Sygnały specyfikacji herbów neuronowych [[[ modyfikator |. Modyfikator i kod ]
Po ekspresji genów specyfikacji na krawędziach płyty nerwowej pojawia się zbiór genów specyfikacji grzebienia nerwowego, w tym genów ślimakowych/ślimakowych, FOXD3, Sox10, Sox9, AP-2 i C-Myc. Geny te są aktywowane, gdy zacznie pojawiać się grzbiet nerwowy. W ksenopie i prawdopodobnie u innych gatunków ekspresja każdego z tych genów jest konieczna i wystarczająca do indukcji ekspresji wszystkich innych, co pokazuje istnienie stałych mechanizmów krzyżowanej regulacji [[[ 2 ] .
Oprócz tej sieci określonych genów grzbietu nerwowego istnieją dwa inne czynniki transkrypcyjne związane z grzebieniem neuronowym, Skręcać I ID . Twist, czynnik transkrypcyjny rodziny BHLH jest wymagany do różnicowania mezenchymu łuków gardła [[[ dwunasty ] . ID jest jednym z bezpośrednich celów C-MYC i bierze udział w utrzymaniu komórek macierzystych grzbietu nerwowego (lub NCSC dla „Neural Crest Temon”)))))))) [[[ 13 ] , Komórki, które wydają się odgrywać rolę w niektórych nowotworach i które odgrywają kluczową rolę w wyglądzie oporności pochodzenia epigenetycznego w komórkach rakowych, stając się w ten sposób opornymi eentinami leków (epigenetyka; Ex: inhibitory metylacji DNA DNA) skierowane do komórek rakowych [[[ 14 ] .
Skuteczne geny [[[ modyfikator |. Modyfikator i kod ]
Wreszcie, sygnały specyfikacji prowadzą do ekspresji skutecznych genów, które nadają komórkom nerwowego grzebienia migracji i właściwości wielofunkcyjnych. Cząsteczki GTPazy Rho i kadheryn są szczególnie zaangażowane w regulację morfologii komórek i właściwości adhezji. Z drugiej strony, Sox9 i Sox10 regulują różnicowanie komórek grzbietu nerwowego poprzez aktywację wielu specyficznych efektorów różnych generowanych populacji komórkowych, takich jak MITF, P0, TRP i CKIT [[[ 2 ] .
Neuralne komórki grzebienia różnicują się w różne typy tkanek i komórek w funkcji ich pozycji wzdłuż osi przednio-tylnej zarodka. Grzebień neuronowy jest zatem regionalizowany. Możemy rozróżnić cztery obszary różnicowania: czaszkę, tułów święty region i tkankę serca.
Neural czaszki [[[ modyfikator |. Modyfikator i kod ]
Na poziomie czaszki komórki grzbietu nerwowego migrują grzbietowo -boczne, tworząc mezenchym czaszkowy, a następnie różnicują się w węzłach chłonnych, chrząstce lub kości [[[ 15 ] . W części rostralnej tworzą chrząstki przednich i błoniaste kości czaszki. Bardziej tylne, komórki te wchodzą do kieszeni gardła i łuków ramiennych, gdzie przyczyniają się do tworzenia chrząstek szczęki, gny [[[ 16 ] W [[[ 17 ] .
Neural Trunk Crest [[[ modyfikator |. Modyfikator i kod ]
Nerwowe komórki grzebienia rodzą trzy populacje komórek. Grupa komórek, zamierzała stać się melanocytami skóry, dorsowo migrując przez ektodermę i jest rozmieszczona przez zarodek do obszaru brzusznego. Druga grupa komórek Ventro-Latérally Migre, przez przednią część każdego twarcinka. Niektóre tworzą węzły kręgosłupa w twardówek i innych, które migrują bardziej brzusznie, tworzą współczulne węzły, nadnercza i nerwy otaczające aorta, a także komórki Schwanna wszystkich nerwów [[[ 17 ] . Wreszcie, trzecia populacja komórek migre wentylacyjnych i jest umieszczona na granicach między rurką nerwową a peryferią, gdzie tworzą struktury zwane kapsułkami granicznymi [[[ 18 ] .

Grzebiej pochwy i święty nerwowy [[[ modyfikator |. Modyfikator i kod ]
Grzebie nerwowe na poziomie błędnym i świętym rodzi węzły jelitowego układu nerwowego, zwane także tysowodem węzłów [[[ 17 ] .
Kierunek neuronowy sercowy [[[ modyfikator |. Modyfikator i kod ]
Grzbiet nerwowy serca rozwija się również w melanocytach, chrząstce, tkance łącznej i neuronie niektórych rozgałęzionych łuków. Z drugiej strony, w bardziej specyficzny sposób, ten obszar grzbietu rodzi niektóre części serca, w tym tkaninę mięśniowo-koncertową tętnic i części przegrody, która oddziela krążenie płucne aorty [[[ 17 ] .
Wiele struktur, które odróżniają kręgi od innych akordów, pochodzi od grzebienia neuronowego. Pojawienie się grzebienia neuronowego jest zatem jednym z osiągnięć u podstawy rozwoju kręgowców na Ziemi. Umożliwiłoby to rozwój wielkości mózgu dzięki skrzynce czaszki, a nawet zwiększenie wielkości kończyn poprzez rozwój obwodowego układu nerwowego. Ta ewolucja jest również kluczowa w pojawieniu się zachowania drapieżnika u kręgowców [[[ 19 ] .
Pochodne mesekodermalne [[[ modyfikator |. Modyfikator i kod ]
Szczyt głowowy [[[ modyfikator |. Modyfikator i kod ]
- Prawie cały szkielet głowy: chrząstka chondrokranowa (kapsułka nosa, chrząstka Meckel, kość szklisty, kość kwadratowa, chrząstka stawowa, heoid i columelle), tchawice i krtani, dermatokran (kości błonowe), grzywny grzbiet
- Odontoblasty;
- Dentystyczne kubki smakowe;
- Pericyty i gładkie mięśnie tętnic i żył ramiennych;
- ścięgna oka i mięśni żucia;
- tkanka łączna gruczołu głowy i szyi (przysadki, ślina, łzć, grasica, tarczycy);
- Skór i tkanka tłuszczowa Calvaria, brzuszna część szyi i twarzy.
Grzbiet [[[ modyfikator |. Modyfikator i kod ]
- Mésenchyme płetwy grzbietowej u niższych kręgowców.
Pochodne komórki hormonalnej [[[ modyfikator |. Modyfikator i kod ]
- Komórki chromafiny Médullo-Surrenale;
- komórki parafollikowe;
- Komórki tajemnicy kalcytoniny tarczycy;
- Komórki ciała szyjnego, typ I / Ii .
Pochodne tworzące obwodowe układ nerwowy [[[ modyfikator |. Modyfikator i kod ]
- Neurony czuciowe i Glie kręgosłupa i cefaliczne węzły chłonne ( VII I częściowo Iii W W W IX , I X ), współczujący i przywspółczulny;
- Kapsułki graniczne;
- Cellules de Rohon-Beard;
- Komórki Merkel;
- Komórki satelitarne (glejki) wszystkich autonomicznych i wrażliwych węzłów;
- Komórki Schwanna wszystkich nerwów obwodowych.
Inni [[[ modyfikator |. Modyfikator i kod ]
- melanocyty
- Komórki pigmentacyjne tęczówki,
- mózg,
- PARTICJA SERCA
- Podział Oarte z płucnym bagażnikiem
- Mięsień gładki wszystkich tętnic i żył
- Huang, X. i Saint-Jeannet, J.P. (2004). Indukcja grzebienia neuronowego i możliwości życia na krawędzi . Dev. Biol. 275, 1-11. Doi 10.1016/j.ydbio.2004.07.033
- Meulemans, D. i Bronner-Fraser, M. (2004). Interakcje genowo-regulacyjne w ewolucji i rozwoju grzebienia nerwowego . DEV CELL. 7, 291-9. Doi 10.1016/J.Devcel.2004.08.007
- Sauka-Spengler, T., Meulemans, D., Jones, M., i Bronner-Fraser, M. (2007). Starożytne pochodzenie ewolucyjne sieci regulacyjnej genów Neural Crest . DEV CELL. 13, 405-20. Doi 10.1016/J.Devcel.2007.08.005
- Le Douarin, N.M. (2004). Abryusz ptaków jako model do badania rozwoju herba neuronowego: długa i wciąż trwająca historia . Mech Dev. 121, 1089-102. Doi 10.1016/j.mod.2004.06.003
- Hörstadius, S. (1950). The Neural Crest: jego właściwości i pochodne w świetle badań eksperymentalnych . Oxford University Press, Londyn, 111 str.
- Le Douarin, N.M. (1969). „Szczególność jądra międzyfazowego w japońskiej przepiórce ( COTURNIX COTURNIX JAPONICA ). Zastosowanie tych szczegółowości jako „oznaczenia biologicznego” w badaniach dotyczących interakcji tkankowych i migracji komórek podczas ontogenezy ”. Bull Biol FR Belg 103: 435-52.
- Le Douarin, N.M. (1973). « Technika znakowania komórek biologicznych i jej zastosowanie w embriologii eksperymentalnej ». Dev Biol. 30 217-22. Doi 10.1016/0012-1606 (73) 90061-4
- Vallin, J. i in. (2001). «Klonowanie i charakterystyka trzech promotorów ślimaków Xenopus ujawniają bezpośrednie regulacje przez sygnalizację LEF/beta-kateniny». J Biol Chem. 276, 30350-8. Doi 10.1074/jbc.M103167200
- Burmistrz, R., Guerrero, N., Martinez, C. (1997). ‘ Rola FGF i Noggin w indukcji grzebienia nerwowego » . Dev Biol. 189 1-12. Doi 10.1006/dbio.1997.8634
- TRUGULO, C. i in. (2003). «Regulacja genów MSX przez gradient BMP jest niezbędny do specyfikacji grzebienia nerwowego». Rozwój . 130, 6441-52. Doi 10.1242/dev.00878
- (W) Mirella Dottori1, Michael K. Gross, Patricia Labosky et Martyn Goulding, ‘ Czynnik transkrypcji skrzydlnej foxd3 tłumi różnicowanie interneuronu i promuje los nerwowy » W Rozwój W N O 128, W P. 4127–4138 (ISSN 0950-1991 I 1477-9129 W Czytaj online , skonsultuałem się z )
- Vincentz, J.W. i in. (2008). «Brak TWIC1 powoduje nieprawidłową morfogenezę herbów sercowych». Dev Biol. 320, 131-9. Doi 10.1016/j.ydbio.2008.04.037
- Light, W. i in. (2005). «Xenopus ID3 jest wymagany poniżej MYC do tworzenia wielopotatywnych komórek progenitorowych grzebienia nerwowego». Rozwój . 132, 1831–41. dwa: 10.1242/dev.01734
- Philippe Lambert « Kierowane oporniki terapii: waga NCSC », Gazeta lekarza W ( Czytaj online , skonsultuałem się z )
- (W) Lisa A. Taneyhill, ‘ Przylegać lub nie przylegać: rola kadheryn w rozwoju grzebienia nerwowego » W Adhezja i migracja komórek W tom. 2, N O 4, W P. 223-30 (ISSN 1933-6918 I 1933-6926 W Czytaj online , skonsultuałem się z )
- Minoux M., Rijli F.M. (2010). «Molekularne mechanizmy migracji i wzornictwa komórek nerwowych czaszki i wzornictwa w rozwoju czaszki». Rozwój
- https://www.ncbi.nlm.nih.gov/bookkshelf/br.fcgi?book=dbio&part=A3109#a313333333
- P Topilko, „Komórki kapsułek granicznych – nisza nerwowych komórek macierzystych w obwodowym układzie nerwowym”, w Bull. Acad. Natle Med., Vol. 191, nr 7, 2007, P. 1383-1394 (ISSN 0001-4079 )
- Gans, C. i Northcutt, R. G. (1983). «Neuralny grzebienie i pochodzenie kręgowców: nowa głowa». Nauka 220, 268–274. Doi 10.1126/science.220.4594.268
Recent Comments