Picoline – Wikipedia
. Picoline Lub metylopirydyna jest heterocyklicznym związkiem aromatycznym surowego wzoru C 6 H 7 N. Składa się z jądra pirydycznego zastąpionego grupą metylową i istnieje w postaci trzech izomerów zgodnie z względną pozycją grupy metylowej w cyklu w porównaniu z atomem azotu.
| Picoline | |||
| Nazwa | 2-metylopirydyna | 3-metylopirydyna | 4-metylopirydyna |
| Inne nazwy | 2-picolina α-picolina O -Spicoline Ortho Picoline |
3-picolina β-picolina M -Spicoline Meta Picoline |
4-picolina γ-picolina P -Spicoline Do Picoline |
| Formuła strukturalna |  |
 |
|
| Sprawa | |||
| (mieszanka) | |||
| Pubchem | 7975 | 7970 | 7962 |
| Brutalna formuła | C 6 H 7 N |
||
| Masa cząsteczkowa | 93.13 G mol −1 | ||
| État (CNTP) | płyn | ||
| Wygląd | bezbarwny płyn Nieprzyjemny i akrowy zapach [[[ Pierwszy ] |
bezbarwny płyn żółtawy [[[ 2 ] |
Żółta płyn zapach pirydyny [[[ 3 ] |
| Punkt fuzji | −70 ° C. [[[ Pierwszy ] | −18 ° C. [[[ 2 ] | 3 ° C. [[[ 3 ] |
| Punkt wrzenia | 128 ° C. [[[ Pierwszy ] | 144 ° C. [[[ 2 ] | 145 ° C. [[[ 3 ] |
| Masa objętościowa ( 20 ° C. ) | 0,94 G · cm -3 [[[ Pierwszy ] | 0,96 G · cm -3 [[[ 2 ] | 0,96 G · cm -3 [[[ 3 ] |
| Ciśnienie pary nasycenie ( 20 ° C. ) |
dwunasty HPA [[[ Pierwszy ] | 5.9 HPA [[[ 2 ] | 5.8 HPA [[[ 3 ] |
| Punkt flash | 27 ° C. (zamknięty kubek) [[[ Pierwszy ] | 36 ° C. (zamknięty kubek) [[[ 2 ] | 39 ° C. (zamknięty kubek) [[[ 3 ] |
| Point d’Auto-inframation | 535 ° C. [[[ Pierwszy ] | > 500 ° C. [[[ 3 ] | |
| Limity wybuchowości | 1,4-8,6% 54-330 g/m3 [[[ Pierwszy ] |
1,3-8,7% 55-335 g/m³ [[[ 2 ] |
1,3-8,7% 50-335 g/m³ [[[ 3 ] |
| Rozpuszczalność wody | rozpuszczalny [[[ Pierwszy ] W [[[ 2 ] W [[[ 3 ] | ||
| Pk A [[[ 4 ] (Sprzężony kwas BH + ) |
5.94 | 5.63 | 6.03 |
| Logp | 1.11 [[[ Pierwszy ] | 1.2 [[[ 2 ] | 1.22 [[[ 3 ] |
| Sgh |
  Niebezpieczeństwo [[[ Pierwszy ] W [[[ 2 ] W [[[ 3 ] |
||
| Zwroty h i p [[[ Pierwszy ] W [[[ 2 ] W [[[ 3 ] | H226 W H302 I H311
H226 : Łatwopalne płyn i opary H319 W H332 I H335 H319 : Powoduje poważne podrażnienie oka |
H226 W H302 I H311
H226 : Łatwopalne płyn i opary H314 I H332 H314 : Powodują poważne oparzenia skóry i uszkodzenia oczu |
H226 W H311 I H302+H332
H226 : Łatwopalne płyn i opary H315 W H319 I H335 H315 : Powoduje podrażnienie skóry |
| P261 I P280.3
P261 : Unikaj oddychania pyłu/dymu/gazu/mgły/oparów/aerozoli. P312 I P305+P351+P338 P312 : Zadzwoń do centrum antypoison lub lekarza w przypadku dyskomfortu. |
– | P210 W P280 I P302+P352
P210 : Zachowaj ciepło/iskry/nagie płomienie/gorące powierzchnie. – ZAKAZ PALENIA. P305+P351+P338 I P308+P310 P305+P351+P338 : W przypadku kontaktu z oczami: spłucz z ostrożnością w wodzie przez kilka minut. Usuń soczewki kontaktowe, jeśli ofiara ją nosi i można je łatwo usunąć. Kontynuuj płukanie. |
|
Pikoliny to bezbarwne płyny, które mają zapach podobny do pirydyny. Są niewspółmiernie z wodą, etanolem i eterem dietylicznym [[[ 5 ] . Trzy izomery mają odpowiednio bardzo odległe temperatury topnienia -70, -18 i 3 ° C. , ale stosunkowo bliskie punkty wrzenia.
Podobnie jak w 2- i 4-picolinie, grupy metylowe są bezpośrednio w połączeniu z elektroatrakcyjnym atomem azotowym, grupy metylowe tych dwóch izomerów można stosunkowo łatwo zmęczyć przez silne zasady, takie jak damy litowe lub butyllito, a następnie podstawione [[[ 6 ] .
W dzisiejszych czasach 2-picolina jest wytwarzana głównie przez dwa syntetyczne szlaki: kondensacja acetaldehydu lub formaldehydu i amoniaka [[[ 7 ] , lub przez cyklizację nitryny i acetylenu (cyklizacja Bönnemann) [[[ 8 ] . Poniżej przykładu reakcji między aldehydem acetaldehydem a amoniakiem:

W 1989 roku wyprodukowano około 8 000 tonów [[[ 7 ] .
3-metylopirydyna można przygotować poprzez reakcję akroleiny z amoniakiem [[[ 7 ] :
Ale bardziej skuteczna metoda wykorzystuje akroléin, propanał i amoniak:
W 1989 roku wyprodukowano około 9 000 tonów [[[ 9 ] .
Trzy izomery mają właściwości dość podobne do właściwości pirydyny w swoich właściwościach i mogą łatwo zastąpić ją w zastosowaniach, w których dokładna struktura molekularna nie jest ważna, na przykład jako rozpuszczalniki. Służą, jeśli nie jako podsumowanie dla farmaceutycznych i agrochemicznych oraz produkcji barwników [[[ 5 ] .
Możemy przytoczyć na przykład 2-winylopirydynę i nitrapyrynę, produkt agrochemiczny, który można wytwarzać z 2-picoliny [[[ 7 ] . 3-picolina może być stosowana jako surowiec do syntezy chloropiryfosu i niacyny [[[ 7 ] , a 4-picolina służy do wytworzenia środka przeciw truźnikowi izoniazydu [[[ 7 ] .
Utlenianie pikolin, na przykład za pomocą permangananu potasu (kmno 4 ) [[[ 7 ] W [[[ dziesięć ] , wytwarza odpowiednio równoważniki kwasu karboksylowego, odpowiednio kwas pikolinowy, kwas nikotyny i kwas izoniotynowy.

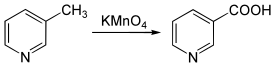
Picoliny są bardziej lotne i pogarszają się wolniej niż ich odpowiedniki kwasu karboksylowego. Ulatnianie się jest znacznie mniej ważne w glebie niż w wodzie, ze względu na sorpcję związków na glinach gleby i materii organicznej [[[ 11 ] . Wydaje się, że degradacja pikolin pośredniczy głównie bakterie, większość izolatów należących do aktynobakterii. 3-metylopirydyna pogarsza się wolniej niż dwa pozostałe izomery, prawdopodobnie z powodu wpływu rezonansu w jądrze heterocykliczne. Podobnie jak najprostsze pochodne pirydyny, pikoliny zawierają więcej azotu niż konieczne do wzrostu mikroorganizmów, a nadmiar azotu jest ogólnie wydalany w środowisku w postaci amonu podczas degradacji procesu [[[ dwunasty ] .
Picolina jest izolowana dla pierwszej, w nieczystej postaci, w 1826 r. Przez niemieckiego chemika Otto Unverdorben (1806–1873), który uzyskał ją przez pirolizę [[[ 13 ] i nazywa ją ” Odoryna »Ze względu na nieprzyjemny zapach [[[ 14 ] . W 1849 r. Szkocki chemik Thomas Anderson (1819–1874) przygotowywał pikolinę czystą z smoły węglowej i przez pirolizę kości [[[ 15 ] W [[[ 16 ] . Anderson nazywa to „Picoline” przez kombinację łacińskich słów szkatułka (smoła) i oleum (olej), olej z smoły węglowej jest materiałem, z którego go wyodrębnił [[[ 17 ] W [[[ 18 ] . Około 1870 r. Niemiecki chemik Adolf von Baeyer zsyntetyzował pikolinę na dwa sposoby: przez suchą destylację ” Acroleïnammoniak »(Ch 2 = CH-CH = N-ChoH-ch-= CH 2 ) [[[ 19 ] i przez ogrzewanie ” tribromallyl »(1,2,3-tribromoprop) z amoniakiem w etanolu [[[ 20 ] .
W 1871 r [[[ 21 ] . Jeśli jednak struktura pirydyny zaproponowana przez chemika Garano-Italiana Wilhelma Körnera w 1869 r. Jest poprawna, to znaczy, że pirydyna jest analogiem benzenowym (cykl heksagonalny z naprzemiennymi i podwójnymi wiązaniami) [[[ 22 ] , Oznacza to, że istnieją trzy izomery z metodylpirydyny. Około 1879 r. Austriackiego chemika Hugo Weidel udało się wyizolować i scharakteryzować trzy izomery pikoliny, które nazywa pikoliną α–, β– i γ – [[[ 23 ] , α -pikolina jest głównym składnikiem nieczystej pikoliny, w towarzystwie niewielkich ilości β -ficoliny i γ -ficoliny, które można uzyskać przez destylację suszarki Baeyera Acroleïnammoniak .
Następnie Weidel przechodzi każdy izomer pikolinowy utlenianie przez nadmanganian potasu, przekształcając je w kwas karboksylowy. Następnie nazywa kwasową postać α -picoliny Kwas pikoliczny (kwas pikolinowy) [[[ 24 ] . Rozpoznaje w kwasu fomme β – picoline Kwas nikomu (niacyna nicyna lub kwas) [[[ 25 ] , skomponował, że odkrył w 1873 roku [[[ 26 ] .
Kiedy Weidel dekarboxyle, kwas karboksylowy Kształt każdego izomeru – przez suchą destylację soli wapnia z tlenkiem wapnia – otrzymuje pirydynę, pokazując, że pikolina była mieszaniną trzech izomerów metylopirydyny, jak miał nadzieję [[[ 27 ] . Jednak Weidel nigdy nie ustalił pozycji grupy metylowej dla żadnego z izomerów w porównaniu z atomem azotu jądra pirydycznego [[[ 28 ] Strukturę niacyny, a tym samym β-picoliny, określono w 1883 r., Kiedy chemik chequo-autichian Zdenko Skraup i Albert Cobenzl wielokrotnie utleniał β-naftoquinolinę i stwierdzono, że niacyna wśród produktów, a także β-picolina była 3- metylopirydyna [[[ 29 ] .
- Wkład „2-picoliny” w bazie danych produktów chemicznych Osiągnięcie IFA (niemiecka organizacja odpowiedzialna za bezpieczeństwo i zdrowie zawodowe) ( Niemiecki W język angielski ), dostęp do 2021-01-02 (Wymagany JavaScript) .
- Wkład „2-picoliny” w bazie danych produktów chemicznych Osiągnięcie IFA (niemiecka organizacja odpowiedzialna za bezpieczeństwo i zdrowie zawodowe) ( Niemiecki W język angielski ), dostęp do 2021-01-02 (Wymagany JavaScript) .
- Wkład „4-picoliny” w bazie danych produktów chemicznych Osiągnięcie IFA (niemiecka organizacja odpowiedzialna za bezpieczeństwo i zdrowie zawodowe) ( Niemiecki W język angielski ), dostęp do 2021-01-02 (Wymagany JavaScript) .
- Podręcznik CRC tabel do identyfikacji związków organicznych W 3 To jest wyd. , 1984 (ISBN 0-8493-0303-6 ) .
- (z) Wejście Metylopirydyna NA Römpp online . Georg Thieme Verlag, dostęp 25 listopada 2014 r.
- M. Sainsbury, M. Berry, J. D. Hepworth, C. Drayton, E. W. Abel, D Phillips, J. D. Woollins, A. G. Davies, Chemia heterocykliczna , Royal Society of Chemistry, W Pierwszy Odnośnie wyd. (ISBN 0-85404-652-6 ) W P. 30
- (W) Shinkichi Shimizu W Czy Watanabe W Toshiaki Kataoka W Takayuki Shoji W Nobuyuki Abe W Sinji Morishita I Hisaso W Encyklopedia chemii przemysłowej Ullmanna , Weinheim, Wiley-vch, (Doi 10.1002/14356007.A22_399 ) , «Pochodne pirydyny i pirydyny» .
- (z) A. Behr, Zastosowana jednorodna kataliza , Weinheim, Wiley-vch, (ISBN 3-527-31666-3 ) W P. 722
- (W) Eric F. V. Scriven et Ramiiah Murugan, Kirk-Othmer Encyclopedia of Chemical Technology , Xli, (Doi 10.1002 / 0471238961.1625180919031809.pub2 ) , «Pochodne pirydyny i pirydyny» .
- (z) Harold Hart, Leslie E. Craine, David J. Hart, Christopher M. Hadad i in. W Chemia organiczna , Weinheim, Wiley-vch, W 3 To jest wyd. (ISBN 978-3-527-31801-8 ) W P. 494
- G. K. Simowie L.E. Sommers « Degradacja pochodnych pirydyny w glebie », J. Jakość środowiska W tom. 14, N O 4, W P. 580–584 (Doi 10.2134/jeq1985.00472425001400040022x )
- G. K. Simowie L.E. Sommers « Biodegradacja pochodnych pirydyny w zawiesinach gleby », Toksykologia i chemia środowiska W tom. 5, N O 6, W P. 503–509 (Doi 10.1002/itd .5620050601 )
- Historia pierwszych badań nad Picoline patrz:
- Podręcznik chemii W tom. tom. 11, Londyn, Anglia, Cavendish Society, , 263–272 P. ( Czytaj online )
- (z) Nowy słownik chemii [«Nowy słownik chemii»], tom. Tom. 5, Braunschweig, Niemcy, Friedrich Vieweg i syn, , 575–584 P. ( Czytaj online )
- (z) Arthur Spokój Et karl Buchka W Chemia pirydyny i jej pochodnych [„Chemia pirydyny i jej pochodnych”], Braunschweig, Niemcy, Friedrich Wieweg i Son, 1889–1891, 62–68 P. ( lire en ligne)
- (z) Richard Wolffenstein W Alkaloidy roślinne [«Plant alkaloids»], Berlin, Niemcy, Julius Springer, , 40–42 P. (ISBN 9783642924491W lire en ligne)
- (z) Otto Dziewicze W ‘ O zachowaniu ciał organicznych w wyższych temperaturach » [«O zachowaniu substancji organicznych w wysokich temperaturach»], Annals of Physics and Chemistry W tom. 8, W P. 253–265; 477–487 ( Czytaj online ) Niesigorowany o imieniu Picoline Odoryna na str. 255.
- Tomasz Anderson « Na temat konstytucji i nieruchomości Picoline, nowej bazy organicznej od węgla », Transakcje Royal Society of Edinburgh W tom. 16, N O 2, W P. 123–136 (Doi 10.1017/S0080456800024984 W Czytaj online )
- Tomasz Anderson « O produktach destrukcyjnej destylacji substancji zwierzęcych. Część I. », Transakcje Royal Society of Edinburgh W tom. 16, N O 4, W P. 463–474 (Doi 10.1017/S0080456800022432 W Czytaj online )
- (Anderson, 1849), s. 1 124.
- (Fehling & Hell, 1890), s. 1 575.
- (Wolffenstein, 1922), s. 1 42.
- (z) Adolf Baeyer W ‘ Badania podstaw serii pirydyny i chinoliny. I. O syntezie pikoliny » [«Badanie podstaw serii pirydyny i chinoliny. I. O syntezie picoline »], Annals of Chemistry and Pharmacie W tom. 155, N O 3, W P. 281–294 (Doi 10.1002/JLAC.18701550304 W Czytaj online )
- James Dewar « Na temat produktów utleniania picoline », Wiadomości chemiczne W tom. 23, W P. 38–41 ( Czytaj online ) Od p. 40: „Jeśli uważamy Picoline jak we wszystkich prawdopodobieństwach metylopirydyny…”
- W. Coerns « Podsumowanie izomerycznej podstawy toluidyny », Journal of Natural and Economic Sciences (Journal of Natural Science and Economics (Palermo, Włochy)) W tom. 5, W P. 111–114 ( Czytaj online )
- (z) H. Weidel W ‘ Badania nad połączeniami z The Animalian theer » [„O badaniu związków smoły zwierzęcych”], Raporty niemieckiego społeczeństwa chemicznego W tom. dwunasty, N O 2, W P. 1989–2012 (Doi 10.1002/CBER.187901202207 W Czytaj online ) P. 2008: «Całkowita separacja udaje się tylko przez sól platndoppels. Α-picolin (jak chcę to nazwać) jest trudniejszy do rozwiązania niż β-picoliny. » (Całkowite oddzielenie [z dwóch izomerów] jest możliwe tylko dzięki ich podwójnym solenie platynowym. Ta [podwójna sól] α-picoliny (jak i wywołują) jest mniej rozpuszczalna niż β-picolina.) S 2011: „Baza Baeyera uzyskana z Acroleïnammoniak można zatem uznać za trzecią, zgodnie z możliwą γ-pikoliną Koernera”. (Tak więc podstawa Baeyera, która została uzyskana Acroleïnammoniak Być może można uznać, zgodnie z interpretacją Körnera, jako trzeci [izomer] możliwy, γ-picolina.)
- (Weidel, 1879), s. 1 1994.
- (Weidel, 1879), s. 1 2004.
- H Weidel « Dla znajomości nikotyny »[« [Wkład] do naszej wiedzy o nikotynie »], Annals of Chemistry and Pharmacie W tom. 165, N O 2, W P. 328–349 (Doi 10.1002/JLAC.18731650212 W Czytaj online )
- Widzieć :
- W (Weidel, 1879), s. 2000–2001, Weidel pokazuje, że dekarboksylacja kwasu pikolinowego wytwarza pirydynę;
- W (Weidel, 1873), s. 1 343, Weidel pokazuje, że dekarboksylacja niacyna wytwarza pirydynę;
- W (Weidel, 1879), s. 1. 2000, Weidel opisuje pikolinę jako pirydynę z grupą metylową (CH 3 -), C 5 H 5 N — ch 3 ;
- W (Weidel, 1879), s. 1. 2008, Weidelécript, że jej próbka picoline zawiera co najmniej dwa izomery z Picoline: „… mieszanka dwóch izomerów …” (… Mieszanka dwóch izomerów …).
- Dans (Weidel, 1879), s. 1. 2011: „Wspólne fakty nie są jeszcze wystarczające, aby zakończyć teoretyczne wyjaśnienia izomerii, które najwyraźniej w względnej pozycji CH 3 -, odpowiednio. Grupa COOH ma swój powód do azotu. » (Zgłoszone fakty nie są jeszcze wystarczające, aby podać ostateczne wyjaśnienia teoretyczne, w szczególności na temat izomerii, co oczywiście wyjaśniono względną pozycją grupy 3 – odpowiednio COOH – w porównaniu z azotem.)))
- (z) Zd. H. Skraup i A. Cobenzl W ‘ Około α – i β – naftochinoliny » [«Na α– i β -niftoquinoline»], Comiesięczne broszury chemii W tom. 4, W P. 436–479 (Doi 10.1007 / BF01517985 , S2cid 96180283 W Czytaj online ) Zobacz ilustrację Kwas nikomu (kwas nikotyny lub kwas niacyny) P. 455.


Recent Comments