Cortistatines – wikipedia wiki
Un article de Wikipédia, l’encyclopédie libre
 |
|
| Des noms | |
|---|---|
| Nom IUPAC
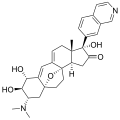
(d’abord R , 2 R , 3 S , 5 R , 8β, 17β) -3- (diméthylamino) -17- (isoquinoline-7-yl) -5,8-époxy-9,19-cyclo-9,10-secoandrosta-9 (11), 10-diène-1 , 2-diol |
|
| Autres noms
Cortistatine a |
|
| Identificateurs | |
| Chebi | |
| Chemspider | |
| QUELQUES | |
|
|
|
|
| Propriétés | |
| C 30 H 36 N 2 O 3 | |
| Masse molaire | 472.629 g · mol −1 |
|
Sauf lorsqu’il est indiqué autrement, des données sont données pour les matériaux à l’état standard (à 25 ° C [77 ° F], 100 kPa).
|
|
Composé chimique
Le cortistatines sont un groupe d’alcaloïdes stéroïdiens pour la première fois isolés en 2006 de l’éponge marine Membranicium simple . [d’abord] Les cortistatines ont d’abord été découvertes dans une recherche de composés naturels qui inhibent la prolifération des cellules endothéliales de la veine ombilicale humaine (HUVEC), la cortistatine A étant le composé le plus puissant de la classe. [2]
Le groupe Shair de Harvard avec des collaborateurs a montré que la cortistatine A est un inhibiteur très puissant et sélectif de CDK8 et CDK19, les kinases qui s’associent au complexe médiateur. [3] Sur 386 kinases évaluées, la cortistatine A a seulement inhibé Cdk8 et Cdk19, révélant qu’elle est parmi les inhibiteurs de kinase les plus sélectifs. Il a également été démontré que la cortistatine a puissement inhiber la croissance des cellules de leucémie myéloïde aiguë et de la LMA dans deux modèles de souris in vivo. L’identification des allèles dominants résistants aux médicaments de CDK8 et CDK19 démontrent que ces kinases médient l’activité de la cortistatine A dans les cellules AML. Ainsi, l’inhibition de CDK8 et CDK19 est une nouvelle approche thérapeutique de la LMA. La cortistatine A a provoqué une régulation à la hausse sélective et disproportionnée des gènes associés aux super-enhancer dans les cellules AML qui ont contribué à son activité anti-leucémique. Ce travail a indiqué que CDK8 et CDK19 sont des régulateurs négatifs des gènes associés à des super-enhancer dans la LMA.
La di-déshydrocortatine A supprime la réplication virale dans les cellules infectées par le VIH via la liaison à la protéine TAT. [4]
La cortistatine A a été synthétisée par le shair, [5] Myers, Baran [6] et Nicolaou Labs. [7]
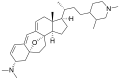
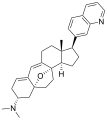
Structures chimiques [ modifier ]]
Les références [ modifier ]]
- ^ Aoki, s; Watanabe, y; Sanagawa, m; Setiawan, a; Kotoku, N; Kobayashi, M (2006). “Cortistatines A, B, C et D, alcaloïdes stéroïdes anti-angiogéniques, à partir de la marine L’éponge est simple. ” Journal de l’American Chemical Society . 128 (10): 3148–9. est ce que je: 10.1021 / ja057404h . PMID 16522087 .
- ^ Aoki, s; Watanabe, y; Tanabe, D; Arai, m; Suna, H; Miyamoto, K; Tsujibo, H; Tsujikawa, K; Yamamoto, H (2007). “Relation structure-activité et propriété biologique des cortistatines, des alcaloïdes stéroïdiens spongiens anti-angiogéniques”. Chimie bioorganique et médicinale . 15 (21): 6758–62. est ce que je: 10.1016 / j.bmc.2007.08.017 . PMID 17765550 .
- ^ Pelish, Henry E.; Liau, Brian B.; Nitulescu, ioana i.; Tangpeerachaikul, Annupot; Poss, Zachary C.; Silva, Diogo H. Da; Caruso, Brittany T.; Arefolov, Alexander; Fadeyi, Ougbeminiyi (2015). “L’inhibition de la kinase des médiateurs active en outre les gènes associés à des super-enhancer dans la LMA” . Nature . 526 (7572): 273-276. Bibcode: 2015Nature.526..273p . est ce que je: 10.1038 / nature14904 . PMC 4641525 . PMID 26416749 .
- ^ Mousseau, G.; Clementz, M. A.; Bakeman, W. N.; Arrisheth, N.; Cameron, M.; Shi, J.; Baran, P.; Fromentin, R. M.; Chomont, N.; Valente, S. T. (2012). “Un analogue de la cortistatine alcaloïde stéroïdale naturelle, un puissant supprimer la transcription du VIH dépendante du TAT” . Hôte de cellule et microbe . douzième (1): 97–108. est ce que je: 10.1016 / j.chom.2012.05.016 . PMC 3403716 . PMID 22817991 .
- ^ Lee, Hong Myung; Nieto-Oberhuber, Cristina; Shair, Matthew D. (2008-12-17). “Synthèse énantiosélective de (+) – cortistatine A, un inhibiteur puissant et sélectif de la prolifération des cellules endothéliales”. Journal de l’American Chemical Society . 130 (50): 16864–16866. est ce que je: 10.1021 / ja8071918 . ISSN 0002-7863 . PMID 19053422 .
- ^ Shenvi, Ryan A.; Guerrero, Carlos A.; Shi, Jun; Li, Chuang-Chuang; Baran, Phil S. (2008). “Synthèse de (+) – cortistatine A” . Journal de l’American Chemical Society . 130 (23): 7241–7243. est ce que je: 10.1021 / ja8023466 . PMC 2652360 . PMID 18479104 .
- ^ Nicolaou, K “Synthèse totale de (+) – cortistatine A” . Édition internationale de chimie appliquée . 47 (38): 7310–7313. est ce que je: 10.1002 / mai.200803550 . PMID 18704899 .








Recent Comments