Réarrangement de piancatelli – Wikipedia wiki
Un article de Wikipédia, l’encyclopédie libre
En 1976, le chimiste italien, Giovanni Piancatelli et ses collègues ont développé une nouvelle méthode pour synthétiser les dérivés 4-hydroxycyclopenénone à partir de 2-furylcarbinols par un réarrangement catalysé par l’acide. [d’abord] Cette découverte s’est produite lorsque Piancatelli étudiait les stéroïdes hétérocycliques et leurs capacités réactives dans un environnement acide. Alors que ce réarrangement a continué à être étudié, il est devenu un réarrangement couramment utilisé dans la synthèse naturelle des produits en raison de la capacité de créer du 4-hydroxy-5-substituédcyclopent-2-enones. [d’abord] Le motif de piancatelli pour étudier ce nouveau réarrangement provenait de la molécule de 3-oxycyclopentène toujours présente, en particulier de son dérivé de 5-hydroxy, trouvé dans les produits naturels biologiquement actifs. [2]

Mécanisme de réaction [ modifier ]]
Le mécanisme de cette réaction est proposé comme une électrocyclisation 4-π comme la réaction de cyclisation de Nazarov. [3] Pour obtenir les carbinols 2-furyle, le furfural soumis à piancatelli, une biomasse non comestible, à une réaction de grignard. [2] Ceci est ensuite soumis à l’hydrolyse catalysée par l’acide pour provoquer un réarrangement moléculaire et obtenir les carbinols finaux à 2-furyle.
Piancatelli a été proposé que la réaction est une réaction électrocyclique thermique d’un système électronique 4π conrotatoire tout en étudiant les spécificités des conditions de mécanisme lors de la synthèse des dérivés 4-hydroxycyclopetenone. Ce mécanisme a été suggéré lors de l’étude d’abord Les spectres RMN H car il est devenu évident que les produits finaux ont exclusivement livré l’isomère trans. [d’abord]
Le mécanisme proposé de Piancatelli [ modifier ]]
Dans le mécanisme proposé de Piancatelli, la formation du carbocation due à une séquence de déshydratation de protonation entraîne le fait que les deux groupes hydroxy sont anti permettre le trans -4hydroxy-5-substitué-cyclopent-2-éone d’une fermeture de cycle d’électrocylisation 4π. [d’abord] [2] [4]

Mécanismes alternatifs [ modifier ]]
D’Auria a proposé un mécanisme possible qui comprenait des intermédiaires zwitterioniques comme moyen de former le cis isomère aux côtés de l’abondance trans isomère du 2-Furylcarbinol. D’Auria a effectué le réarrangement dans l’eau bouillante sans catalyseur acide. [d’abord]

Un autre mécanisme proposé provient du yin et des collègues qui a été étudié tout en terminant le réarrangement des 2-furylcarbinols avec une chaîne hydroxyalkyle en position 5. Le yin a rationalisé le mécanisme en utilisant un ajout intramoléculaire de type Aldol. [d’abord]

Conditions de réaction [ modifier ]]
Le harnais des conditions de réaction nécessaires au réarrangement différait en fonction de la réactivité des substrats. Piancatelli a observé que les substrats les plus réactifs tels que le 5-méthyl-2-furylcarbinols peuvent subir le réarrangement avec des conditions beaucoup plus douces afin d’éviter tout produit secondaire possible. [d’abord] Les acides Lewis ont été découverts pour aider à entraîner la réaction à l’achèvement tant qu’il y avait un rapport équimolaire, tandis que les groupes alkyles sur le carbone porteurs d’hydroxy laissent le matériau de départ plus stable et provoquent des temps de réaction plus longs et des rendements plus faible à l’augmentation de la réactivité de ces carbocations. [d’abord]
Applications [ modifier ]]
Une utilisation importante du réarrangement du piancatelli qui a été étudiée par Piancatelli lui-même est la synthèse des prostaglandines et de leurs dérivés. Piancatelli a pu synthétiser des intermédiaires clés pour la préparation de l’acide prosanoïque à partir de ses 2-furylcarbinols portant un deuxième groupe fonctionnel. Cette étude a pu démontrer la polyvalence de la séquence du réarrangement.
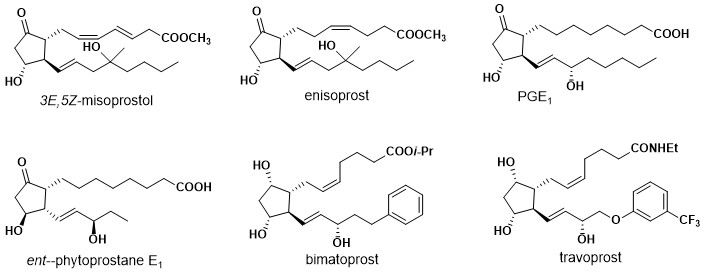
Quelques-uns des produits synthétisés en raison de l’utilisation du réarrangement du piancatelli comprennent: 3e, 5Z -Misoprostol, éisoprost, 4-fluoro-enisoprost, 2-normisoprostol, prostaglandine e d’abord (Pge d’abord ), ent -Phytoprostane E d’abord , 16- et -Phytoprostane E d’abord , bimatoprost et travoprost. (Afficher la clé RXN utilisée)
Les références [ modifier ]]
- ^ un b c d C’est F g H Piutti, Claudia; Quartiers, Francesca (8 octobre 2013). “Le réarrangement du piancatelli: nouvelles applications pour une réaction intrigante” . Molécules . 18 (10): 12290–12312. est ce que je: 10.3390 / molécules181012290 . PMC 6270237 . PMID 24108396 .
- ^ un b c Piancatelli, G.; Scettri, A.; Barbadoro, S. (septembre 1976). “Une préparation utile de 4-hydroxy-3-oxocyclopentène à 4 substitués”. Lettres de tétraèdre . 17 (39): 3555–3558. est ce que je: 10.1016 / s0040-4039 (00) 71357-8 .
- ^ Veits, Gesine K.; Wenz, Donald R.; Lire de Alaniz, Javier (2010-12-03). “Méthode polyvalente pour la synthèse de 4-aminocyclopenténones: dysprosium (III) triflate de réarrangement aza-piancatelli catalysé”. Édition internationale de chimie appliquée . 49 (49): 9484–9487. est ce que je: 10.1002 / peut-être.201005131 . ISSN 1521-3773 . PMID 21053231 .
- ^ Nieto Faza, Olalla; Silva López, Carlos; Álvarez, Rosana; De Lera, Ángel R. (2004-09-06). “Étude théorique de la fermeture de la bague électrocyclique des cations hydroxypisentadiennthes”. Chimie – une revue européenne . dix (17): 4324–4333. est ce que je: 10.1002 / Chem.200400037 . ISSN 1521-3765 . PMID 15352115 .
Recent Comments