Vision des oiseaux – Wikipedia wiki
Sens des oiseaux

Vision est le sens le plus important pour les oiseaux, car une bonne vue est essentielle pour un vol sûr. Les oiseaux ont un certain nombre d’adaptations qui donnent une acuité visuelle supérieure à celle des autres groupes de vertébrés; Un pigeon a été décrit comme “deux yeux avec des ailes”. [d’abord] Les oiseaux sont des dinosaures théropodes, [2] [3] et l’œil aviaire ressemble à celui des autres reptiles, avec des muscles ciliaires qui peuvent changer rapidement la forme de l’objectif et dans une plus grande mesure que chez les mammifères. [ citation requise ]] Les oiseaux ont les plus grands yeux par rapport à leur taille dans le règne animal, et le mouvement est par conséquent limité dans la prise osseuse de l’œil. [d’abord] En plus des deux paupières généralement trouvées chez les vertébrés, les yeux de Bird sont protégés par une troisième membrane mobile transparente. L’anatomie interne de l’œil est similaire à celle des autres vertébrés, mais a une structure, les oculi pecten, uniques aux oiseaux.
Certains groupes d’oiseaux ont des modifications spécifiques à leur système visuel lié à leur mode de vie. Les oiseaux de proie ont une très haute densité de récepteurs et d’autres adaptations qui maximisent l’acuité visuelle. Le placement de leurs yeux leur donne une bonne vision binoculaire permettant un jugement précis des distances. Les espèces nocturnes ont des yeux tubulaires, un faible nombre de détecteurs de couleurs, mais une densité élevée de cellules de tige qui fonctionnent bien sous une mauvaise lumière. Les sternes, les goélands et les albatros font partie des oiseaux de mer qui ont des gouttelettes d’huile rouge ou jaune dans les récepteurs de couleur pour améliorer la vision de la distance, en particulier dans des conditions brumeuses.
L’œil d’un oiseau ressemble le plus à celui des autres reptiles. Contrairement à l’œil des mammifères, il n’est pas sphérique et la forme plus plate permet à une plus grande partie de son champ visuel d’être mis au point. Un cercle de plaques osseuses, l’anneau sclérotique, entoure l’œil et le tient rigide, mais une amélioration par rapport à l’œil reptilien, également trouvée chez les mammifères, est que l’objectif est poussé plus loin, augmentant la taille de l’image sur la rétine. [4]

Les yeux de la plupart des oiseaux sont grands, pas très ronds et capables de se déplacer uniquement dans les orbites, [5] Généralement 10-20 ° (mais dans certains passants,> 80 °) horizontalement. C’est pourquoi les mouvements de la tête dans les oiseaux jouent un rôle plus important que les mouvements oculaires. [6] Deux yeux se déplacent généralement indépendamment, [6] [7] et chez certaines espèces, ils peuvent se déplacer de manière coordonnée dans des directions opposées. [8]
Les oiseaux aux yeux sur les côtés de leur tête ont un large champ visuel, utile pour détecter les prédateurs, tandis que ceux qui ont des yeux sur le devant de leur tête, comme les hiboux, ont une vision binoculaire et peuvent estimer les distances lors de la chasse. [9] [dix] Le cock en bois américain a probablement le plus grand champ visuel de tous les oiseau, 360 ° dans le plan horizontal et 180 ° dans le plan vertical. [11]
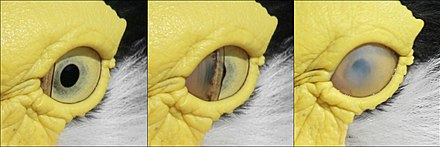
Les paupières d’un oiseau ne sont pas utilisées pour clignoter. Au lieu de cela, l’œil est lubrifié par la membrane nictitante, une troisième paupière dissimulée qui balaie horizontalement à travers l’œil comme un essuie-glace. [douzième] La membrane nictitante couvre également l’œil et agit comme une lentille de contact dans de nombreux oiseaux aquatiques lorsqu’ils sont sous l’eau. [5] En dormant, la paupière inférieure monte pour couvrir l’œil dans la plupart des oiseaux, à l’exception des hiboux à cornes où la paupière supérieure est mobile. [13]
L’œil est également nettoyé par des sécrétions de larmes de la glande lachrymale et protégés par une substance huileuse des glandes durrianes qui recouvre la cornée et empêche la sécheresse. L’œil d’un oiseau est plus grand par rapport à la taille de l’animal que pour tout autre groupe d’animaux, bien qu’une grande partie soit cachée dans son crâne. L’autruche a le plus grand œil de tous les vertébrés terrestres, avec une longueur axiale de 50 mm (2,0 po), deux fois celle de l’œil humain. [d’abord]
La taille des yeux des oiseaux est largement liée à la masse corporelle. Une étude de cinq ordres (perroquets, pigeons, pétrels, rapaces et hiboux) a montré que la masse oculaire est proportionnelle à la masse corporelle, mais comme prévu de leurs habitudes et de leur écologie visuelle, les rapaces et les hiboux ont des yeux relativement importants pour leur masse corporelle. [14]
Les études comportementales montrent que de nombreuses espèces aviaires se concentrent sur des objets distants préférentiellement avec leur champ de vision latéral et monoculaire, et les oiseaux s’orienteront latéralement pour maximiser la résolution visuelle. Pour un pigeon, la résolution est deux fois plus bonne avec la vision monoculaire latérale que la vision binoculaire avant, tandis que pour les humains, l’inverse est vrai. [d’abord]

Les performances de l’œil dans les faibles niveaux de lumière dépendent de la distance entre la lentille et la rétine, et les petits oiseaux sont effectivement forcés d’être diurnes car leurs yeux ne sont pas assez grands pour donner une vision nocturne adéquate. Bien que de nombreuses espèces migrent la nuit, elles entrent souvent en collision avec des objets même brillamment éclairés comme les phares ou les plates-formes pétrolières. Les oiseaux de proie sont diurnes car, bien que leurs yeux soient grands, ils sont optimisés pour donner une résolution spatiale maximale plutôt que dans la collecte de lumière, de sorte qu’elles ne fonctionnent pas non plus bien sous une mauvaise lumière. [15] De nombreux oiseaux ont une asymétrie dans la structure de l’œil qui leur permet de conserver l’horizon et une partie importante du sol en foyer simultanément. Le coût de cette adaptation est qu’ils ont une myopie dans la partie inférieure de leur champ visuel. [d’abord]
Les oiseaux aux yeux relativement grands par rapport à leur masse corporelle, comme les rouges courants et les robins européens, chantent plus tôt à l’aube que les oiseaux de la même masse avec des yeux plus petits. Cependant, si les oiseaux ont la même taille des yeux mais différentes masses corporelles, la plus grande espèce chante plus tard que la plus petite. Cela peut être dû au fait que le petit oiseau doit commencer la veille en raison d’une perte de poids pendant la nuit. [16] La perte de poids d’une nuit pour les petits oiseaux est généralement de 5 à 10% et peut dépasser 15% les nuits d’hiver froides. [16] Dans une étude, Robins a mis plus de masse dans leur alimentation au crépuscule lorsque les nuits étaient froides. [17]
Les oiseaux nocturnes ont des yeux optimisés pour une sensibilité visuelle, avec de gros cornées par rapport à la longueur de l’œil, tandis que les oiseaux diurnes ont des yeux plus longs par rapport au diamètre cornéen pour donner une plus grande acuité visuelle. Des informations sur les activités des espèces éteintes peuvent être déduites des mesures du cycle sclérotique et de la profondeur d’orbite. Pour que cette dernière mesure soit effectuée, le fossile doit avoir conservé sa forme tridimensionnelle, de sorte que le modèle d’activité ne peut pas être déterminé avec confiance à partir d’échantillons aplatis comme Archéopteryx , qui a un anneau sclérotique complet mais aucune mesure de la profondeur d’orbite. [18]
Anatomie de l’œil [ modifier ]]

Les principales structures de l’œil des oiseaux sont similaires à celles des autres vertébrés. La couche extérieure de l’œil se compose de la cornée transparente à l’avant et de deux couches de sclénérat – une couche de fibre de collagène blanche difficile qui entoure le reste de l’œil et soutient et protège l’œil dans son ensemble. L’œil est divisé en interne par l’objectif en deux segments principaux: le segment antérieur et le segment postérieur. Le segment antérieur est rempli d’un liquide aqueux appelé l’humour aqueux, et le segment postérieur contient l’humour vitreux, une substance claire-semblable.
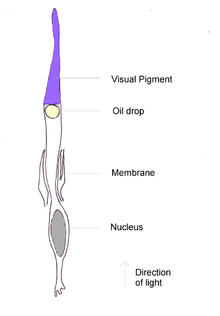
L’objectif est un corps convexe ou de la lentille transparent avec une couche extérieure plus dure et une couche intérieure plus douce. Il concentre la lumière sur la rétine. La forme de la lentille peut être modifiée par des muscles ciliaires qui sont directement attachés à la capsule de la lentille au moyen des fibres zonulaires. En plus de ces muscles, certains oiseaux ont également un deuxième ensemble, les muscles de Crampton, qui peuvent changer la forme de la cornée, donnant ainsi aux oiseaux une plus grande gamme d’accommodement que ce qui est possible pour les mammifères. Ce logement peut être rapide dans certains oiseaux à eau de plongée comme dans les fusions. L’iris est un diaphragme coloré à transition musculaire devant la lentille qui contrôle la quantité de lumière entrant dans l’œil. Au centre de l’iris se trouve l’élève, la zone circulaire variable à travers laquelle la lumière passe dans l’œil. [4] [19]

La rétine est une structure multicouche incurvée relativement lisse contenant la tige photosensible et le cône avec les neurones associés et les vaisseaux sanguins. La densité des photorécepteurs est essentielle pour déterminer l’acuité visuelle maximale réalisable. Les humains ont environ 200 000 récepteurs par mm 2 , mais le Sparrow de la maison en a 400 000 et le bourdonnement commun de 1 000 000. Les photorécepteurs ne sont pas tous connectés individuellement au nerf optique, et le rapport des ganglions du nerf aux récepteurs est important pour déterminer la résolution. Ceci est très élevé pour les oiseaux; La bergeronnette blanche a 100 000 cellules ganglionnaires à 120 000 photorécepteurs. [4]
Les tiges sont plus sensibles à la lumière, mais ne donnent aucune information sur les couleurs, tandis que les cônes moins sensibles permettent la vision des couleurs. Chez les oiseaux diurnes, 80% des récepteurs peuvent être des cônes (90% dans certains marais) tandis que les hiboux nocturnes ont presque toutes les tiges. Comme pour les autres vertébrés à l’exception des mammifères placentaires, certains des cônes peuvent être des cônes doubles. Ceux-ci peuvent représenter 50% de tous les cônes de certaines espèces. [20]
Vers le centre de la rétine se trouve la fovéa (ou la moins spécialisée de la zone centrale) qui a une plus grande densité de récepteurs et est la zone de la plus grande acuité visuelle avant, c’est-à-dire la détection la plus nette la plus claire des objets. Dans 54% des oiseaux, y compris les oiseaux de proies, les martins-pêcheurs, les colibris et les hirondelles, il y a la deuxième fovéa pour une visualisation latérale améliorée. Le nerf optique est un paquet de fibres nerveuses qui transportent des messages de l’œil aux parties pertinentes du cerveau. Comme les mammifères, les oiseaux ont un petit angle mort sans photorécepteurs au disque optique, sous lequel le nerf optique et les vaisseaux sanguins se joignent à l’œil. [4]
Le pecten est un corps mal compris composé de tissus pliés qui projettent de la rétine. Il est bien fourni avec des vaisseaux sanguins et semble garder la rétine fournie en nutriments, [d’abord] et peut également ombrager la rétine de la lumière éblouissante ou aider à détecter les objets en mouvement. [4] Pecten Oculi est abondamment rempli de granules de mélanine qui ont été proposés pour absorber la lumière parasite entrant dans l’œil de l’oiseau pour réduire l’éblouissement de fond. Un léger réchauffement des oculi de pecten due à l’absorption de la lumière par des granules de mélanine a été proposé pour améliorer le taux métabolique de pecten. Cela est suggéré d’aider à augmenter la sécrétion de nutriments dans le corps vitreux, pour finalement être absorbé par la rétine avasculaire des oiseaux pour une meilleure nutrition. [21] Une activité enzymatique extra-élevée de la phosphatase alcaline dans les oculi de pectes a été proposée pour soutenir une activité sécrétoire élevée du pecten pour compléter la nutrition de la rétine. [22]
La choroïde est une couche située derrière la rétine qui contient de nombreuses petites artères et veines. Ceux-ci fournissent du sang artériel à la rétine et drainent le sang veineux. La choroïde contient de la mélanine, un pigment qui donne à l’œil intérieur sa couleur sombre, aidant à prévenir les réflexions perturbatrices.
Perception de la lumière [ modifier ]]

Il y a deux sortes de récepteurs légers dans les yeux d’oiseau, des tiges et des cônes. Les tiges, qui contiennent le pigment visuel, la rhodopsine sont meilleures pour la vision nocturne car elles sont sensibles aux petites quantités de lumière. Les cônes détectent des couleurs (ou des longueurs d’onde) spécifiques de la lumière, elles sont donc plus importantes pour les animaux orientés vers la couleur comme les oiseaux. [25] La plupart des oiseaux sont tétrachromatiques, possédant quatre types de cellules coniques chacune avec un pic d’absorption maximal distinctif. Chez certains oiseaux, le pic d’absorption maximal de la cellule conique responsable de la longueur d’onde la plus courte s’étend à la plage ultraviolette (UV), ce qui les rend sensibles aux UV. [26] En plus de cela, les cônes de la rétine de l’oiseau sont disposés sous une forme caractéristique de distribution spatiale, connue sous le nom de distribution hyperuniforme, qui maximise son absorption de lumière et de couleur. Cette forme de distributions spatiales n’est observée que à la suite d’un processus d’optimisation, qui, dans ce cas, peut être décrite en termes d’histoire évolutive des oiseaux. [27]
Les quatre pigments de cône spectralement distincts sont dérivés de la protéine opsine, liés à une petite molécule appelée rétinction, qui est étroitement liée à la vitamine A. Lorsque le pigment absorbe la forme, les changements de rétine se forment et modifient le potentiel membranaire de la cellule conique affectant les neurones dans les neurones dans La couche ganglionnaire de la rétine. Chaque neurone de la couche de ganglion peut traiter les informations à partir d’un certain nombre de cellules photorécepteurs et peut à son tour déclencher une impulsion nerveuse pour relayer les informations le long du nerf optique pour un traitement ultérieur dans des centres visuels spécialisés dans le cerveau. Plus une lumière est intense, plus les photons sont absorbés par les pigments visuels; Plus l’excitation de chaque cône est grande et plus la lumière apparaît est lumineuse. [25]
De loin, le pigment de cône le plus abondant dans toutes les espèces d’oiseaux examinés est la forme à longue longueur d’onde de l’iodopsine, qui absorbe aux longueurs d’onde près de 570 nm. Il s’agit à peu près de la région spectrale occupée par les pigments sensibles au rouge et au vert dans la rétine primate, et ce pigment visuel domine la sensibilité des couleurs des oiseaux. [28] Dans les pingouins, ce pigment semble avoir déplacé son pic d’absorption à 543 nm, vraisemblablement une adaptation à un environnement aquatique bleu. [29]
Les informations véhiculées par un seul cône sont limitées: en soi, la cellule ne peut pas dire au cerveau quelle longueur d’onde de lumière a provoqué son excitation. Un pigment visuel peut absorber deux longueurs d’onde de manière égale, mais même si leurs photons sont d’énergies différentes, le cône ne peut pas les distinguer, car ils font changer la forme de la rétinction et déclenchent ainsi la même impulsion. Pour que le cerveau puisse voir la couleur, il doit comparer les réponses de deux classes ou plus de cônes contenant différents pigments visuels, de sorte que les quatre pigments chez les oiseaux donnent une discrimination accrue. [25]
Chaque cône d’un oiseau ou d’un reptile contient une gouttelette d’huile colorée; Ceux-ci n’existent plus chez les mammifères. Les gouttelettes, qui contiennent des concentrations élevées de caroténoïdes, sont placées de sorte que la lumière les traverse avant d’atteindre le pigment visuel. Ils agissent comme des filtres, en supprimant certaines longueurs d’onde et en rétrécissant les spectres d’absorption des pigments. Cela réduit le chevauchement de la réponse entre les pigments et augmente le nombre de couleurs qu’un oiseau peut discerner. [25] Six types de gouttelettes d’huile de cône ont été identifiés; Cinq d’entre eux ont des mélanges caroténoïdes qui absorbent à différentes longueurs d’onde et intensités, et le sixième type n’a pas de pigments. [30] Les pigments de cône avec le pic d’absorption maximal le plus bas, y compris ceux qui sont sensibles aux UV, possèdent le type de gouttelettes d’huile «clair» ou «transparent» avec peu d’effet de réglage spectral. [trente et un]
Les couleurs et les distributions des gouttelettes d’huile rétinienne varient considérablement selon les espèces et dépend davantage de la niche écologique utilisée (Hunter, Fisher, Herbivore) que les relations génétiques. À titre d’exemples, les chasseurs diurnes comme la grange et les oiseaux de proie ont peu de gouttelettes colorées, tandis que la sterne commune de pêche en surface a un grand nombre de gouttelettes rouges et jaunes dans la rétine dorsale. Les preuves suggèrent que les gouttelettes d’huile répondent à la sélection naturelle plus rapidement que les pigments visuels du cône. [28] Même dans la gamme de longueurs d’onde visibles par les humains, les oiseaux passéraires peuvent détecter les différences de couleurs que les humains ne s’inscrivent pas. Cette discrimination plus fine, ainsi que la capacité de voir la lumière ultraviolette, signifie que de nombreuses espèces présentent un dichromatisme sexuel visible pour les oiseaux mais pas les humains. [32]
Les oiseaux chanteurs migratoires utilisent le champ magnétique terrestre, les étoiles, le soleil et d’autres indices inconnus pour déterminer leur direction migratoire. Une étude américaine a suggéré que les moineaux migratoires des savanes utilisaient la lumière polarisée dans une zone de ciel près de l’horizon pour recalibrer leur système de navigation magnétique au lever du soleil et au coucher du soleil. Cela suggère que les modèles de polarisation des puits de lumière sont la principale référence d’étalonnage pour tous les oiseaux chanteurs migratoires. [33] Cependant, il semble que les oiseaux puissent répondre aux indicateurs secondaires de l’angle de polarisation et peuvent ne pas être réellement capables de détecter directement la direction de polarisation en l’absence de ces indices. [34]
Sensibilité ultraviolette [ modifier ]]

De nombreuses espèces d’oiseaux sont tétrachromatiques, avec des cellules côtières dédiées pour percevoir des longueurs d’onde dans les régions ultraviolets et violettes du spectre lumineux. Ces cellules contiennent une combinaison d’opsines sensibles aux ondes courtes (SWS1), d’opsines de type SWS1 (SWS2) et de pigments de caroténoïde à ondes longues [35] Pour filtrer et recevoir sélectivement la lumière entre 300 et 400 nm. Il existe deux types de vision des couleurs des ondes courtes chez les oiseaux: sensible aux violettes (VS) et sensible aux ultraviolets (UV). [36] Les substitutions mononucléotidiques dans la séquence d’opsine SWS1 sont responsables de la sensibilité spectrale de l’opsine à partir de la sensible violet (λ max = 400) à ultraviolet sensible (λ max = 310–360). [37] Il s’agit du mécanisme évolutif proposé par lequel la vision ultraviolette est à l’origine apparue. Les principaux clades des oiseaux qui ont une vision des UV sont les paléognathes (ratites et tinamous), les charadriiformes (oiseaux de rivage, les goélands et alcids), les trogoniformes (trogons), les psittaciformes (perroquets) et les pasteriformes (oiseaux perchants, représentant plus de la moitié de tous les Avian espèces). [38]
La vision UVS peut être utile pour la parade nuptiale. Les oiseaux qui ne présentent pas de dichromatisme sexuel dans les longueurs d’onde visibles par l’homme sont parfois distingués par la présence de plaques réfléchissantes ultraviolets sur leurs plumes. [39] [40] Les seins bleus mâles ont un patch de couronne réfléchissante ultraviolette qui est affiché dans la parade nuptiale par la posture et l’élévation de leurs plumes nuages. [41] Les gros-celles de bleu mâle avec le bleu les plus brillantes et les plus en UV dans leur plumage sont plus grandes, contiennent les territoires les plus étendus avec des proies abondantes et nourrissent leur progéniture plus fréquemment que les autres mâles. [25] Les pétrels de tempête méditerranéenne ne présentent pas de dimorphisme sexuel dans les schémas UV, mais la corrélation entre la réflectance UV et la condition corporelle masculine suggère un rôle possible dans la sélection sexuelle. [42]
L’apparence du projet de loi est importante dans les interactions du merle. Bien que la composante UV ne semble pas importante dans les interactions entre les mâles qui tiennent le territoire, où le degré d’orange est le principal facteur, la femme réagit plus fortement aux hommes avec des factures qui ont une bonne réflectivité UV. [43]
Il est également démontré que les UV servent les fonctions dans la recherche de nourriture, [44] Identification des proies, [45] et frugivory. Avantages similaires offerts aux primates trichromatiques sur des primates dichromatiques en frugivory [quarante-six] sont généralement considérés comme existant chez les oiseaux. Les surfaces cireuses de nombreux fruits et baies peuvent refléter la lumière UV qui annonce leur présence aux oiseaux UV. [25] Cependant, des preuves généralisées à l’appui de la frugivoire médiée par la couleur sont équivoques et peuvent être dépendantes de l’échelle. [47] Les crépussels communs sont capables de localiser les sentiers de campagnols avec une vision; Ces petits rongeurs posent des sentiers de parfum d’urine et de excréments qui reflètent la lumière UV, les rendant visibles pour les crécerels. [45] Cependant, ce point de vue a été contesté par la découverte d’une faible sensibilité aux UV chez les rapaces et une faible réflexion UV de l’urine des mammifères. [48]
Bien que la vision tétrachromatique ne soit pas exclusive aux oiseaux (insectes, reptiles et crustacés sont également sensibles aux courtes longueurs d’onde), certains prédateurs d’oiseaux UV ne peuvent pas voir la lumière ultraviolette. Cela soulève la possibilité que la vision ultraviolette donne aux oiseaux un canal dans lequel ils peuvent signaler en privé, restant ainsi discret aux prédateurs. [49] Cependant, des preuves récentes ne semblent pas étayer cette hypothèse. [50]
Les oiseaux peuvent également utiliser des indices ultraviolets pour distinguer les plans d’eau propres et pollués. Le principal produit des déchets du métabolisme aviaire de l’azote est l’acide urique qui absorbe la lumière UV et reste principalement non dissous dans l’eau, tandis que le carbamide dans l’urine des mammifères reflète la lumière UV. [45] Cependant, les expériences à double choix sur les pigeons n’ont pas pu montrer de préférences détectables vers l’eau propre. [51]
Perception [ modifier ]]
Sensibilité au contraste [ modifier ]]
Le contraste (ou plus précisément Michelson-Contrast) est défini comme la différence de luminance entre deux zones de stimulus, divisée par la somme de la luminance des deux. La sensibilité au contraste est l’inverse du plus petit contraste qui puisse être détecté; Une sensibilité au contraste de 100 signifie que le plus petit contraste (Michelson) qui peut être détecté est de 1%. Les oiseaux ont une sensibilité au contraste relativement plus faible que les mammifères. Il a été démontré que les humains détectent des contrastes aussi bas que 0,5 à 1% [52] Alors que la plupart des oiseaux testés nécessitent CA. 10% de contraste pour montrer une réponse comportementale. [53] [54] [55] Une fonction de sensibilité au contraste décrit la capacité d’un animal à détecter le contraste des modèles de réseau de différentes fréquences spatiales (c’est-à-dire des détails différents). Pour les expériences de visualisation stationnaire, la sensibilité au contraste est la plus élevée à une fréquence spatiale moyenne et plus faible pour les fréquences spatiales plus élevées et plus faibles. [56]
Mouvement [ modifier ]]

Les oiseaux peuvent mieux résoudre les mouvements rapides que les humains, pour lesquels le scintillement à un rythme supérieur à 50 cycles d’impulsion légers par seconde apparaît comme un mouvement continu. Les humains ne peuvent donc pas distinguer les éclairs individuels d’une ampoule fluorescente oscillant à 60 cycles d’impulsion lumineuse par seconde, mais les perruches et les poulets ont des cycles d’impulsion scintillants ou légers par seconde de plus de 100 cycles d’impulsion légers par seconde. [ citation requise ]] Un faucon de Cooper peut poursuivre des proies agiles à travers les bois et éviter les branches et autres objets à grande vitesse; Pour les humains, une telle poursuite apparaîtrait comme un flou. [11]
Les oiseaux peuvent également détecter des objets en mouvement lente. Le mouvement du soleil et des constellations à travers le ciel est imperceptible pour l’homme, mais détecté par les oiseaux. La capacité de détecter ces mouvements permet aux oiseaux de migration de s’orienter correctement. [11]
Pour obtenir des images régulières tout en volant ou lorsqu’elles sont perchées sur une branche balançante, les oiseaux maintiennent la tête aussi stable que possible avec des réflexes compensateurs. Le maintien d’une image constante est particulièrement pertinent pour les oiseaux de proie. [11] Parce que l’image peut être centrée sur la fovéa profonde d’un seul œil à la fois, la plupart des faucons lors de la plongée utilisent un chemin en spirale pour aborder leur proie après avoir verrouillé sur un individu cible. L’alternative de tourner la tête pour une meilleure vue ralentit la plongée en augmentant la traînée tandis que la spirale ne réduit pas considérablement les vitesses. [57] [58]
Bords et formes [ modifier ]]
Lorsqu’un objet est partiellement bloqué par un autre, les humains ont inconsciemment tendance à compenser et à compléter les formes (voir la perception amodale). Il a toutefois été démontré que les pigeons ne complètent pas les formes occluses. [59] Une étude basée sur la modification du niveau de gris d’un perchoir qui était coloré différemment de l’arrière-plan a montré que les perruches ne détectent pas les bords en fonction des couleurs. [60]
Champs magnétiques [ modifier ]]
Il a été suggéré que la perception des champs magnétiques par les oiseaux migrateurs dépendait de la lumière. [soixante-et-un] Les oiseaux se déplacent la tête pour détecter l’orientation du champ magnétique, [62] et des études sur les voies neuronales ont suggéré que les oiseaux pourraient être capables de “voir” les champs magnétiques. [63] L’œil droit d’un oiseau migrateur contient des protéines photoréceptives appelées cryptochromes. La lumière excite ces molécules pour produire des électrons non appariés qui interagissent avec le champ magnétique de la Terre, fournissant ainsi des informations directionnelles. [soixante-quatre] [65]
Variations entre les groupes d’oiseaux [ modifier ]]
Oiseaux diurnes de proie [ modifier ]]

La capacité visuelle des oiseaux de proie est légendaire, et la passion de leur vue est due à une variété de facteurs. Les rapaces ont de grands yeux pour leur taille, 1,4 fois supérieur à la moyenne des oiseaux du même poids, [14] et l’œil est en forme de tube pour produire une image rétinienne plus grande. La puissance de résolution d’un œil dépend à la fois de l’optique, de grands yeux avec de grandes ouvertures souffrent moins de diffraction et peuvent avoir des images rétiniennes plus grandes en raison d’une longue distance focale et de la densité de l’espacement des récepteurs. La rétine a un grand nombre de récepteurs par millimètre carré, qui détermine le degré d’acuité visuelle. Plus un animal a des récepteurs, plus sa capacité à distinguer les objets individuels est élevée, surtout lorsque, comme chez les rapaces, chaque récepteur est généralement attaché à un seul ganglion. [d’abord] De nombreux rapaces ont des foveas avec beaucoup plus de tiges et de cônes que la fovéa humaine (65 000 / mm 2 Dans American Kestrel, 38 000 chez l’homme) et cela offre à ces oiseaux une vision à longue distance spectaculaire. [ citation requise ]] Il est proposé que la forme de la fovéa centrale profonde des Raptors puisse créer un système optique de téléobjectif, [66] Augmenter la taille de l’image rétinienne dans la fovéa et ainsi augmenter la résolution spatiale. Les études comportementales montrent que certains rapaces aux yeux grands (aigle à queue de coin, vautours de l’ancien monde) ont une résolution spatiale 2 fois plus élevée que les humains, mais de nombreux rapaces de taille moyenne et de petite taille ont une résolution spatiale comparable ou plus faible. [soixante-sept] [68] [69] [70] [71] [72]
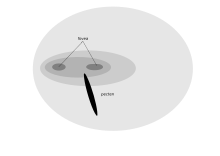
Les yeux orientés vers l’avant d’un oiseau de proie donnent une vision binoculaire, qui est aidée par une double fovéa. [4] Les adaptations du Raptor pour une résolution visuelle optimale (un crécerel américain peut voir un insecte de 2 mm du haut d’un arbre 18-m) a un désavantage en ce que sa vision est médiocre en bas niveau, et il doit se percher la nuit. [d’abord] Les Raptors peuvent avoir à poursuivre des proies mobiles dans la partie inférieure de leur champ visuel, et donc n’ont pas l’adaptation de myopie du champ inférieur démontré par de nombreux autres oiseaux. [d’abord] Les oiseaux de récupération comme les vautours n’ont pas besoin de vision aussi nette, donc un condor n’a qu’une seule fovéa avec environ 35 000 récepteurs MM 2 . Les vautours ont cependant une activité physiologique élevée de nombreuses enzymes importantes pour s’adapter à leur clarté de vision lointaine. [74] [ citation requise ]] Le caracara à crête n’a également qu’une seule fovéa car cette espèce se nourrit au sol pour les charognes et les insectes. Cependant, ils ont un degré plus élevé de chevauchement binoculaire que les autres faucons, potentiellement pour permettre au caracara de manipuler des objets, tels que des roches, tandis que la nourriture. [75]
Comme d’autres oiseaux étudiés, les rapaces ont également des gouttelettes d’huile colorées dans leurs cônes. [69] [70] [76] Le plumage généralement brun, gris et blanc de ce groupe, et l’absence de couleurs dans la cour, suggèrent que la couleur est relativement peu importante pour ces oiseaux. [4]
Dans la plupart des Raptors, une crête des yeux proéminente et ses plumes s’étendent au-dessus et devant l’œil. Ce “sourcil” donne aux oiseaux de proie leur regard distinctif. La crête protège physiquement l’œil du vent, de la poussière et des débris et le protège d’un éclat excessif. L’Osprey n’a pas cette crête, bien que la disposition des plumes au-dessus de ses yeux sert une fonction similaire; Il possède également des plumes sombres devant l’œil qui servent probablement à réduire l’éclat de la surface de l’eau lorsque l’oiseau recherche son régime alimentaire de base du poisson. [11]
Oiseaux nocturnes [ modifier ]]

Les hiboux ont de très grands yeux pour leur taille, 2,2 fois supérieur à la moyenne des oiseaux du même poids, [14] et positionné à l’avant de la tête. Les yeux ont un chevauchement de champ de 50 à 70%, ce qui donne une meilleure vision binoculaire que pour les oiseaux diurnes de proie (chevauchement de 30 à 50%). [77] La rétine du hibou fauve a environ 56 000 tiges légères par millimètre carré (36 millions par pouce carré); Bien que les allégations antérieures puissent voir dans la partie infrarouge du spectre ont été rejetées. [78]

Les adaptations à la vision nocturne comprennent la grande taille de l’œil, sa forme tubulaire, un grand nombre de bâtonnets rétiniens étroitement emballés et une absence de cônes, car les cellules du cône ne sont pas suffisamment sensibles pour un environnement nocturne à faible teneur en photon. Il y a peu de gouttelettes d’huile colorées, ce qui réduirait l’intensité lumineuse, mais la rétine contient une couche réfléchissante, le tapetum lucidum. Cela augmente la quantité de lumière que chaque cellule photosensible reçoit, permettant à l’oiseau de mieux voir dans des conditions de faible luminosité. [4] Les hiboux n’ont normalement qu’une seule fovéa, et qui est mal développée, sauf dans les chasseurs diurnes comme la chouette à oreilles courtes. [77]
Outre les hiboux, les faucons de batte, les grenouilles et les nocturnes affichent également une bonne vision nocturne. Certaines espèces d’oiseaux nichent profondément dans des systèmes de grottes qui sont trop sombres pour la vision, et trouvent leur chemin vers le nid avec une forme simple d’écholocation. Le oiseau d’huile est le seul oiseau nocturne à échoquer, [79] mais plusieurs Aérodramus Les Swiftlets utilisent également cette technique, avec une espèce, ATIU Swiftlet, utilisant également l’écholocation à l’extérieur de ses grottes. [80] [81]
Des oiseaux aquatiques [ modifier ]]

Les oiseaux de mer tels que les sternes et les goélands qui se nourrissent à la surface ou plongent pour les aliments ont des gouttelettes d’huile rouge dans les cônes de leurs rétines. Cela améliore le contraste et aiguise la vision à distance, en particulier dans des conditions brumeuses. [4] Les oiseaux qui doivent parcourir une interface air / eau ont des pigments caroténoïdes plus profondément colorés dans les gouttelettes d’huile que les autres espèces. [28]
Cela les aide à localiser des bancs de poissons, bien qu’il ne soit pas certain qu’ils observent le phytoplancton sur lequel les poissons se nourrissent ou d’autres oiseaux d’alimentation. [82]
Les oiseaux qui pêchent par furtivité au-dessus de l’eau doivent corriger la réfraction, en particulier lorsque les poissons sont observés à un angle. Les hérons de récifs et les petits aigrettes semblent être en mesure de faire les corrections nécessaires lors de la capture du poisson et réussissent mieux à attraper des poissons lorsque des frappes sont faites sous un angle aigu et ce succès plus élevé peut être dû à l’incapacité du poisson à détecter leurs prédateurs. [83] D’autres études indiquent que les aigrettes fonctionnent dans un angle de frappe préféré et que la probabilité de manquements augmente lorsque l’angle devient trop éloigné de la verticale conduisant à une différence accrue entre la profondeur apparente et réelle de la proie. [84]
Les oiseaux qui poursuivent des poissons sous l’eau comme les auks et les plongeurs ont beaucoup moins de gouttelettes d’huile rouge, [4] Mais ils ont des lentilles flexibles spéciales et utilisent la membrane nictitante comme objectif supplémentaire. Cela permet un plus grand logement optique pour une bonne vision dans l’air et l’eau. [5] Les cormorans ont une plus grande gamme d’hébergement visuel, à 50 dioptres, que tout autre oiseau, mais les martins-pêcheurs sont considérés comme ayant la meilleure vision polyvalente (air et eau). [4]
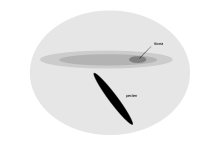
Les oiseaux de mer tubenosés, qui ne surgissent que pour se reproduire et passer la majeure partie de leur vie à se promener près de la surface des océans, ont une longue zone de sensibilité visuelle sur la rétine [d’abord] Cette région, le zone géante cellulaire , a été trouvé dans le manx cachette, Kerguelen Petrel, grand cisaillement, prion à large bec et pettel de plongée commun. Il se caractérise par la présence de cellules ganglionnaires qui sont régulièrement disposées et plus grandes que celles trouvées dans le reste de la rétine, et apparaissent morphologiquement similaires aux cellules de la rétine chez les chats. L’emplacement et la morphologie cellulaire de cette nouvelle zone suggèrent une fonction dans la détection des éléments dans un petit champ binoculaire se projetant en dessous et autour du projet de loi. Il ne concerne pas principalement une résolution spatiale élevée, mais peut aider à la détection des proies près de la surface de la mer alors qu’un oiseau vole à bas sur elle. [85]
Le Manx Shearwater, comme de nombreux autres oiseaux de mer, visite ses colonies reproductrices la nuit pour réduire les risques d’attaque par des prédateurs aériens. Deux aspects de sa structure optique suggèrent que l’œil de cette espèce est adapté à la vision la nuit. Aux yeux du cisaillement, l’objectif fait la majeure partie de la flexion de la lumière nécessaire pour produire une image ciblée sur la rétine. La cornée, le revêtement extérieur de l’œil, est relativement plat et donc de faible puissance de réfraction. Dans un oiseau diurne comme le pigeon, l’inverse est vrai; La cornée est très courbée et est le principal composant de réfraction. Le rapport de réfraction par l’objectif à celui par la cornée est de 1,6 pour le cisaillement et 0,4 pour le pigeon; La figure du cisaillement est cohérente avec celle d’une gamme d’oiseaux et de mammifères nocturnes. [quatre-vingt six]
La distance focale plus courte des yeux de cisaillement leur donne une image plus petite mais plus brillante que ce qui est le cas pour les pigeons, donc ce dernier a une vision diurne plus nette. Bien que le Manx Shearwater ait des adaptations pour la vision nocturne, l’effet est petit et il est probable que ces oiseaux utilisent également l’odeur et l’ouïe pour localiser leurs nids. [quatre-vingt six]
On pensait que les pingouins étaient en phase vue sur terre. Bien que la cornée soit plate et adaptée à la natation sous l’eau, la lentille est très forte et peut compenser la focalisation cornéenne réduite lorsqu’elle est hors de l’eau. [77] Presque la solution inverse est utilisée par le fusion à capuchon qui peut gonfler une partie de l’objectif à travers l’iris lorsqu’il est submergé. [77]
Voir également [ modifier ]]
- ^ un b c d C’est F g H je J Güntürkün, onur, “Structure and functions of the eye” in Sturkie (1998) 1–18
- ^ “En fait, les oiseaux vivants ne sont rien de moins que les petits dinosaures théropodes à queue à plumes à plumes.” K. Padian et L.M. Chiappe: l’origine des oiseaux et leur vol. Scientific American (février 1998), p. 47.
- ^ “Avian Visual Cognition”, édité et publié par le Dr Robert G. Cook, Département de psychologie, Tufts University. En coopération avec la Cognition Press comparative (septembre 2001), http://www.pigeon.psy.tift.edu/avc/husband/avc3dino.htm
- ^ un b c d C’est F g H je J k Sinclair (1985) 88–100
- ^ un b c Gill, Frank (1995). Ornithologie . New York: WH Freeman and Co. Isbn 978-0-7167-2415-5 . OCLC 30354617 .
- ^ un b Land, M. F. (2014). “Mouvements oculaires des vertébrés et leur relation avec la forme et la fonction des yeux”. Journal of Comparative Physiology a . 201 (2): 195–214. est ce que je: 10.1007 / S00359-014-0964-5 . PMID 25398576 . S2cid 15836436 .
- ^ Martin G. R. (2007). “Les champs visuels et leurs fonctions chez les oiseaux”. Journal of Ornithology . 148 : 547–562. est ce que je: 10.1007 / s10336-007-0213-6 . S2cid 24678783 .
- ^ Voss J., Mgr H.-J. (2009). “Les mouvements oculaires des oiseaux aux yeux latéralement ne sont pas indépendants” (PDF) . Journal of Experimental Biology . 212 (10): 1568–1575. est ce que je: 10.1242 / ou.024950 . PMID 19411551 . S2cid 931601 .
- ^ Martin, Graham R.; Katzir, G (1999). “Champs visuels dans les aigles courts, Français (Accipitridae), et la fonction de la binocularité chez les oiseaux “. Cerveau, comportement et évolution . 53 (2): 55–66. est ce que je: 10.1159 / 000006582 . PMID 9933782 . S2cid 44351032 .
- ^ Tyrrell L. P., Fernández-Juricic E. (2017). “Vision binoculaire aviaire: ce n’est pas seulement ce que les oiseaux peuvent voir, c’est aussi ce qu’ils ne peuvent pas” . Plos un . douzième (3): E0173235. Bibcode: 2017ploso..1273235T . est ce que je: 10.1371 / journal.pone.0173235 . PMC 5371358 . PMID 28355250 .
- ^ un b c d C’est Jones, Michael P; Pierce Jr, Kenneth E.; Ward, Daniel (avril 2007). “Vision aviaire: examen de la forme et de la fonction avec une considération particulière pour les oiseaux de proie” (PDF) . Journal of Exotic Pet Medicine . 16 (2): 69–87. est ce que je: 10.1053 / j.jepm.2007.03.012 . Archivé de l’original (PDF) le 2008-12-17.
- ^ Williams, David L.; Flach, E (mars 2003). “Symblepharon avec saillie aberrante de la membrane nictitante dans le hibou enneigé ( Nycta scandiaca ) ” (PDF) . Ophtalmologie vétérinaire . 6 (1): 11–13. est ce que je: 10.1046 / j.1463-5224.2003.00250.x . PMID 12641836 . Archivé de l’original (PDF) le 2008-12-17.
- ^ Beebe, C. William (1906). L’oiseau: sa forme et sa fonction . Henry Holt & Co, New York. Pp. 214 .
- ^ un b c Brooke, M. De L.; Hanley, S.; Laughlin, S. B. (février 1999). “La mise à l’échelle de la taille des yeux avec la masse corporelle chez les oiseaux” . Actes de la Royal Society B . 266 (1417): 405–412. est ce que je: 10.1098 / rspb.1999.0652 . PMC 1689681 .
- ^ Martin, Graham. “Produire l’image” dans Ziegler & Bischof (1993) 5-24
- ^ un b Thomas, Robert J.; Suzuki, M; Saito, s; Tanda, s; Newson, Stuart E.; Frayling, Tim D.; Wallis, Paul D. (2002). “Taille des yeux dans les oiseaux et le timing de la chanson à l’aube” . Actes de la Royal Society B . 269 (1493): 831–837. est ce que je: 10.1098 / rspb.2001.1941 . PMC 1690967 . PMID 11958715 .
- ^ Thomas, Robert (2002). “La régulation de la masse corporelle et les routines chantantes quotidiennes des robins européens” . Comportement animal . 63 (2): 285–295. est ce que je: 10.1006 / anbe.2001.1926 . S2cid 54376020 . Archivé de l’original le 1er janvier 2015 . Récupéré 1er janvier 2015 .
- ^ Hall, Margaret I. (juin 2008). “Les relations anatomiques entre l’œil aviaire, l’orbite et le cycle sclérotique: implications pour déduire les modèles d’activité chez les oiseaux éteints” . Journal of Anatomy . 212 (6): 781–794. est ce que je: 10.1111 / j.1469-7580.2008.00897.x . PMC 2423400 . PMID 18510506 .
- ^ Sivak, Jacob G. (2004). “Par l’objectif clairement: phylogénie et développement” . Investir. Ophthalmol. Vis. SCI . 45 (3): 740–747. est ce que je: 10.1167 / iovs.03-0466 . PMID 14985284 .
- ^ Nalbach Hans-Ortwin; Wolf-Oberhollenzer, Friedericke; Remy Monika. “Exploration de l’image” dans Ziegler & Bischof (1993) 26-28
- ^ Bawa, S.R.; Yashroy, R.C. (1974). “Structure et fonction du vautour pecten” . Acte anatomique . 89 (3): 473–480. est ce que je: 10.1159 / 000144308 . PMID 4428954 . Archivé de l’original le 2015-07-14.
- ^ Bawa, S.R.; Yashroy, R.C. (1972). “Effet de l’adaptation sombre et légère sur la rétine et le pecti de poulet” . Recherche de l’œil expérimental . 13 (1): 92–97. est ce que je: 10.1016 / 0014-4835 (72) 90129-7 . PMID 5060117 . Archivé de l’original le 2014-10-09.
- ^ Hart, NS; Partridge, J.C.; Bennett, A.T.D.; Cuthill, Innes C. (2000). “Pigments visuels, gouttelettes d’huile de cône et milieux oculaires dans quatre espèces de pinson estridid” (PDF) . Journal of Comparative Physiology a . 186 (7–8): 681–694. est ce que je: 10.1007 / s003590000121 . PMID 1116784 . S2cid 19458550 . Archivé de l’original (PDF) le 20 février 2005.
- ^ L’effet des gouttelettes d’huile colorés est de rétrécir et de décalé le pic d’absorption pour chaque pigment. Les pics d’absorption sans les gouttelettes d’huile seraient plus larges et moins atteints, mais ceux-ci ne sont pas illustrés ici.
- ^ un b c d C’est F Goldsmith, Timothy H. (juillet 2006). “Ce que les oiseaux voient” (PDF) . Scientifique américain : 69–75. Archivé de l’original (PDF) le 10 avril 2011.
- ^ Nous avons Areeee, ssess. V VSSS, MP; Thèses; Set, moût; Yanloader, Jnut; LN, Ben, un nombre (1998). “La base moléculaire de la vision des UV chez les oiseaux: caractéristiques spectrales, séquence d’ADNc et localisation rétinienne du pigment visuel sensible aux UV du Budgerigar (Melopsittacus undulatus)” . Journal biochimique . 330 (PT 1): 541–47. deux: 10.1042 / bj3300541 . PMC 1219171 . PMID 9461554 .
- ^ “Hyperuniformité trouvée dans les oiseaux, les mathématiques et la physique – le magazine Quanta” . quamamagazine.org . 12 juillet 2016. Archivé de l’original le 9 avril 2017 . Récupéré 6 mai 2018 .
- ^ un b c Varela, F. J.; Palacios, A. G.; Goldsmith T. M. “Vision des couleurs des oiseaux” Dans Ziegler & Bischof (1993) 77–94
- ^ Bowmaker, J. K.; Martin, G. R. (janvier 1985). “Pigments visuels et gouttelettes d’huile dans le pingouin, Spheniscus Humbolti “. Journal of Comparative Physiology . 156 (1): 71–77. est ce que je: 10.1007 / bf00610668 . S2cid 29312337 .
- ^ Goldsmith, T. H.; Collins, JS; Licht, S (1984). “Les gouttelettes d’huile de cône des rétines aviaires”. Recherche de vision . 24 (11): 1661–1671. est ce que je: 10.1016 / 0042-6989 (84) 90324-9 . PMID 6533991 . S2cid 13730240 .
- ^ Vorobyev, M.; Osorio, D.; Bennett, A. T. D.; Marshall, N. J.; Cuthill, I. C. (3 juillet 1998). “Tétrachromacy, gouttelettes d’huile et couleurs du plumage des oiseaux” (PDF) . Journal of Comparative Physiology a . 183 (5): 621–633. est ce que je: 10.1007 / s003590050286 . PMID 9839454 . S2cid 372159 . Archivé de l’original (PDF) le 25 avril 2012.
- ^ Eaton, Muir D. (août 2005). “La vision humaine ne parvient pas à distinguer le dichromatisme sexuel généralisé parmi les” oiseaux “monochromatiques sexuellement” monochromatiques sexuels . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 102 (31): 10942–10946. Bibcode: 2005pnas..10210942E . est ce que je: 10.1073 / pnas.0501891102 . PMC 1182419 . PMID 16033870 .
- ^ Muheim, Rachel; Phillips, JB; Akesson, S (août 2006). “Les signaux légers polarisés sous-tendent l’étalonnage de la boussole dans les oiseaux de chanteurs migratoires” (PDF) . Science . 313 (5788): 837–839. Bibcode: 2006SCI … 313..837M . est ce que je: 10.1126 / science.1129709 . PMID 16902138 . S2cid 22251614 . Archivé de l’original (PDF) le 2008-12-17.
- ^ Greenwood, Verity J.; Smith, El; Église, SC; Partridge, JC (2003). “Investigation comportementale de la sensibilité à la polarisation dans la caille japonaise ( Coturnix Coturnix japonica ) et le Starling européen ( Starling Vulgaris ) ” . Le Journal of Experimental Biology . 206 (Pour 18): 3201–3210. deux: 10.1242 / ou.00537 . PMID 12909701 .
- ^ Toomey, Matthew B.; Collins, Aaron M.; Frederiksen, Ricard; Cornwall, M. Carter; Timlin, Jerrilyn A.; Corbo, Joseph C. (2015-10-06). “Une palette de caroténoïdes complexe accueille la vision des couleurs aviaire” . Journal of the Royal Society Interface . douzième (111): 20150563. doi: 10.1098 / sif.2015.0563 . ISSN 1742-5689 . PMC 4614492 . PMID 26446559 .
- ^ Odeen, Anders; Håstad, Olle (11 février 2013). “La distribution phylogénétique de la sensibilité ultraviolette chez les oiseaux” . Biologie évolutive du BMC . 13 : 36. doi: 10.1186 / 1471-2148-13-36 . PMC 3637589 . PMID 23394614 .
- ^ Yokoyama, Shozo; Radlwimmer, F. Bernhard; Blow, Nathan S. (2000-06-20). “Les pigments ultraviolets chez les oiseaux ont évolué à partir de pigments violets par un seul changement d’acide aminé” . Actes de l’Académie nationale des sciences . 97 (13): 7366–7371. Bibcode: 2000pnas … 97.7366y . est ce que je: 10.1073 / pnas.97.13.7366 . ISSN 0027-8424 . PMC 16551 . PMID 10861005 .
- ^ Fate, Anders; Håstad, Olle; Alström, par (2011-10-24). “Évolution de la vision ultraviolette dans le plus grand rayonnement aviaire – les passants” . Biologie évolutive du BMC . 11 : 313. doi: 10.1186 / 1471-2148-11-313 . ISSN 1471-2148 . PMC 3225180 . PMID 22024316 .
- ^ Hunt, Sarah; Bennett, Andrew T. D.; Cuthill, Innes C.; Griffiths, Richard (1998-03-22). “Les seins bleus sont des seins ultraviolets” . Actes de la Royal Society of London B: Sciences biologiques . 265 (1395): 451–455. est ce que je: 10.1098 / rspb.1998.0316 . ISSN 0962-8452 . PMC 1688906 .
- ^ Barreira, A. S.; Lagorio, M. G.; Lijtmaer, D. A.; Lougheed, S. C.; Tubaro, P. L. (2012-10-01). “Dichromatisme sexuel fluorescent et ultraviolet dans le parrotlet à ailes bleues”. Journal of Zoology . 288 (2): 135–142. est ce que je: 10.1111 / j.1469-7998.2012.00931.x . ISSN 1469-7998 .
- ^ Andersson, S.; J. Ornborg; M. Andersson (1998). “Dimorphisme sexuel ultraviolet et accouplement assortiment en seins bleus” . Actes de la Royal Society B . 265 (1395): 445–50. est ce que je: 10.1098 / rspb.1998.0315 . PMC 1688915 . Archivé de l’original le 2008-10-11.
- ^ Soravia, étirement; Aguado … Philip; Avilé, Jésus M. (2020). “La fiabilité des étalages achromatiques dépend de l’île dans les pétrels de tempête nocturne” . Ibis . 162 (3): 655–672. est ce que je: 10.1111 / magasin.12772 . HDL: 10261/202994 . ISSN 1474-919X . S2cid 202024467 .
- ^ Brillant, Ashleigh; Waas, Joseph R. (août 2002). “Effets de la pigmentation de la facture et de la réflectance UV lors de l’établissement du territoire dans les merles” (PDF) . Comportement animal . soixante-quatre (2): 207–213. est ce que je: 10.1006 / anbe.2002.3042 . S2cid 51833485 . Archivé de l’original (PDF) le 2011-09-29 . Récupéré 2008-07-21 .
- ^ O’Daniels, Sean T.; Kesler, Dylan C.; Mihail, Jeanne D.; Webb, Elisabeth B.; Werner, Scott J. (2017). “Sensibilité visuelle fonctionnelle aux longueurs d’onde ultraviolets dans le pic pilié (Dryocopus Pilatus), et son influence sur la sélection de substrat de recherche de nourriture” . Physiologie et comportement . 174 : 144–154. est ce que je: 10.1016/j.physbeh.2017.02.041 . PMID 28259805 .
- ^ un b c Viitala, Jussi; Korplmäki, Erkki; Palokangas, Pälvl; Koivula, Minna (1995). “L’attraction des crépussels aux marques de parfum de voles visibles dans la lumière ultraviolette”. Nature . 373 (6513): 425–27. Bibcode: 1995natur.373..425v . est ce que je: 10.1038 / 373425A0 . S2cid 4356193 .
- ^ Osorio, D.; Vorobyev, M. (1996-05-22). “La vision des couleurs comme une adaptation à frugivory chez les primates”. Proc. R. Soc. Lond. B . 263 (1370): 593–599. Bibcode: 1996RSPSB.263..593O . est ce que je: 10.1098 / rspb.1996.0089 . ISSN 0962-8452 . PMID 8677259 . S2cid 21822879 .
- ^ Lim, Gange; Burns, Kevin C. (2021-11-24). “Les propriétés de réflectance des fruits affectent-elles la frugivorie aviaire en Nouvelle-Zélande?” . Journal néo-zélandais de botanique . 60 (3): 319–329. est ce que je: 10.1080 / 0028825x.2021.2001664 . ISSN 0028-825X . S2cid 244683146 .
- ^ Lind, Olle; Mitkus, Mindaugas; Olson, Peter; Kelber, Almut (2013-05-15). “Sensibilité ultraviolette et vision des couleurs dans la recherche de raptor” . Le Journal of Experimental Biology . 216 (10): 1819–1826. est ce que je: 10.1242 / ou.082834 . ISSN 0022-0949 . PMID 23785106 .
- ^
- ^ Stevens, Martin; Cuthill, Innes (2007). “Messages cachés: les signaux ultraviolets sont-ils un canal spécial dans la communication aviaire?” . Bioscience . 57 (6): 501–507. est ce que je: 10.1641 / b570607 .
- ^ Olah, George; Rose, Lajos (2006). “Les déchets métaboliques de l’azote n’influencent pas la préférence de l’eau potable dans les pigeons sauvages” (PDF) . ACADEMY ACCA des sciences hongroises . 52 (4): 401–406.
- ^ De Valois, Russel L; Morgan, Herman; Snodderly, Max D (1974). “Études psychophysiques de la vision du singe – III. Tests de sensibilité à la luminance spatiale des observateurs macaques et humains”. Recherche de vision . 14 (1): 75–81. est ce que je: 10.1016 / 0042-6989 (74) 90118-7 . PMID 4204839 .
- ^ Harning, loup m; Nikolay, P; Orlowski, J; Wagner, Hermann J (2009). “Sensibilité au contraste spatial et acuité de réseau des hiboux” . Journal of Vision . 9 (7): 13. doi: 10.1167 / 9.7.13 . PMID 19761328 .
- ^ Jarvis, John R; Abeyesinghe, Siobhan M; McMahon, Claire E; Wathes, Christopher M (2009). “Mesurer et modéliser la sensibilité au contraste spatial du poulet (Gallus g. Domesticus)” . Recherche de vision . 49 (11): 1448–1454. est ce que je: 10.1016 / j.visres.2009.02.019 . PMID 19272401 . S2cid 15267506 .
- ^ Ghim, Mimi M; Hodos, William (2006). “Sensibilité au contraste spatial des oiseaux” (PDF) . Journal of Comparative Physiology a . 192 (5): 523–534. est ce que je: 10.1007 / S00359-005-0090-5 . HDL: 1903/65 . PMID 16404602 . S2cid 1020137 .
- ^ Uhlrich, Daniel J; Essock, Edward A; Lehmkuhle, Stephen (1981). “Correspondance croisée des fonctions de sensibilité au contraste spatial”. Recherche du cerveau comportemental . 2 (3): 291–299. est ce que je: 10.1016 / 0166-4328 (81) 90013-9 . PMID 6784738 . S2cid 3996329 .
- ^ Tucker, V. A.; Tucker, A. E.; Akers, K.; Enderson, J. H. (décembre 2000). “Les trajectoires de vol incurvées et la vision latérale dans les faucons pérégiens (Falco Peregrinus)”. Le Journal of Experimental Biology . 203 (Pour 24): 3755–3763. deux: 10.1242 / ou.203.24.3755 . ISSN 0022-0949 . PMID 11076739 .
- ^ Tucker, V. A. (décembre 2000). “La fovéa profonde, la vision latérale et les chemins de vol en spirale chez les rapaces”. Le Journal of Experimental Biology . 203 (Pour 24): 3745–3754. deux: 10.1242 / ou.203.24.3745 . ISSN 0022-0949 . PMID 11076738 .
- ^ Sekuler AB, Lee JA, Shettleworth SJ (1996). “Les pigeons ne complètent pas les figures partiellement occluses”. Perception . 25 (9): 1109–1120. est ce que je: 10.1068 / p251109 . PMID 8983050 . S2cid 31085585 .
- ^ Bhagavatula P, Claudanos C, Unstotson M, Srinivasan M (2009). Mandat e (éd.). “Détection des bords dans l’atterrissage des perruches (Melopsittacus undulatus)” . Plos un . 4 (10): E7301. Bibcode: 2009ploso … 4.7301b . est ce que je: 10.1371 / journal.pone.0007301 . PMC 2752810 . PMID 19809500 .
- ^ Mouritsen, Henrik; Gesa Feens, Miriam Liedvogel, Kazuhiro Wada et Erich D. Jarvis (2005). “Zone de cerveau de vision nocturne dans les oiseaux chanteurs migratoires” . PNA . 102 (23): 8339–8344. Bibcode: 2005pnas..102.8339m . est ce que je: 10.1073 / pnas.0409575102 . PMC 1149410 . PMID 15928090 .
{{cite journal}}: CS1 Maint: plusieurs noms: liste des auteurs (lien) - ^ Mouritsen, h.; Feers, G; Liedvogel, m; Body, W (2004). “Les oiseaux migrateurs utilisent des scanneurs de tête pour détecter la direction du champ magnétique de la Terre” (PDF) . Biologie actuelle . 14 (21): 1946-1949. est ce que je: 10.1016 / j.cub.2004.10.025 . HDL: 11858 / 00-001M-0000-0028-7BC5-A . PMID 15530397 . S2cid 11012106 .
- ^ Heyers D, Manns M, Luxch H, Güntürkün O, Mouritsen H (2007). Iwaniuk A (éd.). “Une voie visuelle relie les structures cérébrales actives lors de l’orientation magnétique de la boussole chez les oiseaux migrateurs” . Plos un . 2 (9): E937. Bibcode: 2007ploso … 2..937h . est ce que je: 10.1371 / journal.pone.0000937 . PMC 1976598 . PMID 17895978 .
- ^ Shanor, Karen; Kanwal, Jagmeet (2009). Les chauves-souris chantent, les souris rires: révéler la vie secrète des animaux . Livres d’icônes. p. 25. ISBN 978-1-84831-071-1 . (Malgré son titre, cela est écrit par des scientifiques professionnels avec de nombreuses références)
- ^ Heyers, Dominik; Manns, m; Luksch, H; Güntürkün, O; Mouritsen, H; Iwaniuk, Andrew (septembre 2007). Iwaniuk, Andrew (éd.). “Une voie visuelle relie les structures cérébrales actives lors de l’orientation magnétique de la boussole chez les oiseaux migrateurs” . Plos un . 2 (9): E937. Bibcode: 2007ploso … 2..937h . est ce que je: 10.1371 / journal.pone.0000937 . PMC 1976598 . PMID 17895978 .
- ^ Snyder, Allan W.; Miller, William H. (1978). “Système de téléobjectif des yeux fauconiformes”. Nature . 275 (5676): 127–129. Bibcode: 1978natur.275..127S . est ce que je: 10.1038 / 275127A0 . PMID 692679 . S2cid 4204025 .
- ^ Poitier, Simone; Bonadonna, Francesco; Kelber, Almut; Durée, Olivier (2016). “Acuité visuelle dans un Raptor opportuniste, le Chimango Caracara ( Cadre milsego ) “. Physiologie et comportement . 157 : 125–128. est ce que je: 10.1016/j.physbeh.2016.01.032 . PMID 26821187 . S2cid 36207899 .
- ^ Gaffney, Matthew F; Hodos, William (2003). “L’acuité visuelle et l’état de réfraction du crécerel américain ( Falco Sparverius ) ” . Recherche de vision . 43 (19): 2053-2059. est ce que je: 10.1016 / s0042-6989 (03) 00304-3 . PMID 12842158 . S2cid 17008291 .
- ^ un b Reymond, Liz (1985). “Acuité visuelle spatiale de l’aigle Eagle audacieux : une étude comportementale, optique et anatomique “. Recherche de vision . 25 (10): 1477–1491. est ce que je: 10.1016 / 0042-6989 (85) 90226-3 . PMID 4090282 . S2cid 20680520 .
- ^ un b Reymond, Liz (1987). “Acuité visuelle spatiale du faucon, Falco Berigora : Une étude comportementale, optique et anatomique “. Recherche de vision . 27 (10): 1859–1874. est ce que je: 10.1016 / 0042-6989 (87) 90114-3 . PMID 3445475 . S2cid 1526462 .
- ^ Fischer, Anna Barbara (1969). “Examens de laboratoire et observations ouvertes sur la vue sous le comportement des vautours du vieux monde”. Département des annuaires zoologiques pour la systématique (en allemand) (96): 81–132.
- ^ Martin, Graham (1986). “Les lacunes de l’œil d’un aigle”. Nature . 319 (6052): 357. doi: 10.1038 / 319357A0 . PMID 3945316 . S2cid 4233018 .
- ^ un b c Diagramme schématique de la rétine de l’œil droit, sans base basé sur Sturkie (1998) 6
- ^ Bawa, S.R.; Yashroy, R.C. (1972). “Distribution et fonction de l’enzyme de la rétine Vulture Retina” . Neurobiologie . 2 (4): 162–168. PMID 4218304 . Archivé de l’original le 2015-11-26.
- ^ Pote, S.; Bonadonna, F.; Martin, G. R.; Isard, P.F.; Dulaurent, T.; Mentek, M.; Durée, O. (2018). “Configuration visuelle de deux espèces de Falconidae avec différentes écologies de nourriture”. Ibis . 160 (1): 54–61. est ce que je: 10.1111 / magasin.12528 .
- ^ Sillman, A. J.; Bolnick, D. A.; Haynes, L. W.; Walter, A. E.; Loew, Ellis R. (1981). “Microposctrophotométrie des photorécepteurs des oiseaux palaegnatous – l’émeu et le tinamou”. Journal of Comparative Physiology a . 144 (3): 271–276. est ce que je: 10.1007 / bf00612558 . S2cid 7182768 .
- ^ un b c d Burton (1985) 44–48
- ^ Fait, Seligh; Terence, MH (1940). “La sensibilité de la chouette nocturne à longues oreilles dans le spectre” . Journal of General Physiology . 23 (6): 709–717. est ce que je: 10.1085 / jgp.23.6.709 . PMC 2237955 . PMID 19873186 .
- ^ Cleere, Nigel; Nurney, David (1998). Nightjars: A Guide to the Nightjars, Frogmouths, Potoos, Oilbird et Owlet-Nightjars du monde . Pica / Christopher Helm. p. 7. ISBN 978-1-873403-48-8 . OCLC 39882046 .
- ^ Fullard, J. H.; Barclay; Thomas (1993). “Écholocation dans les swifts atiu volants ( Aerodramus Sawtelli ) ” (PDF) . Biotropica . 25 (3): 334–339. est ce que je: 10 2307/2388791 . Jstor 2388791 . Archivé de l’original (PDF) le 17 décembre 2008 . Récupéré 12 juillet 2008 .
- ^ Konishi, M.; Knudsen, EI (avril 1979). “The Oilbird: l’audition et l’écholocation”. Science . 204 (4391): 425–427. Bibcode: 1979SCI … 204..425K . est ce que je: 10.1126 / science.441731 . PMID 441731 .
- ^ Lythgoe, J. N. (1979). L’écologie de la vision . Oxford: Clarendon Press. pp. 180–183. ISBN 978-0-19-854529-3 . OCLC 4804801 .
- ^ Vol A; Schechtman E&G Katzir (1991). “Capture de proies submergées par de petits aigrettes, Egretta Garzetta Garzetta : profondeur de frappe, angle de frappe et problème de la réfraction légère ” (PDF) . Anim. Se comporter . 42 (3): 341–346. est ce que je: 10.1016 / s0003-3472 (05) 80033-8 . S2cid 37797506 . Archivé (PDF) de l’original le 2011-06-04.
- ^ Katzir, Gadi; Lot, Arnon; Intrator, Nathan (1989). “La proie sous-marine stationnaire manquée à Reef Herons, Egretta Gularis: position de tête et réfraction légère au moment de la frappe” (PDF) . Journal of Comparative Physiology a . 165 (4): 573–576. est ce que je: 10.1007 / bf00611243 . S2cid 6191096 . Archivé de l’original (PDF) le 2016-03-04.
- ^ Hayes, Brian; Martin, Graham R.; Brooke, Michael de L. (1991). “Nouvelle zone servant une vision binoculaire dans les rétines des oiseaux de mer procellariiformes”. Cerveau, comportement et évolution . 37 (2): 79–84. est ce que je: 10.1159 / 000114348 . PMID 2054586 .
- ^ un b Martin, Graham R.; Brooke, M. de L. (1991). “L’œil d’un oiseau de mer procellariiforme, le manx cachette, Puffinus Puffinus : Champs visuels et structure optique “. Cerveau, comportement et évolution . 37 (2): 65–78. est ce que je: 10.1159 / 000114347 . PMID 2054585 .
Les références [ modifier ]]
- Burton, Robert (1985). Comportement des oiseaux . Londres: Granada Publishing. ISBN 978-0-246-12440-1 .
- Sinclair, Sandra (1985). Comment les animaux voient: d’autres visions de notre monde . Beckenham, Kent: Croom Helm. ISBN 978-0-7099-3336-6 .
- Sturkie, P. D. (1998). Physiologie aviaire de Sturkie . 5e édition. Academic Press, San Diego. ISBN 978-0-12-747605-6 . OCLC 162128712 .
- Ziegler, Harris Philip; Bischof, Hans-Joachim, éd. (1993). Vision, cerveau et comportement chez les oiseaux: une revue comparative . Avec presse. ISBN 978-0-262-24036-9 . OCLC 27727176 .
Liens externes [ modifier ]]
Recent Comments