DNA-Glycosylase – Wikipedia
Enzyme, die an der Reparatur der Basenexzision beteiligt sind
DNA-Glycosylasen sind eine Familie von Enzymen, die an der Reparatur von Basenexzisionen beteiligt sind und unter der EG-Nummer EC 3.2.2 klassifiziert sind. Die Reparatur der Basenexzision ist der Mechanismus, durch den beschädigte Basen in der DNA entfernt und ersetzt werden. DNA-Glycosylasen katalysieren den ersten Schritt dieses Prozesses. Sie entfernen die beschädigte stickstoffhaltige Base, während das Zucker-Phosphat-Rückgrat intakt bleibt, wodurch eine Apurin / Apyrimidin-Stelle entsteht, die üblicherweise als AP-Stelle bezeichnet wird. Dies wird erreicht, indem die beschädigte Base aus der Doppelhelix herausgeklappt und anschließend die N-glycosidische Bindung gespalten wird.[1]
Glycosylasen wurden erstmals in Bakterien entdeckt und sind seitdem in allen Lebensbereichen zu finden. Zusätzlich zu ihrer Rolle bei der Reparatur der Basenexzision waren DNA-Glycosylaseenzyme an der Unterdrückung der Gen-Stummschaltung in beteiligt A. thaliana, N. tabacum und andere Pflanzen durch aktive Demethylierung. 5-Methylcytosinreste werden herausgeschnitten und durch nicht methylierte Cytosine ersetzt, die den Zugang zur Chromatinstruktur der Enzyme und Proteine ermöglichen, die für die Transkription und anschließende Translation erforderlich sind.[2][3]
Monofunktionelle vs. bifunktionelle Glycosylasen[edit]
Es gibt zwei Hauptklassen von Glycosylasen: monofunktionelle und bifunktionelle. Monofunktionelle Glycosylasen haben nur Glycosylaseaktivität, während bifunktionelle Glycosylasen auch AP-Lyaseaktivität besitzen, die es ihnen ermöglicht, die Phosphodiesterbindung der DNA zu durchtrennen, wodurch ein Einzelstrangbruch entsteht, ohne dass eine AP-Endonuklease erforderlich ist. Die β-Eliminierung einer AP-Stelle durch eine Glycosylase-Lyase ergibt einen 3 ‘α, β-ungesättigten Aldehyd neben einem 5’-Phosphat, der sich vom AP-Endonuklease-Spaltprodukt unterscheidet.[4] Einige Glycosylase-Lyasen können ferner eine δ-Eliminierung durchführen, die den 3′-Aldehyd in ein 3′-Phosphat umwandelt.
Biochemischer Mechanismus[edit]
Die erste Kristallstruktur einer DNA-Glycosylase wurde für E. coli Nth erhalten.[5] Diese Struktur zeigte, dass das Enzym die beschädigte Base aus der Doppelhelix in eine Tasche des aktiven Zentrums wirft, um sie herauszuschneiden. Es wurde seitdem festgestellt, dass andere Glycosylasen dem gleichen allgemeinen Paradigma folgen, einschließlich des unten abgebildeten menschlichen UNG. Um die N-glycosidische Bindung zu spalten, verwenden monofunktionelle Glycosylasen ein aktiviertes Wassermolekül, um Kohlenstoff 1 des Substrats anzugreifen. Bifunktionelle Glycosylasen verwenden stattdessen einen Aminrest als Nucleophil, um denselben Kohlenstoff über ein Schiff-Base-Intermediat anzugreifen.
Arten von Glycosylasen[edit]
Kristallstrukturen vieler Glycosylasen wurden gelöst. Aufgrund der strukturellen Ähnlichkeit werden Glycosylasen in vier Superfamilien eingeteilt. Das UDG und AAG Familien enthalten kleine, kompakte Glycosylasen, während die MutM / Fpg und HhH-GPD Familien umfassen größere Enzyme mit mehreren Domänen.[4]
Eine Vielzahl von Glycosylasen hat sich entwickelt, um verschiedene beschädigte Basen zu erkennen. Die folgende Tabelle fasst die Eigenschaften bekannter Glycosylasen in häufig untersuchten Modellorganismen zusammen.
| E coli | B. cereus | Hefe (S. cerevisiae) | Mensch | Art | Substrate |
|---|---|---|---|---|---|
| AlkA | AlkE | Mag1 | MPG (N-Methylpurin-DNA-Glycosylase) | monofunktional | 3-meA (3-Alkyladenin), Hypoxanthin |
| UDG | Ung1 | UNG | monofunktional | Uracil | |
| Fpg | Ogg1 | hOGG1 | bifunktional | 8-OxoG (8-Oxoguanin), FapyG | |
| Nth | Ntg1 | hNTH1 | bifunktional | Tg, hoU, hoC, Harnstoff, FapyG (2,6-Diamino-4-hydroxy-5-formamidopyrimidin) | |
| Ntg2 | |||||
| Nei | Nicht anwesend | hNEIL1 | bifunktional | Tg, hoU, hoC, Harnstoff, FapyG, FapyA (4,6-Diamino-5-formamidopyrimidin) | |
| hNEIL2 | AP Seite, hoU | ||||
| hNEIL3 | Unbekannt | ||||
| MutY | Nicht anwesend | hMYH | monofunktional | A: 8-OxoG | |
| Nicht anwesend | Nicht anwesend | hSMUG1 | monofunktional | U, hoU (5-Hydroxyuracil), hmU (5-Hydroxymethyluracil), fU (5-Formyluracil) | |
| Nicht anwesend | Nicht anwesend | TDG | monofunktional | T: G Fehlpaarung | |
| Nicht anwesend | Nicht anwesend | MBD4 | monofunktional | T: G Fehlpaarung | |
| AlkC | AlkC | Nicht anwesend | Nicht anwesend | monofunktional | Alkylpurin |
| AlkD | AlkD | Nicht anwesend | Nicht anwesend | monofunktional | Alkylpurin |
DNA-Glycosylasen können basierend auf ihren Substraten in die folgenden Kategorien eingeteilt werden:
Uracil-DNA-Glycosylasen[edit]

In der Molekularbiologie ist die Proteinfamilie Uracil-DNA-Glycosylase (UDG) ein Enzym, das Mutationen in der DNA rückgängig macht. Die häufigste Mutation ist die Desaminierung von Cytosin zu Uracil. UDG repariert diese Mutationen. UDG ist entscheidend für die DNA-Reparatur. Ohne UDG können diese Mutationen zu Krebs führen.[8]
Dieser Eintrag repräsentiert verschiedene Uracil-DNA-Glycosylasen und verwandte DNA-Glycosylasen (EG), wie Uracil-DNA-Glycosylase,[9]thermophile Uracil-DNA-Glycosylase,[10] G: T / U-Fehlpaarungs-spezifische DNA-Glycosylase (Mug),[11] und einzelsträngige selektive monofunktionelle Uracil-DNA-Glycosylase (SMUG1).[12]
Uracil-DNA-Glycosylasen entfernen Uracil aus der DNA, die entweder durch spontane Desaminierung von Cytosin oder durch fehlerhafte Inkorporation von dU gegenüber dA während der DNA-Replikation entstehen kann. Das prototypische Mitglied dieser Familie ist E. coli UDG, das zu den ersten entdeckten Glycosylasen gehörte. In Säugetierzellen wurden vier verschiedene Uracil-DNA-Glycosylase-Aktivitäten identifiziert, darunter UNG, SMUG1, TDG und MBD4. Sie variieren in der Substratspezifität und subzellulären Lokalisation. SMUG1 bevorzugt einzelsträngige DNA als Substrat, entfernt aber auch U aus doppelsträngiger DNA. Zusätzlich zu unmodifiziertem Uracil kann SMUG1 5-Hydroxyuracil, 5-Hydroxymethyluracil und 5-Formyluracil herausschneiden, die am Ring C5 eine oxidierte Gruppe tragen.[13] TDG und MBD4 sind streng spezifisch für doppelsträngige DNA. TDG kann Thyminglykol entfernen, wenn es gegenüber Guanin vorhanden ist, sowie Derivate von U mit Modifikationen an Kohlenstoff 5. Aktuelle Erkenntnisse legen nahe, dass TDG und SMUG1 in menschlichen Zellen die Hauptenzyme sind, die für die Reparatur der durch: verursachten U: G-Fehlpaarungen verantwortlich sind spontane Cytosin-Desaminierung, während Uracil, das durch dU-Fehlinkorporation in der DNA entsteht, hauptsächlich von UNG behandelt wird. Es wird angenommen, dass MBD4 T: G-Fehlpaarungen korrigiert, die durch Desaminierung von 5-Methylcytosin zu Thymin an CpG-Stellen entstehen.[14] MBD4-Mutantenmäuse entwickeln sich normal und zeigen keine erhöhte Krebsanfälligkeit oder ein verringertes Überleben. Sie erwerben jedoch mehr CT-Mutationen an CpG-Sequenzen in Epithelzellen des Dünndarms.[15]
Die Struktur von menschlichem UNG im Komplex mit DNA zeigte, dass es wie andere Glycosylasen das Zielnukleotid aus der Doppelhelix in die Tasche des aktiven Zentrums kippt.[16] UDG erfährt einen Konformationswechsel von einem “offenen” ungebundenen Zustand zu einem “geschlossenen” DNA-gebundenen Zustand.[17]
Geschichte[edit]
Lindahl war der erste, der die Reparatur von Uracil in der DNA beobachtete. UDG wurde aus gereinigt Escherichia coliund dies hydrolysierte die N-glycosidische Bindung, die die Base mit dem Desoxyribose-Zucker des DNA-Rückgrats verbindet.[8]
Funktion[edit]
Die Funktion von UDG besteht darin, Mutationen in der DNA zu entfernen, insbesondere Uracil zu entfernen.
Struktur[edit]
Diese Proteine haben eine 3-Schicht-Alpha / Beta / Alpha-Struktur. Die Polypeptidtopologie von UDG ist die eines klassischen Alpha / Beta-Proteins. Die Struktur besteht hauptsächlich aus einem zentralen, viersträngigen, vollständig parallelen Beta-Blatt, das auf beiden Seiten von insgesamt acht Alpha-Helices umgeben ist, und wird als paralleles doppelt gewickeltes Beta-Blatt bezeichnet.[9]
Mechanismus[edit]
Uracil-DNA-Glycosylasen sind DNA-Reparaturenzyme, die Uracilreste aus der DNA herausschneiden, indem sie die N-glycosydische Bindung spalten und den Reparaturweg für die Basenexzision initiieren. Uracil in der DNA kann entweder durch Desaminierung von Cytosin unter Bildung mutagener U: G-Fehlpaare oder durch Einbau von dUMP durch DNA-Polymerase unter Bildung von U: A-Paaren entstehen.[18] Diese aberranten Uracilreste sind genotoxisch.[19]
Lokalisierung[edit]
In eukaryotischen Zellen findet sich die UNG-Aktivität sowohl im Zellkern als auch in den Mitochondrien. Humanes UNG1-Protein wird sowohl zu den Mitochondrien als auch zum Kern transportiert.[20]
Erhaltung[edit]
Die Sequenz der Uracil-DNA-Glycosylase ist äußerst gut konserviert[21] in Bakterien und Eukaryoten sowie in Herpesviren. Weiter entfernte Uracil-DNA-Glycosylasen finden sich auch in Pockenviren.[22]
Die N-terminalen 77 Aminosäuren von UNG1 scheinen für die Lokalisierung der Mitochondrien erforderlich zu sein, aber das Vorhandensein eines mitochondrialen Transitpeptids wurde nicht direkt nachgewiesen. Die am meisten N-terminale konservierte Region enthält einen Asparaginsäurerest, der basierend auf Röntgenstrukturen vorgeschlagen wurde[23] als allgemeine Basis im katalytischen Mechanismus wirken.
Es gibt zwei UDG-Familien mit den Namen Familie 1 und Familie 2. Familie 1 ist in ssDNA und dsDNA gegen Uracil aktiv. Familie 2 entfernt Uracil aus Fehlpaarungen mit Guanin.[8]
Glycosylasen oxidierter Basen[edit]
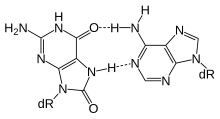
Eine Vielzahl von Glycosylasen hat sich entwickelt, um oxidierte Basen zu erkennen, die üblicherweise durch reaktive Sauerstoffspezies gebildet werden, die während des Zellstoffwechsels erzeugt werden. Die am häufigsten an Guaninresten gebildeten Läsionen sind 2,6-Diamino-4-hydroxy-5-formamidopyrimidin (FapyG) und 8-Oxoguanin. Aufgrund der Fehlpaarung mit Adenin während der Replikation ist 8-OxoG stark mutagen, was zu G-zu-T-Transversionen führt. Die Reparatur dieser Läsion wird durch die bifunktionelle DNA-Glycosylase OGG1 initiiert, die 8-OxoG in Kombination mit C. hOGG1 erkennt, eine bifunktionelle Glycosylase, die zur Familie der Helix-Haarnadel-Helix (HhH) gehört. MYH erkennt mit 8-OxoG falsch gepaartes Adenin, entfernt jedoch das A und lässt das 8-OxoG intakt. OGG1-Knockout-Mäuse zeigen keine erhöhte Tumorinzidenz, akkumulieren jedoch mit zunehmendem Alter 8-OxoG in der Leber.[24] Ein ähnlicher Phänotyp wird bei der Inaktivierung von MYH beobachtet, aber die gleichzeitige Inaktivierung von MYH und OGG1 führt zu einer 8-OxoG-Akkumulation in mehreren Geweben, einschließlich Lunge und Dünndarm.[25] Beim Menschen sind Mutationen in MYH mit einem erhöhten Risiko für die Entwicklung von Dickdarmpolypen und Dickdarmkrebs verbunden. Zusätzlich zu OGG1 und MYH enthalten menschliche Zellen drei zusätzliche DNA-Glycosylasen, NEIL1, NEIL2 und NEIL3. Diese sind homolog zu bakteriellem Nei und ihr Vorhandensein erklärt wahrscheinlich die milden Phänotypen der OGG1- und MYH-Knockout-Mäuse.
Glycosylasen alkylierter Basen[edit]
Diese Gruppe umfasst E. coli AlkA und verwandte Proteine in höheren Eukaryoten. Diese Glycosylasen sind monofunktionell und erkennen methylierte Basen wie 3-Methyladenin.
AlkA[edit]
AlkA bezieht sich auf 3-Methyladenin-DNA-Glycosylase II.[26]
Pathologie[edit]
Epigenetische Mängel bei Krebserkrankungen[edit]
Epigenetische Veränderungen (Epimutationen) in DNA-Glycosylase-Genen wurden erst kürzlich bei einigen Krebsarten untersucht, verglichen mit den zahlreichen früheren Studien zu Epimutationen in Genen, die auf anderen DNA-Reparaturwegen wirken (wie MLH1 bei der Fehlpaarungsreparatur und MGMT bei direkter Umkehrung). .[citation needed] Zwei Beispiele für Epimutationen in DNA-Glycosylase-Genen, die bei Krebs auftreten, sind nachstehend zusammengefasst.
MBD4[edit]

MBD4 (Methyl-CpG-Bindungsdomänenprotein 4) ist eine Glycosylase, die in einem ersten Schritt der Basenentfernungsreparatur eingesetzt wird. MBD4-Protein bindet bevorzugt an vollständig methylierte CpG-Stellen.[28] Diese veränderten Basen entstehen durch die häufige Hydrolyse von Cytosin zu Uracil (siehe Bild) und die Hydrolyse von 5-Methylcytosin zu Thymin, wobei G: U- und G: T-Basenpaare entstehen.[29] Wenn die falschen Uracils oder Thymine in diesen Basenpaaren vor der DNA-Replikation nicht entfernt werden, verursachen sie Übergangsmutationen. MBD4 katalysiert spezifisch die Entfernung von T und U, die mit Guanin (G) gepaart sind, innerhalb von CpG-Stellen.[30] Dies ist eine wichtige Reparaturfunktion, da etwa 1/3 aller intragenen Mutationen einzelner Basenpaare bei Krebserkrankungen beim Menschen in CpG-Dinukleotiden auftreten und das Ergebnis von Übergängen von G: C zu A: T sind.[30][31] Diese Übergänge umfassen die häufigsten Mutationen bei menschlichem Krebs. Beispielsweise sind fast 50% der somatischen Mutationen des Tumorsuppressor-Gens p53 bei Darmkrebs G: C- zu A: T-Übergänge innerhalb von CpG-Stellen.[30] Eine Abnahme der Expression von MBD4 könnte daher zu einer Zunahme krebserzeugender Mutationen führen.
Die MBD4-Expression ist in fast allen kolorektalen Neoplasmen aufgrund der Methylierung der Promotorregion von MBD4 reduziert.[32] Auch MBD4 ist aufgrund einer Mutation bei etwa 4% der Darmkrebserkrankungen mangelhaft.[33]
Ein Großteil der histologisch normalen Felder, die das neoplastische Wachstum (Adenome und Dickdarmkrebs) im Dickdarm umgeben, zeigt im Vergleich zu histologisch normalem Gewebe von Personen, die nie ein Kolon-Neoplasma hatten, auch eine verringerte MBD4-mRNA-Expression (ein Felddefekt).[32] Dieser Befund legt nahe, dass die epigenetische Stummschaltung von MBD4 ein früher Schritt in der kolorektalen Karzinogenese ist.
In einer untersuchten chinesischen Population war der MBD4-Glu346Lys-Polymorphismus mit einem um etwa 50% verringerten Risiko für Gebärmutterhalskrebs verbunden, was darauf hindeutet, dass Veränderungen von MBD4 bei diesem Krebs wichtig sind.[34]
NEIL1[edit]
Nei-like (NEIL) 1 ist eine DNA-Glycosylase der Nei-Familie (die auch NEIL2 und NEIL3 enthält).[35] NEIL1 ist ein Bestandteil des DNA-Replikationskomplexes, der zur Überwachung oxidierter Basen vor der Replikation benötigt wird, und scheint als „Cowcatcher“ zu fungieren, um die Replikation zu verlangsamen, bis NEIL1 als Glycosylase fungieren und die oxidativ beschädigte Base entfernen kann.[35]
Das NEIL1-Protein erkennt (Ziele) und entfernt bestimmte oxidativ geschädigte Basen und schneidet dann die abasische Stelle über die β-, δ-Eliminierung ein, wobei 3′- und 5′-Phosphatenden verbleiben. NEIL1 erkennt oxidierte Pyrimidine, Formamidopyrimidine, an der Methylgruppe oxidierte Thyminreste und beide Stereoisomere von Thyminglykol.[36] Die besten Substrate für menschliches NEIL1 scheinen die Hydantoinläsionen Guanidinohydantoin und Spiroiminodihydantoin zu sein, die weitere Oxidationsprodukte von 8-OxoG sind. NEIL1 ist auch in der Lage, Läsionen von einzelsträngiger DNA sowie von Blasen- und Gabel-DNA-Strukturen zu entfernen. Ein Mangel an NEIL1 führt zu einer erhöhten Mutagenese an der Stelle eines 8-Oxo-Gua: C-Paares, wobei die meisten Mutationen G: C- zu T: A-Transversionen sind.[37]
Eine Studie aus dem Jahr 2004 ergab, dass 46% der primären Magenkrebserkrankungen eine verringerte Expression von NEIL1-mRNA aufwiesen, obwohl der Mechanismus der Reduktion nicht bekannt war.[38] Diese Studie fand auch heraus, dass 4% der Magenkrebserkrankungen Mutationen im NEIL1-Gen aufwiesen. Die Autoren schlugen vor, dass eine geringe NEIL1-Aktivität aufgrund einer verringerten Expression und / oder Mutation des NEIL1-Gens häufig an der Magenkarzinogenese beteiligt war.
Ein Screening von 145 DNA-Reparaturgenen auf aberrante Promotormethylierung wurde an Kopf-Hals-Plattenepithelkarzinom-Geweben (HNSCC) von 20 Patienten und an Kopf-Hals-Schleimhautproben von 5 Nicht-Krebspatienten durchgeführt.[39] Dieses Screening zeigte, dass das NEIL1-Gen die Hypermethylierung wesentlich erhöht hatte, und von den 145 bewerteten DNA-Reparaturgenen hatte NEIL1 die signifikant unterschiedliche Häufigkeit der Methylierung. Darüber hinaus entsprach die Hypermethylierung einer Abnahme der NEIL1-mRNA-Expression. Weitere Arbeiten mit 135 Tumoren und 38 normalen Geweben zeigten auch, dass 71% der HNSCC-Gewebeproben eine erhöhte Methylierung des NEIL1-Promotors aufwiesen.[39]
Wenn 8 DNA-Reparaturgene in nicht-kleinzelligen Lungenkrebstumoren (NSCLC) bewertet wurden, waren 42% in der NEIL1-Promotorregion hypermethyliert.[40] Dies war die häufigste DNA-Reparaturanomalie, die unter den 8 getesteten DNA-Reparaturgenen gefunden wurde. NEIL1 war auch eines von sechs DNA-Reparaturgenen, bei denen festgestellt wurde, dass sie in ihren Promotorregionen bei Darmkrebs hypermethyliert sind.[41]
Verweise[edit]
- ^ Lindahl, T. (1986). “DNA-Glycosylasen bei der DNA-Reparatur”. Mechanismen der DNA-Beschädigung und Reparatur. 38: 335–340. doi:10.1007 / 978-1-4615-9462-8_36. ISBN 978-1-4615-9464-2. PMID 3527146.
- ^ Aguis, F.; Kapoor, A; Zhu, JK (2006). Rolle der Arabidopsis-DNA-Glycosylase / Lyase ROS1 bei der aktiven DNA-Demethylierung. Proc. Natl. Acad. Sci. Vereinigte Staaten von Amerika. 103 (31): 11796–11801. Bibcode:2006PNAS..10311796A. doi:10.1073 / pnas.0603563103. PMC 1544249. PMID 16864782.
- ^ Choi, CS.; Sano, H. (2007). Identifizierung von Tabakgenen, die für Proteine kodieren, die eine Entfernungsaktivität von 5-Methylcytosinen aus intakter Tabak-DNA besitzen. Pflanzenbiotechnologie. 24 (3): 339–344. doi:10.5511 / plantbiotechnology.24.339.
- ^ ein b Fromme JC, Banerjee A, Verdine GL (Februar 2004). “Erkennung und Katalyse von DNA-Glycosylase”. Aktuelle Meinung in der Strukturbiologie. 14 (1): 43–9. doi:10.1016 / j.sbi.2004.01.003. PMID 15102448.
- ^ Kuo CF, McRee DE, Fisher CL, O’Handley SF, Cunningham RP, Tainer JA (Oktober 1992). “Atomstruktur der DNA-Reparatur [4Fe-4S] Enzym Endonuklease III “. Wissenschaft. 258 (5081): 434–40. Bibcode:1992Sci … 258..434K. doi:10.1126 / science.1411536. PMID 1411536.
- ^ Ide H, Kotera M (April 2004). “Humane DNA-Glycosylasen, die an der Reparatur oxidativ geschädigter DNA beteiligt sind”. Biol. Pharm. Stier. 27 (4): 480–5. doi:10.1248 / bpb.27.480. PMID 15056851.
- ^ Alseth I., Osman F., Korvald H. et al. (2005). “Biochemische Charakterisierung und Wechselwirkungen des DNA-Reparaturweges der Mag1-vermittelten Basenexzisionsreparatur in Schizosaccharomyces pombe”. Nucleic Acids Res. 33 (3): 1123–31. doi:10.1093 / nar / gki259. PMC 549418. PMID 15722486.
- ^ ein b c Pearl LH (2000). “Struktur und Funktion in der Uracil-DNA-Glycosylase-Superfamilie”. Mutat Res. 460 (3–4): 165–81. doi:10.1016 / S0921-8777 (00) 00025-2. PMID 10946227.
- ^ ein b Mol CD, Arvai AS, Slupphaug G., Kavli B., Alseth I., Krokan HE, Tainer JA (März 1995). “Kristallstruktur und Mutationsanalyse der menschlichen Uracil-DNA-Glycosylase: strukturelle Grundlage für Spezifität und Katalyse”. Zelle. 80 (6): 869–78. doi:10.1016 / 0092-8674 (95) 90290-2. PMID 7697717. S2CID 14851787.
- ^ Sandigursky M, Franklin WA (Mai 1999). “Thermostabile Uracil-DNA-Glycosylase aus Thermotoga maritima, Mitglied einer neuen Klasse von DNA-Reparaturenzymen”. Curr. Biol. 9 (10): 531–4. doi:10.1016 / S0960-9822 (99) 80237-1. PMID 10339434. S2CID 32822653.
- ^ Barrett TE, Savva R., Panayotou G., Barlow T., Brown T., Jiricny J., Pearl LH (Januar 1998). “Kristallstruktur einer G: T / U-Fehlpaarungs-spezifischen DNA-Glycosylase: Fehlpaarungserkennung durch komplementäre Strangwechselwirkungen”. Zelle. 92 (1): 117–29. doi:10.1016 / S0092-8674 (00) 80904-6. PMID 9489705. S2CID 9136303.
- ^ Buckley B, Ehrenfeld E (Oktober 1987). “Der cap-bindende Proteinkomplex in nicht infizierten und Poliovirus-infizierten HeLa-Zellen”. J. Biol. Chem. 262 (28): 13599–606. PMID 2820976.
- ^ Matsubara M., Tanaka T., Terato H., Ohmae E., Izumi S., Katayanagi K., Ide H. (2004). “Mutationsanalyse der Schadenserkennung und des katalytischen Mechanismus der menschlichen SMUG1-DNA-Glycosylase”. Nucleic Acids Res. 32 (17): 5291–5302. doi:10.1093 / nar / gkh859. PMC 521670. PMID 15466595.
- ^ Wu P, Qiu C, Sohail A, Zhang X, Bhagwat, AS, Xiaodong C. (2003). Fehlpaarungsreparatur in methylierter DNA. STRUKTUR UND AKTIVITÄT DER MISMATCH-SPEZIFISCHEN THYMIN-GLYCOSYLASE-DOMÄNE DES METHYL-CpG-BINDENDEN PROTEINS MBD4. 5285-5291.
- ^ Wong E; Yang K; Kuraguchi M; Werling U; Avdievich E; Fan K; Fazzari M; Jin B; Brown MC; et al. (1995). “Die Inaktivierung von Mbd4 erhöht die C → T-Übergangsmutationen und fördert die Bildung von Magen-Darm-Tumoren.”. PNAS. 99 (23): 14937–14942. doi:10.1073 / pnas.232579299. PMC 137523. PMID 12417741.
- ^ Mol CD, Arvai AS, Slupphaug G., Kavli B., Alseth I., Krokan HE, Tainer JA (1995). “Kristallstruktur und Mutationsanalyse der menschlichen Uracil-DNA-Glycosylase”. Zelle. 80 (6): 869–878. doi:10.1016 / 0092-8674 (95) 90290-2. PMID 7697717. S2CID 14851787.
- ^ Slupphaug G, Mol CD, Kavli B, Arvai AS, Krokan HE, Tainer JA. (1996). Ein Nucleotid-Flip-Mechanismus aus der Struktur der an DNA gebundenen menschlichen Uracil-DNA-Glycosylase. 384: 87 & ndash; 92.
- ^ Kavli B., Otterlei M., Slupphaug G., Krokan HE (April 2007). “Uracil in DNA – allgemeines Mutagen, aber normales Zwischenprodukt bei erworbener Immunität”. DNA-Reparatur (Amst.). 6 (4): 505–16. doi:10.1016 / j.dnarep.2006.10.014. PMID 17116429.
- ^ Hagen L; Peña-Diaz J; Kavli B; Otterlei M; Slupphaug G; Krokan HE (August 2006). “Genomisches Uracil und menschliche Krankheit”. Exp. Cell Res. 312 (14): 2666–72. doi:10.1016 / j.yexcr.2006.06.015. PMID 16860315.
- ^ Slupphaug G., Markussen FH, Olsen LC, Aasland R., Aarsaether N., Bakke O., Krokan HE, Helland DE (Juni 1993). “Nukleare und mitochondriale Formen der menschlichen Uracil-DNA-Glycosylase werden von demselben Gen kodiert.”. Nucleic Acids Res. 21 (11): 2579–84. doi:10.1093 / nar / 21.11.2579. PMC 309584. PMID 8332455.
- ^ Olsen LC, Aasland R., Wittwer CU, Krokan HE, Helland DE (Oktober 1989). “Molekulare Klonierung von menschlicher Uracil-DNA-Glycosylase, einem hochkonservierten DNA-Reparaturenzym”. EMBO J.. 8 (10): 3121–5. doi:10.1002 / j.1460-2075.1989.tb08464.x. PMC 401392. PMID 2555154.
- ^ Upton C., Stuart DT, McFadden G. (Mai 1993). Identifizierung eines Pockenvirus-Gens, das eine Uracil-DNA-Glycosylase codiert. Proc. Natl. Acad. Sci. Vereinigte Staaten von Amerika. 90 (10): 4518–22. Bibcode:1993PNAS … 90.4518U. doi:10.1073 / pnas.90.10.4518. PMC 46543. PMID 8389453.
- ^ Savva R., McAuley-Hecht K., Brown T., Pearl L. (Februar 1995). “Die strukturelle Basis der spezifischen Reparatur der Basenexzision durch Uracil-DNA-Glycosylase”. Natur. 373 (6514): 487–93. Bibcode:1995Natur.373..487S. doi:10.1038 / 373487a0. PMID 7845459. S2CID 4315434.
- ^ Klungland A; Rosewell I; Hollenbach S; Larsen E; Daly G; Epe A; Seeberg E; Lindahl T; Barnes DE; et al. (1999). “Akkumulation von prämutagenen DNA-Läsionen bei Mäusen, bei denen die oxidative Basenschädigung nicht beseitigt werden kann”. PNAS. 96 (23): 13300–13305. Bibcode:1999PNAS … 9613300K. doi:10.1073 / pnas.96.23.13300. PMC 23942. PMID 10557315.
- ^ Russo MT, De, Degan P., Parlanti E., Dogliotti E. Barnes DE, Lindahl T., Yang H., Miller J. H., Bignami M .; et al. (2004). Akkumulation der oxidativen Basenläsion 8-Hydroxyguanin in der DNA von anfälligen Mäusen, die sowohl in der Myh- als auch in der Ogg1-DNA-Glycosylase defekt sind. Cancer Res. 64 (13): 4411–4414. doi:10.1158 / 0008-5472.can-04-0355. PMID 15231648.CS1-Wartung: mehrere Namen: Autorenliste (Link)
- ^ Moe E, Halle DR, Leiros I, Monsen VT, Timmins J, McSweeney S. (2012). “Struktur-Funktions-Studien einer ungewöhnlichen 3-Methyladenin-DNA-Glycosylase II (AlkA) aus Deinococcus radiodurans”. Acta Crystallogr D.. 68 (6): 703–12. doi:10.1107 / S090744491200947X. PMID 22683793.
- ^ Osorio, A; Milne, RL; Kuchenbaecker, K; Vaclová, T; Pita, G; Alonso, R; Peterlongo, P; Blanco, ich; de la Hoya, M; Duran, M; Díez, O; Ramón y Cajal, T; Konstantopoulou, ich; Martínez-Bouzas, C; Andrés Conejero, R; Soucy, P; McGuffog, L; Barrowdale, D; Lee, A; Swe-Brca; Arver, B; Rantala, J; Loman, N; Ehrencrona, H; Olopade, OI; Beattie, MS; Domchek, SM; Nathanson, K; Rebbeck, TR; et al. (2014). “DNA-Glycosylasen, die an der Reparatur der Basenexzision beteiligt sind, können mit dem Krebsrisiko in BRCA1- und BRCA2-Mutationsträgern assoziiert sein.”. PLOS Genetik. 10 (4): e1004256. doi:10.1371 / journal.pgen.1004256. PMC 3974638. PMID 24698998.
- ^ Walavalkar, Ninad (2014). “Lösungsstruktur und intramolekularer Austausch von Methyl-Cytosin-Bindungsdomänenprotein 4 (MBD4) auf DNA legen einen Mechanismus nahe, um nach mCpG / TpG-Fehlpaarungen zu suchen.”. Nukleinsäureforschung. 42 (17): 11218–11232. doi:10.1093 / nar / gku782. PMC 4176167. PMID 25183517.
- ^ Bellacosa A, Drohat AC (August 2015). “Rolle der Basenexzisionsreparatur bei der Aufrechterhaltung der genetischen und epigenetischen Integrität von CpG-Stellen”. DNA-Reparatur. 32: 33–42. doi:10.1016 / j.dnarep.2015.04.011. PMC 4903958. PMID 26021671.
- ^ ein b c Sjolund AB, Senejani AG, Sweasy JB (2013). “MBD4 und TDG: vielfältige DNA-Glycosylasen mit immer größeren biologischen Rollen”. Mutationsforschung. 743–744: 12–25. doi:10.1016 / j.mrfmmm.2012.11.001. PMC 3661743. PMID 23195996.
- ^ Cooper DN, Youssoufian H. (Februar 1988). “Das CpG-Dinukleotid und die genetische Erkrankung des Menschen”. Humangenetik. 78 (2): 151–5. doi:10.1007 / bf00278187. PMID 3338800. S2CID 41948691.
- ^ ein b Howard JH, Frolov A., Tzeng CW, Stewart A., Midzak A., Majmundar A., Godwin A., Heslin M., Bellacosa A., Arnoletti JP (Januar 2009). “Epigenetische Herunterregulierung des DNA-Reparaturgens MED1 / MBD4 bei Darm- und Eierstockkrebs”. Krebsbiologie & Therapie. 8 (1): 94–100. doi:10.4161 / cbt.8.1.7469. PMC 2683899. PMID 19127118.
- ^ Tricarico R., Cortellino S., Riccio A., Jagmohan-Changur S., Van der Klift H., Wijnen J., Turner D., Ventura A., Rovella V., Percesepe A., Lucci-Cordisco E., Radice P., Bertario L., Pedroni M., Ponz de Leon M., Mancuso P., Devarajan K., Cai K. Q., Klein-Szanto A. J., Neri G., Møller P., Viel A., Genuardi M., Fodde R., Bellacosa A. (Okt. 2015). “Beteiligung der MBD4-Inaktivierung an der Tumorentstehung mit Fehlpaarungsreparaturmangel” (PDF). Oncotarget. 6 (40): 42892–904. doi:10.18632 / oncotarget.5740. PMC 4767479. PMID 26503472.
- ^ Xiong XD, Luo XP, Liu X, Jing X, Zeng LQ, Lei M, Hong XS, Chen Y (2012). “Der MBD4 Glu346Lys-Polymorphismus ist mit dem Risiko von Gebärmutterhalskrebs in einer chinesischen Bevölkerung verbunden.” Int. J. Gynecol. Krebs. 22 (9): 1552–6. doi:10.1097 / IGC.0b013e31826e22e4. PMID 23027038. S2CID 788490.
- ^ ein b Hegde ML, Hegde PM, Bellot LJ, Mandal SM, Hazra TK, Li GM, Boldogh I, Tomkinson AE, Mitra S. (2013). “Die präplikative Reparatur oxidierter Basen im menschlichen Genom wird durch NEIL1-DNA-Glycosylase zusammen mit Replikationsproteinen vermittelt.”. Proc. Natl. Acad. Sci. Vereinigte Staaten von Amerika. 110 (33): E3090–9. Bibcode:2013PNAS..110E3090H. doi:10.1073 / pnas.1304231110. PMC 3746843. PMID 23898192.
- ^ Nemec AA, Wallace SS, Sweasy JB (Oktober 2010). “Varianten-Basen-Exzisionsreparaturproteine: tragen zur genomischen Instabilität bei”. Seminare in Krebsbiologie. 20 (5): 320–8. doi:10.1016 / j.semcancer.2010.10.010. PMC 3254599. PMID 20955798.
- ^ Suzuki T., Harashima H., Kamiya H. (2010). “Auswirkungen von Basenexzisionsreparaturproteinen auf die Mutagenese durch 8-Oxo-7,8-dihydroguanin (8-Hydroxyguanin), gepaart mit Cytosin und Adenin”. DNA-Reparatur (Amst.). 9 (5): 542–50. doi:10.1016 / j.dnarep.2010.02.004. hdl:2115/43021. PMID 20197241.
- ^ Shinmura K., Tao H., Goto M., Igarashi H., Taniguchi T., Maekawa M., Takezaki T., Sugimura H. (2004). “Inaktivierung von Mutationen des Exzisionsreparaturgens NEIL1 der menschlichen Basis bei Magenkrebs”. Karzinogenese. 25 (12): 2311–7. doi:10.1093 / karzin / bgh267. PMID 15319300.
- ^ ein b Chaisaingmongkol J., Popanda O., Warta R., Dyckhoff G., Herpel E., Geiselhart L., Claus R., Lasitschka F., Campos B., Oakes CC, Bermejo J. L., Herold-Mende C., Plass C., Schmezer P. (2012). “Das epigenetische Screening menschlicher DNA-Reparaturgene identifiziert eine aberrante Promotormethylierung von NEIL1 beim Plattenepithelkarzinom von Kopf und Hals.”. Onkogen. 31 (49): 5108–16. doi:10.1038 / onc.2011.660. PMID 22286769.
- ^ Do H, Wong NC, Murone C., John T., Solomon B., Mitchell PL, Dobrovic A. (2014). “Eine kritische Neubewertung der Methylierung des DNA-Reparaturgen-Promotors beim nichtkleinzelligen Lungenkarzinom”. Wissenschaftliche Berichte. 4: 4186. Bibcode:2014NatSR … 4E4186D. doi:10.1038 / srep04186. PMC 3935198. PMID 24569633.
- ^ Farkas SA, Vymetalkova V, Vodickova L., Vodicka P., Nilsson TK (April 2014). “DNA-Methylierungsänderungen in Genen, die häufig bei sporadischem Darmkrebs mutiert sind, sowie in den Genen DNA-Reparatur und Wnt / β-Catenin-Signalweg”. Epigenomics. 6 (2): 179–91. doi:10.2217 / epi.14.7. PMID 24811787.
Externe Links[edit]
Recent Comments