Phosphonium – Wikipedia

4das Ausgangsphosphoniumkation.
Das Phosphonium (dunkler: Phosphinium) Kation beschreibt mehratomige Kationen mit der chemischen Formel PR+
4 (R = H, Alkyl, Aryl, Halogenid). Sie sind tetraedrisch und im Allgemeinen farblos.[1]
Arten von Phosphoniumkationen[edit]
Protonierte Phosphine[edit]
Das Elternteil Phosphonium ist PH+
4 wie im Iodidsalz Phosphoniumiodid gefunden. Salze der Eltern PH+
4 sind selten anzutreffen, aber dieses Ion ist ein Zwischenprodukt bei der Herstellung des industriell nützlichen Tetrakis (hydroxymethyl) phosphoniumchlorids:
- PH3 + HCl + 4 CH2O → P (CH
2OH)+
4Cl– –
Viele Organophosphoniumsalze werden durch Protonierung von primären, sekundären und tertiären Phosphinen hergestellt:
- PR3 + H.+ → HPR+
3
Die Basizität von Phosphinen folgt den üblichen Trends, wobei R = Alkyl basischer ist als R = Aryl.[2]
Tetraorganophosphoniumkationen[edit]
Die gebräuchlichsten Phosphoniumverbindungen haben vier organische Substituenten, die an Phosphor gebunden sind. Die quaternären Phosphoniumkationen umfassen Tetraphenylphosphonium (C.6H.5)4P.+ und Tetramethylphosphonium P (CH
3)+
4.


Quartäre Phosphoniumkationen (PR+
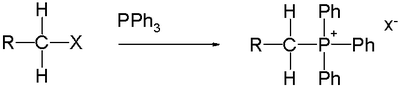
4) werden durch Alkylierung von Organophosphinen hergestellt.[3] Beispielsweise ergibt die Reaktion von Triphenylphosphin mit Methylbromid Methyltriphenylphosphoniumbromid, den Vorläufer eines Wittig-Reagens:[5]
- PPh3 + CH3Br → CH
3PPh+
3Br– –
[edit]
Festes Phosphorpentachlorid ist eine formulierte ionische Verbindung PCl+
4PCl– –
6das heißt, ein Salz, das das Tetrachlorphosphoniumkation enthält.[6][7] Verdünnte Lösungen dissoziieren gemäß folgendem Gleichgewicht:
- PCl5 ⇌ PCl+
4 + Cl– –
Triphenylphosphindichlorid (Ph3PCl2) liegt je nach Medium sowohl als pentakoordiniertes Phosphoran als auch als Chlortriphenylphosphoniumchlorid vor.[8] Die Situation ist ähnlich wie bei PCl5. Es ist eine ionische Verbindung (PPh3Cl)+Cl– – in polaren Lösungen und einer molekularen Spezies mit trigonaler bipyramidaler Molekülgeometrie in unpolarer Lösung.[9]
Alkoxyphosphoniumsalze: Arbuzov-Reaktion[edit]
Die Michaelis-Arbuzov-Reaktion ist die chemische Reaktion eines dreiwertigen Phosphoresters mit einem Alkylhalogenid unter Bildung einer fünfwertigen Phosphorspezies und eines weiteren Alkylhalogenids. Üblicherweise ist das Phosphorsubstrat ein Phosphitester (P (OR)3) und das Alkylierungsmittel ist ein Alkyliodid.[10]

Textiloberflächen[edit]

Tetrakis (hydroxymethyl) phosphoniumchlorid hat industrielle Bedeutung bei der Herstellung knitterfester und flammhemmender Oberflächen auf Baumwolltextilien und anderen Cellulosegeweben.[11][12] Ein flammhemmendes Finish kann aus THPC nach dem Proban-Verfahren hergestellt werden.[13] in dem THPC mit Harnstoff behandelt wird. Der Harnstoff kondensiert mit den Hydroxymethylgruppen an THPC. Die Phosphoniumstruktur wird als Ergebnis dieser Reaktion in Phosphinoxid umgewandelt.[14]
Phasentransferkatalysatoren und Fällungsmittel[edit]
Organische Phosphoniumkationen sind lipophil und können bei der Phasentransferkatalyse nützlich sein, ähnlich wie quaternäre Ammoniumsalze.
Das Kation Tetraphenylphosphonium (PPh+
4) ist ein nützliches Fällungsmittel.
Reagenzien für die organische Synthese[edit]
Wittig-Reagenzien werden in der organischen Synthese verwendet. Sie werden von Phosphoniumsalzen abgeleitet. Für die Deprotonierung ist eine starke Base wie Butyllithium oder Natriumamid erforderlich:
- [Ph3P+CH2R]X.– – + C.4H.9Li → Ph3P = CHR + LiX + C.4H.10
Eines der einfachsten Ylide ist Methylentriphenylphosphoran (Ph3P = CH2).[5]
Die Verbindungen Ph3PX2 (X = Cl, Br) werden in der Kirsanov-Reaktion verwendet.[15]
Mit der Kinnear-Perren-Reaktion werden Alkylphosphonyldichloride (RP (O) Cl2) und Ester (RP (O) (OR ‘)2). Ein Schlüsselzwischenprodukt sind Alkyltrichlorphosphoniumsalze, die durch Alkylierung von Phosphortrichlorid erhalten werden:[16]
- RCl + PCl3 + AlCl3 → [RPCl3]+AlCl4– –
Siehe auch[edit]
Verweise[edit]
- ^ Corbridge, DEC (1995). Phosphor: Ein Überblick über seine Chemie, Biochemie und Technologie (5. Aufl.). Amsterdam: Elsevier. ISBN 978-0-444-89307-9.
- ^ Zündete.; Lough, AJ; Morris, RH (2007). Eine Säureskala von Tetrafluorboratsalzen von Phosphonium- und Eisenhydridverbindungen in [D2]Dichlormethan “. Chem. EUR. J.. 13 (13): 3796–3803. doi:10.1002 / chem.200601484. PMID 17245785.
- ^ ein b HF Klein (1978). Trimethylphosphoniummethylid (Trimethylmethylenphosphoran). Anorganische Synthesen. 18. S. 138–140. doi:10.1002 / 9780470132494.ch23. ISBN 9780470132494.
- ^ Finch, A.; Fitch, AN; Gates, PN (1993). “Kristall- und Molekülstruktur einer metastabilen Modifikation von Phosphorpentachlorid”. Zeitschrift der Chemical Society, Chemical Communications: 957–958.
- ^ ein b Wittig; Schoellkopf, U. (1960). “Methylencyclohexan”. Organische Synthesen. 40: 66. doi:10.15227 / orgsyn.040.0066.. Beschreibt Ph3P = CH2.
- ^ Holleman, AF; Wiber, E.; Wiberg, N. (2001). Anorganische Chemie. Akademische Presse. ISBN 978-0-12-352651-9.
- ^ Suter, RW; Knachel, HC; Petro, VP; Howatson, JH & amp; Shore, SG (1978). “Natur von Phosphor (V) chlorid in ionisierenden und nichtionisierenden Lösungsmitteln”. Zeitschrift der American Chemical Society. 95 (5): 1474–1479. doi:10.1021 / ja00786a021.
- ^ SM Godfrey; CA McAuliffe; RG Pritchard; JM Sheffield (1996). “Eine röntgenkristallorgraphische Untersuchung des Reagens Ph3PCl2;; keine Gebührenübertragung, R.3P-Cl-Cl, trigonal bipyramidal oder [R3PCl]Cl aber eine ungewöhnliche zweikernige ionische Spezies, [Ph3PCl+⋯Cl–⋯+CIPPh3]Cl mit langen Cl-Cl-Kontakten “. Chemische Kommunikation (22): 2521–2522. doi:10.1039 / CC9960002521.
- ^ Jennings, EV; Nikitin, K; Ortin, Y; Gilheany, DG (2014). “Entartete nukleophile Substitution in Phosphoniumsalzen”. Marmelade. Chem. Soc. 136 (46): 16217–16226. doi:10.1021 / ja507433g. PMID 25384344.
- ^ Bhattacharya, AK; Thyagarajan, G. (1981). “Michaelis-Arbuzov-Umlagerung”. Chem. Rev. 81 (4): 415–430. doi:10.1021 / cr00044a004.
- ^ Weil, Edward D.; Levchik, Sergei V. (2008). “Flammschutzmittel bei der kommerziellen Verwendung oder Entwicklung von Textilien”. J. Fire Sci. 26 (3): 243–281. doi:10.1177 / 0734904108089485.
- ^ Svara, Jürgen; Weferling, Norbert; Hofmann, Thomas. Phosphorverbindungen, organisch. Ullmanns Enzyklopädie der Industriechemie. John Wiley & Sons, Inc., 2008 doi:10.1002 / 14356007.a19_545.pub2
- ^ “Häufig gestellte Fragen: Was ist der PROBAN®-Prozess?”. Rhodia Proban. Abgerufen 25. Februar 2013.
- ^ Reeves, Wilson A.; Guthrie, John D. (1956). “Zwischenprodukt für flammwidrige Polymerreaktionen von Tetrakis (hydroxymethyl) phosphoniumchlorid”. Industrie- und Ingenieurchemie. 48 (1): 64–67. doi:10.1021 / ie50553a021.
- ^ Studium der Organophosphorchemie. I. Umwandlung von Alkoholen und Phenolen in Halogenide durch tertiäre Phosphindihalogenide GA Wiley, RL Hershkowitz, BM Rein, BC Chung J. Am. Chem. Soc., 196486 (5), S. 964–965 doi:10.1021 / ja01059a073
- ^ Svara, J.; Weferling, N.; Hofmann, T. “Phosphorverbindungen, organisch”. Ullmanns Enzyklopädie der Industriechemie. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a19_545.pub2.
Recent Comments