Zweiter Hauptsatz der Thermodynamik – Wikipedia
Gesetz der Physik
Das zweiter Hauptsatz der Thermodynamik etabliert das Konzept der Entropie als physikalische Eigenschaft eines thermodynamischen Systems. Die Entropie sagt die Richtung spontaner Prozesse voraus und bestimmt, ob sie irreversibel oder unmöglich sind, obwohl die im ersten Hauptsatz der Thermodynamik festgelegte Anforderung der Energieerhaltung eingehalten wird. Das zweite Gesetz kann durch die Beobachtung formuliert werden, dass die Entropie isolierter Systeme, die der spontanen Evolution überlassen sind, nicht abnehmen kann, da sie immer zu einem Zustand des thermodynamischen Gleichgewichts gelangen, in dem die Entropie am höchsten ist. Wenn alle Prozesse im System reversibel sind, ist die Entropie konstant.[1]
Eine Zunahme der Entropie erklärt die Irreversibilität natürlicher Prozesse, auf die häufig im Konzept des Zeitpfeils Bezug genommen wird.[2]
Historisch gesehen war das zweite Gesetz ein empirischer Befund, der als Axiom der thermodynamischen Theorie akzeptiert wurde. Die statistische Mechanik liefert eine mikroskopische Erklärung des Gesetzes in Bezug auf Wahrscheinlichkeitsverteilungen der Zustände großer Anordnungen von Atomen oder Molekülen.
Das zweite Gesetz wurde auf viele Arten ausgedrückt. Seine erste Formulierung, die der richtigen Definition der Entropie vorausging und auf der Kalorietheorie basierte, ist Carnots Theorem, das dem französischen Wissenschaftler Sadi Carnot zugeschrieben wurde, der 1824 zeigte, dass die Effizienz der Umwandlung von Wärme in Arbeit in einer Wärmekraftmaschine einen höheren Wert hat Grenze.[3][4] Die erste strenge Definition des zweiten Gesetzes auf der Grundlage des Entropiekonzepts stammt von dem deutschen Wissenschaftler Rudolph Clausius in den 1850er Jahren, einschließlich seiner Aussage, dass Wärme niemals von einem kälteren zu einem wärmeren Körper übergehen kann, ohne dass eine andere damit verbundene Veränderung gleichzeitig auftritt Zeit.
Der zweite Hauptsatz der Thermodynamik kann auch verwendet werden, um das Konzept der thermodynamischen Temperatur zu definieren, dies wird jedoch normalerweise an den nullten Hauptsatz der Thermodynamik delegiert.
Einführung[edit]

Der erste Hauptsatz der Thermodynamik definiert die innere Energie eines thermodynamischen Systems und drückt das Gesetz der Energieerhaltung aus.[5][6] Das zweite Gesetz befasst sich mit der Richtung natürlicher Prozesse.[7] Es wird behauptet, dass ein natürlicher Prozess nur in einem Sinne abläuft und nicht reversibel ist. Wenn beispielsweise ein Weg für Leitung und Strahlung zur Verfügung gestellt wird, fließt Wärme immer spontan von einem heißeren zu einem kälteren Körper. Solche Phänomene werden in Bezug auf die Entropie erklärt.[8][9] Wenn ein isoliertes System anfänglich durch interne Trennwände undurchlässige Wände im inneren thermodynamischen Gleichgewicht gehalten wird und dann einige Operationen die Wände durchlässiger machen, entwickelt sich das System spontan, um ein endgültiges neues inneres thermodynamisches Gleichgewicht und seine Gesamtentropie zu erreichen. S., erhöht sich.
In einem fiktiven reversiblen Prozess ein infinitesimales Inkrement in der Entropie (dS.) eines Systems ist definiert als Ergebnis einer infinitesimalen Wärmeübertragung (δQ.) zu einem geschlossenen System (das den Eintritt oder Austritt von Energie ermöglicht – aber keine Übertragung von Materie) geteilt durch die gemeinsame Temperatur (T.) des Systems im Gleichgewicht und der Umgebung, die die Wärme liefert:[10]
Für infinitesimale Wärmemengen werden unterschiedliche Notationen verwendet (δ) und infinitesimale Mengen an Entropie (d) weil Entropie eine Funktion des Zustands ist, Wärme hingegen nicht wie Arbeit. Für einen tatsächlich möglichen infinitesimalen Prozess ohne Massenaustausch mit der Umgebung verlangt das zweite Gesetz, dass das Inkrement der Systementropie die Ungleichung erfüllt [11][12]
- T.) und die Temperatur der Umgebung (T.surr).[13][14] Beachten Sie, dass die Gleichheit weiterhin für den reinen Wärmefluss gilt.[15]
Dies ist die Grundlage für die genaue Bestimmung der absoluten Entropie von Reinsubstanzen aus gemessenen Wärmekapazitätskurven und Entropieänderungen bei Phasenübergängen, dh durch Kalorimetrie.[16][11] Einführung einer Reihe interner Variablen
Beschreibung der Abweichung eines thermodynamischen Systems im physikalischen Gleichgewicht (mit dem erforderlichen genau definierten gleichmäßigen Druck P. und Temperatur T.)[15] Aus dem chemischen Gleichgewichtszustand kann man die Gleichheit erfassen
Der zweite Term repräsentiert die Arbeit interner Variablen, die durch äußere Einflüsse gestört werden können, aber das System kann keine positive Arbeit über interne Variablen ausführen. Diese Aussage führt die Unmöglichkeit der zeitlichen Umkehrung der Evolution des thermodynamischen Systems ein und kann als Formulierung von betrachtet werden das zweite Prinzip der Thermodynamik – die Formulierung, die natürlich der Entropieformulierung des Prinzips entspricht.[17][18]
Das nullte Gesetz der Thermodynamik in seiner üblichen kurzen Aussage erlaubt die Erkennung, dass zwei Körper in einem Verhältnis des thermischen Gleichgewichts dieselbe Temperatur haben, insbesondere, dass ein Testkörper die gleiche Temperatur wie ein thermometrischer Referenzkörper hat.[19] Für einen Körper im thermischen Gleichgewicht mit einem anderen gibt es unbegrenzt viele empirische Temperaturskalen, die im Allgemeinen jeweils von den Eigenschaften eines bestimmten thermometrischen Referenzkörpers abhängen. Das zweite Gesetz erlaubt[how?] eine ausgezeichnete Temperaturskala, die eine absolute thermodynamische Temperatur definiert, unabhängig von den Eigenschaften eines bestimmten thermometrischen Referenzkörpers.[20][21]
Verschiedene Gesetzeserklärungen[edit]
Der zweite Hauptsatz der Thermodynamik kann auf viele spezifische Arten ausgedrückt werden:[22] Die bekanntesten klassischen Aussagen sind die Aussage von Rudolf Clausius (1854), die Aussage von Lord Kelvin (1851) und die Aussage in axiomatischer Thermodynamik von Constantin Carathéodory (1909). Diese Aussagen stellen das Gesetz allgemein physikalisch dar und führen die Unmöglichkeit bestimmter Prozesse an. Die Aussagen von Clausius und Kelvin haben sich als gleichwertig erwiesen.
Carnots Prinzip[edit]
Der historische Ursprung[25] des zweiten Hauptsatzes der Thermodynamik war in Carnots Prinzip. Es bezieht sich auf einen Zyklus einer Carnot-Wärmekraftmaschine, die fiktiv im Grenzmodus extremer Langsamkeit betrieben wird, der als quasistatisch bezeichnet wird, so dass die Wärme- und Arbeitsübertragung zwischen Teilsystemen erfolgt, die sich immer in ihren eigenen internen Zuständen des thermodynamischen Gleichgewichts befinden. Der Carnot-Motor ist ein idealisiertes Gerät von besonderem Interesse für Ingenieure, die sich mit dem Wirkungsgrad von Wärmekraftmaschinen befassen. Carnots Prinzip wurde von Carnot zu einer Zeit anerkannt, als die kalorische Theorie der Wärme ernsthaft in Betracht gezogen wurde, bevor der erste Hauptsatz der Thermodynamik erkannt wurde und bevor der Begriff der Entropie mathematisch ausgedrückt wurde. Im Lichte des ersten Hauptsatzes interpretiert, entspricht es physikalisch dem zweiten Hauptsatz der Thermodynamik und bleibt bis heute gültig. Carnots ursprüngliche Argumente wurden unter dem Gesichtspunkt der Kalorietheorie vor der Entdeckung des ersten Hauptsatzes der Thermodynamik vorgebracht. Einige Beispiele aus seinem Buch sind:
-
- …Überall dort, wo ein Temperaturunterschied besteht, kann Antriebskraft erzeugt werden.[26]
-
- Die Erzeugung von Antriebskraft ist dann bei Dampfmaschinen nicht auf einen tatsächlichen Kalorienverbrauch zurückzuführen, sondern zu seinem Transport von einem warmen Körper zu einem kalten Körper …[27]
-
- Die Antriebskraft der Wärme ist unabhängig von den zur Realisierung eingesetzten Mitteln; seine Menge wird allein durch die Temperaturen der Körper festgelegt, zwischen denen schließlich die Übertragung von Kalorien bewirkt wird.[28]
In modernen Begriffen kann Carnots Prinzip genauer ausgedrückt werden:
-
- Der Wirkungsgrad eines quasistatischen oder reversiblen Carnot-Zyklus hängt nur von den Temperaturen der beiden Wärmespeicher ab und ist unabhängig von der Arbeitssubstanz gleich. Ein auf diese Weise betriebener Carnot-Motor ist mit diesen beiden Temperaturen die effizienteste Wärmekraftmaschine.[29][30][31][32][33][34]
Clausius Aussage[edit]
Der deutsche Wissenschaftler Rudolf Clausius legte 1850 den Grundstein für den zweiten Hauptsatz der Thermodynamik, indem er den Zusammenhang zwischen Wärmeübertragung und Arbeit untersuchte. Seine Formulierung des zweiten Gesetzes, das 1854 in deutscher Sprache veröffentlicht wurde, ist bekannt als Clausius Aussage::
Wärme kann niemals von einem kälteren zu einem wärmeren Körper gelangen, ohne dass gleichzeitig eine andere damit verbundene Veränderung auftritt.
Die Aussage von Clausius verwendet das Konzept des Wärmeübergangs. Wie in thermodynamischen Diskussionen üblich, bedeutet dies “Nettotransfer von Energie als Wärme” und bezieht sich nicht auf beitragsabhängige Übertragungen in die eine oder andere Richtung.
Wärme kann nicht spontan von kalten Regionen in heiße Regionen fließen, ohne dass externe Arbeiten am System durchgeführt werden, was beispielsweise aus gewöhnlichen Erfahrungen mit der Kühlung hervorgeht. In einem Kühlschrank fließt Wärme von kalt nach heiß, jedoch nur, wenn sie von einem externen Mittel, dem Kühlsystem, erzwungen wird.
Kelvin Aussagen[edit]
Lord Kelvin drückte das zweite Gesetz in mehreren Formulierungen aus.
-
- Es ist unmöglich, dass eine selbsttätige Maschine ohne fremde Hilfe Wärme mit einer höheren Temperatur von einem Körper zum anderen transportiert.
-
- Es ist unmöglich, durch unbelebte Materialwirkung einen mechanischen Effekt aus irgendeinem Teil der Materie abzuleiten, indem sie unter die Temperatur des kältesten der umgebenden Objekte abgekühlt wird.
Gleichwertigkeit der Aussagen von Clausius und Kelvin[edit]
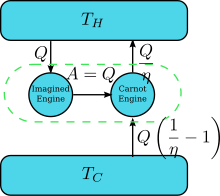 Leiten Sie die Kelvin-Aussage von der Clausius-Aussage ab
Leiten Sie die Kelvin-Aussage von der Clausius-Aussage abAngenommen, es gibt einen Motor, der gegen die Kelvin-Aussage verstößt: dh einen Motor, der Wärme abführt und zyklisch vollständig in Arbeit umwandelt, ohne dass ein anderes Ergebnis erzielt wird. Koppeln Sie es nun mit einem umgekehrten Carnot-Motor, wie in der Abbildung gezeigt. Der Wirkungsgrad einer normalen Wärmekraftmaschine beträgt η und somit beträgt der Wirkungsgrad der Umkehrwärmekraftmaschine 1 / η. Die Netto- und einzige Wirkung des kombinierten Motorpaares besteht in der Wärmeübertragung
vom kühleren Reservoir zum heißeren, was gegen die Clausius-Aussage verstößt. (Dies ist eine Folge des ersten Hauptsatzes der Thermodynamik, da die Energie des Gesamtsystems gleich bleibt.
, also deshalb
). Ein Verstoß gegen die Kelvin-Aussage impliziert also einen Verstoß gegen die Clausius-Aussage, dh die Clausius-Aussage impliziert die Kelvin-Aussage. Wir können auf ähnliche Weise beweisen, dass die Kelvin-Aussage die Clausius-Aussage impliziert, und daher sind die beiden gleichwertig.
Plancks Vorschlag[edit]
Planck bot den folgenden Vorschlag an, der direkt aus der Erfahrung abgeleitet wurde. Dies wird manchmal als seine Aussage zum zweiten Gesetz angesehen, aber er betrachtete es als Ausgangspunkt für die Ableitung des zweiten Gesetzes.
-
- Es ist unmöglich, einen Motor zu konstruieren, der in einem vollständigen Zyklus arbeitet und keine Wirkung außer der Erhöhung eines Gewichts und der Kühlung eines Wärmespeichers erzeugt.[38][39]
Beziehung zwischen Kelvins Aussage und Plancks Vorschlag[edit]
In Lehrbüchern ist es fast üblich, von der zu sprechen “Kelvin-Planck-Aussage” des Gesetzes, wie zum Beispiel im Text von ter Haar und Wergeland.[40]
Das Kelvin-Planck-Aussage (oder der Wärmekraftmaschine Aussage) des zweiten Hauptsatzes der Thermodynamik besagt, dass
-
- Es ist unmöglich, eine zyklisch arbeitende Vorrichtung zu entwickeln, deren einzige Wirkung darin besteht, Energie in Form von Wärme aus einem einzelnen Wärmespeicher zu absorbieren und eine äquivalente Menge an Arbeit zu liefern.[41]
Plancks Aussage[edit]
Planck stellte das zweite Gesetz wie folgt fest.
-
- Jeder in der Natur ablaufende Prozess verläuft in dem Sinne, dass die Summe der Entropien aller am Prozess beteiligten Körper erhöht wird. In der Grenze, dh für reversible Prozesse, bleibt die Summe der Entropien unverändert.[42][43][44]
Eher wie Plancks Aussage ist die von Uhlenbeck und Ford für irreversible Phänomene.
-
- … bei einem irreversiblen oder spontanen Wechsel von einem Gleichgewichtszustand in einen anderen (wie zum Beispiel der Temperaturausgleich zweier Körper A und B bei Kontakt) nimmt die Entropie immer zu.[45]
Prinzip der Carathéodory[edit]
Constantin Carathéodory formulierte die Thermodynamik auf einer rein mathematischen axiomatischen Grundlage. Seine Aussage zum zweiten Gesetz ist als das Prinzip der Carathéodory bekannt, das wie folgt formuliert werden kann:[46]
In jeder Nachbarschaft eines Staates S eines adiabatisch geschlossenen Systems gibt es Staaten, die von S aus nicht zugänglich sind.[47]
Mit dieser Formulierung beschrieb er erstmals das Konzept der adiabatischen Zugänglichkeit und bildete die Grundlage für ein neues Teilgebiet der klassischen Thermodynamik, das oft als geometrische Thermodynamik bezeichnet wird. Aus Carathéodorys Prinzip folgt, dass die quasi statisch als Wärme übertragene Energiemenge eine holonome Prozessfunktion ist, mit anderen Worten:
.[48][clarification needed]
Obwohl es in Lehrbüchern fast üblich ist zu sagen, dass Carathéodorys Prinzip das zweite Gesetz ausdrückt und es als gleichwertig mit den Aussagen von Clausius oder Kelvin-Planck behandelt, ist dies nicht der Fall. Um den gesamten Inhalt des zweiten Gesetzes zu erhalten, muss das Carathéodory-Prinzip durch das Planck-Prinzip ergänzt werden, dass isochore Arbeit immer die innere Energie eines geschlossenen Systems erhöht, das sich ursprünglich in seinem eigenen inneren thermodynamischen Gleichgewicht befand.[14][50][51][clarification needed]
Plancks Prinzip[edit]
1926 schrieb Max Planck eine wichtige Arbeit über die Grundlagen der Thermodynamik.[50][52] Er wies auf das Prinzip hin
-
- Die innere Energie eines geschlossenen Systems wird durch einen adiabatischen Prozess erhöht, während dessen Dauer das Volumen des Systems konstant bleibt.[14]
Diese Formulierung erwähnt weder Wärme noch Temperatur oder sogar Entropie und beruht nicht notwendigerweise implizit auf diesen Konzepten, impliziert jedoch den Inhalt des zweiten Gesetzes. Eine eng verwandte Aussage ist die “Reibungsdruck wirkt sich niemals positiv aus.”[53] Planck schrieb: “Die Erzeugung von Wärme durch Reibung ist irreversibel.”[54][55]
Ganz zu schweigen von der Entropie, dieses Prinzip von Planck wird physikalisch ausgedrückt. Es ist sehr eng mit der oben gegebenen Kelvin-Aussage verwandt.[56] Es ist relevant, dass für ein System mit konstantem Volumen und konstanten Molzahlen die Entropie eine monotone Funktion der inneren Energie ist. Dennoch ist dieses Prinzip von Planck nicht die bevorzugte Aussage von Planck zum zweiten Gesetz, die oben in einem früheren Unterabschnitt des vorliegenden Abschnitts dieses Artikels zitiert wurde und auf dem Konzept der Entropie beruht.
Eine Aussage, die in gewissem Sinne das Plancksche Prinzip ergänzt, machen Borgnakke und Sonntag. Sie bieten es nicht als vollständige Erklärung des zweiten Gesetzes an:
-
- … es gibt nur einen Weg, auf dem die Entropie von a [closed] System kann verringert werden, und das heißt, um Wärme vom System zu übertragen.[57]
Abweichend von Plancks gerade vorstehendem Prinzip bezieht sich dieses explizit auf die Entropieänderung. Das Entfernen von Materie aus einem System kann auch seine Entropie verringern.
Aussage für ein System, das einen bekannten Ausdruck seiner inneren Energie als Funktion seiner umfangreichen Zustandsvariablen hat[edit]
Es wurde gezeigt, dass das zweite Gesetz der inneren Energie entspricht U. eine schwach konvexe Funktion, wenn sie als Funktion umfangreicher Eigenschaften (Masse, Volumen, Entropie, …) geschrieben wird.[58][59][clarification needed]
Folgerungen[edit]
Perpetual Motion der zweiten Art[edit]
Vor der Einführung des zweiten Gesetzes hatten viele Menschen, die an der Erfindung einer Perpetual-Motion-Maschine interessiert waren, versucht, die Einschränkungen des ersten Hauptsatzes der Thermodynamik zu umgehen, indem sie die massive innere Energie der Umgebung als Kraft der Maschine extrahierten. Eine solche Maschine heißt a “Perpetual Motion Maschine der zweiten Art”. Das zweite Gesetz erklärte die Unmöglichkeit solcher Maschinen.
Carnot-Theorem[edit]
Der Satz von Carnot (1824) ist ein Prinzip, das den maximalen Wirkungsgrad für jeden möglichen Motor begrenzt. Der Wirkungsgrad hängt ausschließlich von der Temperaturdifferenz zwischen den heißen und kalten Wärmespeichern ab. Carnots Satz besagt:
- Alle irreversiblen Wärmekraftmaschinen zwischen zwei Wärmespeichern sind weniger effizient als ein Carnot-Motor, der zwischen denselben Wärmespeichern betrieben wird.
- Alle reversiblen Wärmekraftmaschinen zwischen zwei Wärmespeichern sind gleich effizient wie ein Carnot-Motor, der zwischen denselben Wärmespeichern betrieben wird.
In seinem idealen Modell könnte die in Arbeit umgewandelte Kalorienwärme durch Umkehren der Bewegung des Zyklus wiederhergestellt werden, ein Konzept, das später als thermodynamische Reversibilität bezeichnet wird. Carnot postulierte jedoch weiter, dass etwas Kalorien verloren geht und nicht in mechanische Arbeit umgewandelt wird. Daher konnte keine echte Wärmekraftmaschine die Reversibilität des Carnot-Zyklus erkennen und wurde als weniger effizient verurteilt.
Obwohl in Bezug auf Kalorien (siehe die veraltete Kalorietheorie) und nicht in Bezug auf Entropie formuliert, war dies ein früher Einblick in das zweite Gesetz.
Clausius-Ungleichung[edit]
Der Clausius-Satz (1854) besagt dies in einem zyklischen Prozess
Die Gleichheit gilt im reversiblen Fall[60] und die strikte Ungleichung gilt im irreversiblen Fall. Der reversible Fall wird verwendet, um die Zustandsfunktionsentropie einzuführen. Dies liegt daran, dass in zyklischen Prozessen die Variation einer Zustandsfunktion von der Zustandsfunktionalität Null ist.
Thermodynamische Temperatur[edit]
Für eine beliebige Wärmekraftmaschine beträgt der Wirkungsgrad:
wo W.n ist für das pro Zyklus geleistete Netz. Somit hängt der Wirkungsgrad nur von q abC./ qH..
Der Satz von Carnot besagt, dass alle reversiblen Motoren, die zwischen denselben Wärmespeichern arbeiten, gleich effizient sind. Somit arbeitet jede reversible Wärmekraftmaschine zwischen den Temperaturen T.1 und T.2 muss den gleichen Wirkungsgrad haben, dh der Wirkungsgrad ist nur die Funktion der Temperaturen:
Zusätzlich arbeitet eine reversible Wärmekraftmaschine zwischen Temperaturen T.1 und T.3 muss den gleichen Wirkungsgrad haben wie einer, der aus zwei Zyklen besteht, einer dazwischen T.1 und eine andere (Zwischen-) Temperatur T.2und die zweite zwischen T.2 undT.3. Dies kann nur dann der Fall sein, wenn
Betrachten Sie nun den Fall, in dem
ist eine feste Referenztemperatur: die Temperatur des Tripelpunktes von Wasser. Dann für jeden T.2 und T.3,
Daher, wenn die thermodynamische Temperatur durch definiert ist
dann die Funktion f, als Funktion der thermodynamischen Temperatur betrachtet, ist einfach
und die Referenztemperatur T.1 wird den Wert 273,16 haben. (Jede Referenztemperatur und jeder positive numerische Wert können verwendet werden – die Auswahl hier entspricht der Kelvin-Skala.)
Entropie[edit]
Nach der Clausius-Gleichheit für einen reversiblen Prozess
Das heißt das Linienintegral
ist pfadunabhängig für reversible Prozesse.
Wir können also eine Zustandsfunktion S definieren, die als Entropie bezeichnet wird und für einen reversiblen Prozess oder für die reine Wärmeübertragung gilt[15] befriedigt
Damit können wir den Entropiedifferenz nur durch Integration der obigen Formel erhalten. Um den absoluten Wert zu erhalten, benötigen wir den dritten Hauptsatz der Thermodynamik, der besagt, dass S. = 0 bei absolutem Nullpunkt für perfekte Kristalle.
Da Entropie eine Zustandsfunktion ist, können wir für jeden irreversiblen Prozess den Anfangs- und den Endzustand immer mit einem imaginären reversiblen Prozess verbinden und auf diesem Pfad integrieren, um die Entropiedifferenz zu berechnen.
Kehren Sie nun den reversiblen Prozess um und kombinieren Sie ihn mit dem irreversiblen Prozess. Anwenden der Clausius-Ungleichung auf diese Schleife,
So,
wo die Gleichheit gilt, wenn die Transformation reversibel ist.
Beachten Sie, dass wenn der Prozess ein adiabatischer Prozess ist, dann
, so
.
Energie, verfügbare nützliche Arbeit[edit]
Ein wichtiger und aufschlussreicher idealisierter Sonderfall besteht darin, die Anwendung des zweiten Gesetzes auf das Szenario eines isolierten Systems (als Gesamtsystem oder Universum bezeichnet) zu betrachten, das aus zwei Teilen besteht: einem interessierenden Teilsystem und der Umgebung des Teilsystems. Diese Umgebung ist so groß, dass man sie als eine betrachten kann unbegrenzt Wärmespeicher auf Temperatur T.R. und Druck P.R. – damit unabhängig davon, wie viel Wärme an das Subsystem (oder von diesem) übertragen wird, die Umgebungstemperatur erhalten bleibt T.R.;; und egal wie stark sich das Volumen des Subsystems ausdehnt (oder zusammenzieht), der Druck der Umgebung bleibt bestehen P.R..
Was auch immer sich ändert dS und dSR. treten in den Entropien des Teilsystems und der Umgebung individuell nach dem zweiten Gesetz der Entropie auf S.Knirps des isolierten Gesamtsystems darf nicht abnehmen:
Nach dem ersten Hauptsatz der Thermodynamik ist die Änderung dU in der inneren Energie des Teilsystems ist die Summe der Wärme δq zum Subsystem hinzugefügt, weniger irgendeine Arbeit δw getan durch das Subsystem, Plus jede chemische Nettoenergie, die in das Teilsystem gelangt d ∑μiRN.ich, so dass:
wo μiR sind die chemischen Potentiale chemischer Spezies in der äußeren Umgebung.
Jetzt ist die Wärme, die den Vorratsbehälter verlässt und in das Teilsystem eintritt
wo wir zuerst die Definition der Entropie in der klassischen Thermodynamik verwendet haben (alternativ kann in der statistischen Thermodynamik die Beziehung zwischen Entropieänderung, Temperatur und absorbierter Wärme abgeleitet werden); und dann die Ungleichung des zweiten Gesetzes von oben.
Daraus folgt, dass jedes Netzwerk δw vom Subsystem getan muss gehorchen
Es ist nützlich, die Arbeit zu trennen δw vom Subsystem in die nützlich Arbeit δwu das kann getan werden durch das Subsystem, über die Arbeit hinaus pR. dV Dies geschieht lediglich durch das Teilsystem, das sich gegen den umgebenden äußeren Druck ausdehnt und die folgende Beziehung für die nützliche Arbeit (Exergie) ergibt, die ausgeführt werden kann:
Es ist zweckmäßig, die rechte Seite als die genaue Ableitung eines thermodynamischen Potentials zu definieren, das als bezeichnet wird Verfügbarkeit oder Exergie E. des Subsystems,
Das zweite Gesetz impliziert daher, dass für jeden Prozess, der als einfach in ein Teilsystem unterteilt betrachtet werden kann, und einen unbegrenzten Temperatur- und Druckspeicher, mit dem er in Kontakt steht,
dh die Änderung der Exergie des Subsystems plus die nützliche Arbeit durch das Subsystem (oder die Änderung der Exergie des Subsystems abzüglich jeglicher Arbeit, die zusätzlich zu der vom Druckspeicher geleisteten Arbeit geleistet wird) auf das System) muss kleiner oder gleich Null sein.
In der Summe, wenn eine richtige unendlich-Reservoir-ähnlich Der Referenzzustand wird als Systemumgebung in der realen Welt gewählt, dann sagt das zweite Gesetz eine Abnahme von voraus E. für einen irreversiblen Prozess und keine Änderung für einen reversiblen Prozess.
- Ist äquivalent zu
Dieser Ausdruck zusammen mit dem zugehörigen Referenzzustand ermöglicht es einem Konstrukteur, der im makroskopischen Maßstab (oberhalb der thermodynamischen Grenze) arbeitet, den zweiten Hauptsatz zu verwenden, ohne die Entropieänderung in einem insgesamt isolierten System direkt zu messen oder zu berücksichtigen. ((Siehe auch Verfahrenstechniker). Diese Änderungen wurden bereits unter der Annahme berücksichtigt, dass das betrachtete System ein Gleichgewicht mit dem Referenzzustand erreichen kann, ohne den Referenzzustand zu ändern. Es kann auch eine Effizienz für einen Prozess oder eine Sammlung von Prozessen gefunden werden, die ihn mit dem reversiblen Ideal vergleicht (Siehe Effizienz nach dem zweiten Gesetz.)
Diese Herangehensweise an das zweite Gesetz ist in der Ingenieurpraxis, der Umweltbilanzierung, der Systemökologie und anderen Disziplinen weit verbreitet.
Der zweite Hauptsatz in der chemischen Thermodynamik[edit]
Für einen spontanen chemischen Prozess in einem geschlossenen System bei konstanter Temperatur und konstantem Druck ohnePV Arbeit, die Clausius-Ungleichung ΔS> Q / T.surr verwandelt sich in eine Bedingung für die Änderung der freien Energie von Gibbs
oder dG <0. Für einen ähnlichen Prozess bei konstanter Temperatur und konstantem Volumen muss die Änderung der freien Helmholtz-Energie negativ sein.
. Ein negativer Wert der Änderung der freien Energie (G oder A) ist daher eine notwendige Bedingung für einen spontanen Prozess. Dies ist die nützlichste Form des zweiten Hauptsatzes der Thermodynamik in der Chemie, bei der Änderungen der freien Energie aus tabellierten Bildungsenthalpien und molaren Standardentropien von Reaktanten und Produkten berechnet werden können.[16][11] Der chemische Gleichgewichtszustand ist konstant T. und p ohne elektrische Arbeit ist dG = 0.
Geschichte[edit]

Die erste Theorie der Umwandlung von Wärme in mechanische Arbeit geht auf Nicolas Léonard Sadi Carnot aus dem Jahr 1824 zurück. Er erkannte als erster richtig, dass der Wirkungsgrad dieser Umwandlung von der Temperaturdifferenz zwischen Motor und Umgebung abhängt.
Rudolf Clausius erkannte die Bedeutung von James Prescott Joules Arbeit zur Energieeinsparung und formulierte 1850 als erster das zweite Gesetz in dieser Form: Wärme fließt nicht spontan von kalten bis heißen Körpern. Obwohl dies heute allgemein bekannt ist, widersprach dies der damals populären Kalorietheorie der Wärme, die Wärme als Flüssigkeit betrachtete. Von dort konnte er auf das Prinzip von Sadi Carnot und die Definition der Entropie (1865) schließen.
Die im 19. Jahrhundert gegründete Kelvin-Planck-Erklärung des Zweiten Gesetzes besagt: “Es ist unmöglich, dass ein Gerät, das in einem Zyklus arbeitet, Wärme von einem einzelnen Speicher empfängt und einen Nettobetrag an Arbeit erzeugt.” Es wurde gezeigt, dass dies der Aussage von Clausius entspricht.
Die ergodische Hypothese ist auch für den Boltzmann-Ansatz wichtig. Es heißt, dass über lange Zeiträume die Zeit, die in einem Bereich des Phasenraums von Mikrozuständen mit derselben Energie verbracht wird, proportional zum Volumen dieses Bereichs ist, dh dass alle zugänglichen Mikrozustände über einen langen Zeitraum gleich wahrscheinlich sind. Entsprechend heißt es, dass Zeitdurchschnitt und Durchschnitt über das statistische Ensemble gleich sind.
Es gibt eine traditionelle Lehre, beginnend mit Clausius, dass Entropie als molekulare “Störung” innerhalb eines makroskopischen Systems verstanden werden kann. Diese Lehre ist veraltet.[61][62][63]
Bericht von Clausius[edit]

1856 erklärte der deutsche Physiker Rudolf Clausius, wie er das nannte “zweiter grundlegender Satz in der mechanischen Theorie der Wärme” in der folgenden Form:
wo Q. ist Wärme, T. ist Temperatur und N. ist der “Äquivalenzwert” aller nicht kompensierten Transformationen, die an einem zyklischen Prozess beteiligt sind. Später, im Jahr 1865, würde Clausius kommen, um zu definieren “Äquivalenzwert” als Entropie. Nach dieser Definition wurde im selben Jahr die berühmteste Version des zweiten Gesetzes in einer Präsentation in der Philosophischen Gesellschaft von Zürich am 24. April gelesen, in der Clausius am Ende seiner Präsentation Folgendes abschließt:
Die Entropie des Universums tendiert zu einem Maximum.
Diese Aussage ist die bekannteste Formulierung des zweiten Gesetzes. Aufgrund der Lockerheit seiner Sprache, z. B. des Universums, sowie des Fehlens spezifischer Bedingungen, z. B. offen, geschlossen oder isoliert, verstehen viele Menschen mit dieser einfachen Aussage, dass der zweite Hauptsatz der Thermodynamik praktisch für jedes vorstellbare Thema gilt. Das ist nicht wahr; Diese Aussage ist nur eine vereinfachte Version einer erweiterten und genaueren Beschreibung.
In Bezug auf die Zeitvariation lautet die mathematische Aussage des zweiten Gesetzes für ein isoliertes System, das einer willkürlichen Transformation unterzogen wird:
wo
- S. ist die Entropie des Systems und
- t ist an der Zeit.
Das Gleichheitszeichen gilt nach dem Ausgleich. Eine alternative Formulierungsform des zweiten Gesetzes für isolierte Systeme ist:
- mit
mit
die Summe der Entropieproduktionsrate aller Prozesse innerhalb des Systems. Der Vorteil dieser Formulierung ist, dass sie den Effekt der Entropieproduktion zeigt. Die Entropieproduktionsrate ist ein sehr wichtiges Konzept, da sie den Wirkungsgrad von thermischen Maschinen bestimmt (begrenzt). Multipliziert mit der Umgebungstemperatur
es gibt die sogenannte dissipierte Energie
.
Der Ausdruck des zweiten Gesetzes für geschlossene Systeme (also Wärmeaustausch und Verschieben von Grenzen, aber kein Austausch von Materie) lautet:
- mit
Hier
- ist der Wärmefluss in das System
- ist die Temperatur an dem Punkt, an dem die Wärme in das System eintritt.
Das Gleichheitszeichen gilt für den Fall, dass nur reversible Prozesse innerhalb des Systems stattfinden. Wenn irreversible Prozesse stattfinden (was bei in Betrieb befindlichen realen Systemen der Fall ist), gilt das> -Zeichen. Wenn dem System an mehreren Stellen Wärme zugeführt wird, müssen wir die algebraische Summe der entsprechenden Terme nehmen.
Für offene Systeme (die auch den Austausch von Materie ermöglichen):
- mit
Hier
ist der Entropiefluss in das System, der mit dem in das System eintretenden Materiefluss verbunden ist. Es sollte nicht mit der zeitlichen Ableitung der Entropie verwechselt werden. Wenn Materie an mehreren Stellen geliefert wird, müssen wir die algebraische Summe dieser Beiträge nehmen.
Statistische Mechanik[edit]
Die statistische Mechanik erklärt das zweite Gesetz, indem sie postuliert, dass ein Material aus Atomen und Molekülen besteht, die sich in ständiger Bewegung befinden. Ein bestimmter Satz von Positionen und Geschwindigkeiten für jedes Partikel im System wird als Mikrozustand des Systems bezeichnet, und aufgrund der ständigen Bewegung ändert das System ständig seinen Mikrozustand. Die statistische Mechanik postuliert, dass im Gleichgewicht jeder Mikrozustand, in dem sich das System befinden könnte, gleich wahrscheinlich auftritt, und wenn diese Annahme getroffen wird, führt dies direkt zu der Schlussfolgerung, dass das zweite Gesetz im statistischen Sinne gelten muss. Das heißt, das zweite Gesetz gilt im Durchschnitt mit einer statistischen Abweichung in der Größenordnung von 1 /√N. wo N. ist die Anzahl der Partikel im System. Für alltägliche (makroskopische) Situationen ist die Wahrscheinlichkeit, dass das zweite Gesetz verletzt wird, praktisch Null. Bei Systemen mit einer geringen Anzahl von Partikeln können die thermodynamischen Parameter, einschließlich der Entropie, signifikante statistische Abweichungen von den im zweiten Gesetz vorhergesagten aufweisen. Die klassische thermodynamische Theorie befasst sich nicht mit diesen statistischen Variationen.
Ableitung aus der statistischen Mechanik[edit]
Das erste mechanische Argument der kinetischen Theorie der Gase, dass molekulare Kollisionen einen Temperaturausgleich und damit eine Tendenz zum Gleichgewicht zur Folge haben, war James Clerk Maxwell im Jahr 1860 zu verdanken;[65]Ludwig Boltzmann argumentierte mit seinem H-Theorem von 1872 auch, dass Gase aufgrund von Kollisionen im Laufe der Zeit zur Maxwell-Boltzmann-Verteilung tendieren sollten.
Aufgrund des Loschmidt-Paradoxons müssen Ableitungen des Zweiten Hauptsatzes eine Annahme in Bezug auf die Vergangenheit treffen, nämlich dass das System zu einem bestimmten Zeitpunkt in der Vergangenheit nicht korreliert ist; Dies ermöglicht eine einfache probabilistische Behandlung. Diese Annahme wird normalerweise als Randbedingung angesehen, und daher ist das zweite Gesetz letztendlich eine Folge der Anfangsbedingungen irgendwo in der Vergangenheit, wahrscheinlich am Anfang des Universums (dem Urknall), obwohl auch andere Szenarien vorgeschlagen wurden.[66][67][68]
Angesichts dieser Annahmen ist das zweite Gesetz in der statistischen Mechanik kein Postulat, sondern eine Folge des grundlegenden Postulats, das auch als Postulat mit gleicher vorheriger Wahrscheinlichkeit bezeichnet wird, solange klar ist, dass einfache Wahrscheinlichkeitsargumente nur auf das angewendet werden Zukunft, während es für die Vergangenheit zusätzliche Informationsquellen gibt, die uns sagen, dass es sich um eine niedrige Entropie handelte.[citation needed] Der erste Teil des zweiten Gesetzes, der besagt, dass die Entropie eines thermisch isolierten Systems nur zunehmen kann, ist eine triviale Folge des Postulats mit gleicher vorheriger Wahrscheinlichkeit, wenn wir den Begriff der Entropie auf Systeme im thermischen Gleichgewicht beschränken. Die Entropie eines isolierten Systems im thermischen Gleichgewicht enthält eine Energiemenge von
ist:
wo
ist die Anzahl der Quantenzustände in einem kleinen Intervall zwischen
und
. Hier
ist ein makroskopisch kleines Energieintervall, das festgehalten wird. Genau genommen bedeutet dies, dass die Entropie von der Wahl abhängt
. In der thermodynamischen Grenze (dh in der Grenze einer unendlich großen Systemgröße) hängt die spezifische Entropie (Entropie pro Volumeneinheit oder pro Masseneinheit) jedoch nicht davon ab
.
Angenommen, wir haben ein isoliertes System, dessen makroskopischer Zustand durch eine Reihe von Variablen angegeben wird. Diese makroskopischen Variablen können sich beispielsweise auf das Gesamtvolumen, die Positionen der Kolben im System usw. beziehen. Dann
hängt von den Werten dieser Variablen ab. Wenn eine Variable nicht fest ist (z. B. wenn wir einen Kolben nicht in einer bestimmten Position festklemmen), ist die freie Variable im Gleichgewicht so, dass alle zugänglichen Zustände im Gleichgewicht gleich wahrscheinlich sind
wird maximiert, da dies die wahrscheinlichste Situation im Gleichgewicht ist.
Wenn die Variable ursprünglich auf einen bestimmten Wert festgelegt wurde, wird sich die Variable beim Loslassen und wenn das neue Gleichgewicht erreicht ist, so anpassen, dass
wird maximiert, bedeutet, dass die Entropie zugenommen hat oder gleich geblieben ist (wenn der Wert, bei dem die Variable festgelegt wurde, zufällig der Gleichgewichtswert ist). Angenommen, wir gehen von einer Gleichgewichtssituation aus und entfernen plötzlich eine Einschränkung für eine Variable. Gleich danach gibt es eine Nummer
von zugänglichen Mikrozuständen, aber das Gleichgewicht wurde noch nicht erreicht, so dass die tatsächlichen Wahrscheinlichkeiten des Systems, das sich in einem zugänglichen Zustand befindet, noch nicht der vorherigen Wahrscheinlichkeit von entsprechen
. Wir haben bereits gesehen, dass im endgültigen Gleichgewichtszustand die Entropie im Vergleich zum vorherigen Gleichgewichtszustand zugenommen hat oder gleich geblieben ist. Boltzmanns H-Theorem beweist jedoch, dass die Menge H. steigt monoton als Funktion der Zeit während des Zwischenzustands außerhalb des Gleichgewichtszustands an.
Ableitung der Entropieänderung für reversible Prozesse[edit]
Der zweite Teil des zweiten Gesetzes besagt, dass die Entropieänderung eines Systems, das einen reversiblen Prozess durchläuft, gegeben ist durch:
wobei die Temperatur definiert ist als:
Hier finden Sie die Begründung für diese Definition. Angenommen, das System verfügt über einen externen Parameter x, der geändert werden kann. Im Allgemeinen hängen die Energieeigenzustände des Systems von x ab. Nach dem adiabatischen Theorem der Quantenmechanik bleibt das System an der Grenze einer unendlich langsamen Änderung des Hamilton-Zustands des Systems im gleichen Energieeigenzustand und ändert somit seine Energie entsprechend der Energieänderung des Energieeigenzustands, in dem es sich befindet.
Die verallgemeinerte Kraft X, die der externen Variablen x entspricht, ist so definiert, dass
ist die vom System ausgeführte Arbeit, wenn x um einen Betrag dx erhöht wird. Wenn beispielsweise x das Volumen ist, ist X der Druck. Die verallgemeinerte Kraft für ein System, von dem bekannt ist, dass es sich im Energieeigenzustand befindet
ist gegeben durch:
Da sich das System innerhalb eines Intervalls von in einem beliebigen Energieeigenzustand befinden kann
definieren wir die verallgemeinerte Kraft für das System als den Erwartungswert des obigen Ausdrucks:
Um den Durchschnitt zu ermitteln, partitionieren wir die
Energieeigenzustände durch Zählen, für wie viele von ihnen einen Wert für haben
innerhalb eines Bereichs zwischen
und
. Diese Nummer anrufen
, wir haben:
Der Durchschnitt, der die verallgemeinerte Kraft definiert, kann nun geschrieben werden:
Wir können dies wie folgt auf die Ableitung der Entropie in Bezug auf x bei konstanter Energie E beziehen. Angenommen, wir ändern x in x + dx. Dann
ändert sich, weil die Energieeigenzustände von x abhängen, wodurch sich die Energieeigenzustände in den Bereich zwischen oder aus dem Bereich zwischen bewegen
und
. Konzentrieren wir uns noch einmal auf die Energieeigenzustände, für die
liegt im Bereich zwischen
und
. Da diese Energieeigenzustände um Y dx an Energie zunehmen, bewegen sich alle diese Energieeigenzustände, die im Intervall von E – Y dx bis E liegen, von unter E nach über E. Es gibt
solche Energieeigenzustände. Wenn
Alle diese Energieeigenzustände bewegen sich in den Bereich zwischen
und
und zu einer Steigerung von beitragen
. Die Anzahl der Energieeigenzustände, die sich von unten bewegen
nach oben
ist gegeben durch
. Der Unterschied
ist somit der Nettobeitrag zum Anstieg in
. Beachten Sie, dass wenn Y dx größer als ist
Es wird die Energieeigenzustände geben, die sich von unten E nach oben bewegen
. Sie werden in beiden gezählt
und
daher gilt der obige Ausdruck auch in diesem Fall.
Das Ausdrücken des obigen Ausdrucks als Ableitung in Bezug auf E und das Summieren über Y ergibt den Ausdruck:
Die logarithmische Ableitung von
in Bezug auf x ist also gegeben durch:
Der erste Begriff ist intensiv, dh er skaliert nicht mit der Systemgröße. Im Gegensatz dazu skaliert der letzte Term als inverse Systemgröße und verschwindet somit in der thermodynamischen Grenze. Wir haben also festgestellt, dass:
Kombiniere dies mit
Gibt:
Ableitung für vom kanonischen Ensemble beschriebene Systeme[edit]
Befindet sich ein System bei einer Temperatur T in thermischem Kontakt mit einem Wärmebad, so wird im Gleichgewicht die Wahrscheinlichkeitsverteilung über die Energieeigenwerte vom kanonischen Ensemble angegeben:
Hier ist Z ein Faktor, der die Summe aller Wahrscheinlichkeiten auf 1 normalisiert. Diese Funktion wird als Partitionsfunktion bezeichnet. Wir betrachten nun eine infinitesimale reversible Änderung der Temperatur und der externen Parameter, von denen die Energieniveaus abhängen. Aus der allgemeinen Formel für die Entropie folgt:
Das
Einfügen der Formel für
für das kanonische Ensemble hier gibt:
Ausgangsbedingungen beim Urknall[edit]
Wie oben ausgeführt, wird angenommen, dass der zweite Hauptsatz der Thermodynamik ein Ergebnis der Anfangsbedingungen mit sehr niedriger Entropie beim Urknall ist. Aus statistischer Sicht waren dies ganz besondere Bedingungen. Andererseits waren sie recht einfach, da das Universum – oder zumindest der Teil davon, aus dem sich das beobachtbare Universum entwickelte – äußerst einheitlich zu sein scheint.[69]
Dies mag etwas paradox erscheinen, da in vielen physikalischen Systemen einheitliche Bedingungen (z. B. gemischte statt getrennte Gase) eine hohe Entropie aufweisen. Das Paradoxon wird gelöst, sobald erkannt wird, dass Gravitationssysteme eine negative Wärmekapazität haben, so dass bei wichtiger Schwerkraft einheitliche Bedingungen (z. B. Gas mit gleichmäßiger Dichte) tatsächlich eine geringere Entropie aufweisen als ungleichmäßige Bedingungen (z. B. Schwarze Löcher im leeren Raum).[70] Ein weiterer Ansatz ist, dass das Universum aufgrund seiner Größe eine hohe (oder sogar maximale) Entropie hatte, aber als das Universum wuchs, kam es schnell aus dem thermodynamischen Gleichgewicht heraus, seine Entropie nahm im Vergleich zur Zunahme der maximal möglichen Entropie nur geringfügig zu und hat es daher kam zu einer sehr niedrigen Entropie im Vergleich zu dem viel größeren möglichen Maximum aufgrund seiner späteren Größe.[71]
Was den Grund betrifft, warum die Anfangsbedingungen so waren, so ist ein Vorschlag, dass die kosmologische Inflation ausreichte, um die Nichtglätte zu beseitigen, während ein anderer darin besteht, dass das Universum spontan geschaffen wurde, wo der Schöpfungsmechanismus Anfangsbedingungen mit niedriger Entropie impliziert.[72]
Lebende Organismen[edit]
Es gibt zwei Hauptmethoden zur Formulierung der Thermodynamik: (a) durch Übergänge von einem Zustand des thermodynamischen Gleichgewichts in einen anderen und (b) durch zyklische Prozesse, bei denen das System unverändert bleibt, während die Gesamtentropie der Umgebung erhöht wird. Diese beiden Möglichkeiten helfen, die Prozesse des Lebens zu verstehen. Die Thermodynamik lebender Organismen wurde von vielen Autoren wie Erwin Schrödinger, Léon Brillouin berücksichtigt[73] und Isaac Asimov.
In angemessener Näherung können lebende Organismen als Beispiele für (b) angesehen werden. Ungefähr der physische Zustand eines Tieres ändert sich von Tag zu Tag und lässt das Tier nahezu unverändert. Tiere nehmen Nahrung, Wasser und Sauerstoff auf und geben aufgrund des Stoffwechsels Abbauprodukte und Wärme ab. Pflanzen nehmen Strahlungsenergie von der Sonne auf, die als Wärme, Kohlendioxid und Wasser angesehen werden kann. Sie geben Sauerstoff ab. Auf diese Weise wachsen sie. Schließlich sterben sie und ihre Überreste verrotten und verwandeln sich größtenteils wieder in Kohlendioxid und Wasser. Dies kann als zyklischer Prozess angesehen werden. Insgesamt stammt das Sonnenlicht von einer Hochtemperaturquelle, der Sonne, und seine Energie wird an eine Senke mit niedrigerer Temperatur weitergeleitet, dh in den Weltraum abgestrahlt. Dies ist eine Zunahme der Entropie der Umgebung der Pflanze. Tiere und Pflanzen gehorchen also dem zweiten Hauptsatz der Thermodynamik, der in Bezug auf zyklische Prozesse betrachtet wird.
Darüber hinaus widerspricht die Fähigkeit lebender Organismen, zu wachsen und an Komplexität zuzunehmen sowie Korrelationen mit ihrer Umwelt in Form von Anpassung und Gedächtnis zu bilden, nicht dem zweiten Gesetz, sondern den daraus resultierenden allgemeinen Ergebnissen : Unter einigen Definitionen führt eine Zunahme der Entropie auch zu einer Zunahme der Komplexität.[74] und für ein endliches System, das mit endlichen Reservoirs interagiert, ist eine Zunahme der Entropie gleichbedeutend mit einer Zunahme der Korrelationen zwischen dem System und den Reservoirs.[75]
Lebende Organismen können als offene Systeme betrachtet werden, da Materie in sie hinein und aus ihnen heraus gelangt. Die Thermodynamik offener Systeme wird derzeit häufig in Form von Durchgängen von einem Zustand des thermodynamischen Gleichgewichts zu einem anderen oder in Form von Strömungen in der Annäherung an das lokale thermodynamische Gleichgewicht betrachtet. Das Problem für lebende Organismen kann durch die Annäherung an die Annahme eines stationären Zustands mit unveränderlichen Strömungen weiter vereinfacht werden. Allgemeine Prinzipien der Entropieproduktion für solche Annäherungen unterliegen einer ungeklärten aktuellen Debatte oder Forschung.
Gravitationssysteme[edit]
Im Allgemeinen haben Systeme, für die die Schwerkraft nicht wichtig ist, eine positive Wärmekapazität, was bedeutet, dass ihre Temperatur mit ihrer inneren Energie steigt. Wenn daher Energie von einem Hochtemperaturobjekt zu einem Niedertemperaturobjekt fließt, nimmt die Quellentemperatur ab, während die Sinkentemperatur erhöht wird; Daher neigen die Temperaturunterschiede dazu, sich mit der Zeit zu verringern.
Dies ist nicht immer der Fall bei Systemen, bei denen die Gravitationskraft wichtig ist: Systeme, die durch ihre eigene Schwerkraft gebunden sind, wie z. B. Sterne, können negative Wärmekapazitäten aufweisen. Während sie sich zusammenziehen, nehmen sowohl ihre Gesamtenergie als auch ihre Entropie ab[76] aber ihre Innentemperatur kann ansteigen. Dies kann für Protosterne und sogar Gasriesenplaneten wie Jupiter von Bedeutung sein.
Da die Schwerkraft die wichtigste Kraft auf kosmologischen Skalen ist, kann es schwierig oder unmöglich sein, das zweite Gesetz auf das gesamte Universum anzuwenden.[77]
Nichtgleichgewichtszustände[edit]
Die Theorie der klassischen oder Gleichgewichtsthermodynamik ist idealisiert. Ein Hauptpostulat oder eine Hauptannahme, die oft nicht einmal explizit angegeben wird, ist die Existenz von Systemen in ihren eigenen internen Zuständen des thermodynamischen Gleichgewichts. Im Allgemeinen befindet sich ein Raumbereich, der zu einem bestimmten Zeitpunkt ein physikalisches System enthält und in der Natur vorkommt, nicht im thermodynamischen Gleichgewicht, was in den strengsten Begriffen gelesen wird. Locker gesagt, nichts im gesamten Universum befindet sich oder war jemals wirklich im exakten thermodynamischen Gleichgewicht.[77][78]
Für physikalische Analysen ist es oft ausreichend zweckmäßig, ein thermodynamisches Gleichgewicht anzunehmen. Eine solche Annahme kann zur Rechtfertigung auf Versuch und Irrtum beruhen. Wenn die Annahme gerechtfertigt ist, kann sie oft sehr wertvoll und nützlich sein, da sie die Theorie der Thermodynamik zur Verfügung stellt. Elemente der Gleichgewichtsannahme sind, dass beobachtet wird, dass sich ein System über eine unbegrenzt lange Zeit nicht ändert, und dass sich so viele Partikel in einem System befinden, dass seine partikuläre Natur vollständig ignoriert werden kann. Unter einer solchen Gleichgewichtsannahme gibt es im Allgemeinen keine makroskopisch nachweisbaren Schwankungen. Es gibt eine Ausnahme, den Fall kritischer Zustände, die mit bloßem Auge das Phänomen der kritischen Opaleszenz zeigen. Für Laboruntersuchungen kritischer Zustände sind außergewöhnlich lange Beobachtungszeiten erforderlich.
In allen Fällen impliziert die einmal angenommene Annahme eines thermodynamischen Gleichgewichts als Konsequenz, dass kein mutmaßlicher Kandidat vorliegt “Fluktuation” verändert die Entropie des Systems.
Es kann leicht vorkommen, dass ein physikalisches System interne makroskopische Änderungen aufweist, die schnell genug sind, um die Annahme der Konstanz der Entropie ungültig zu machen. Oder dass ein physikalisches System so wenige Partikel hat, dass sich die partikuläre Natur in beobachtbaren Schwankungen manifestiert. Dann ist die Annahme eines thermodynamischen Gleichgewichts aufzugeben. Es gibt keine uneingeschränkte allgemeine Definition der Entropie für Nichtgleichgewichtszustände.[79]
Es gibt Zwischenfälle, in denen die Annahme eines lokalen thermodynamischen Gleichgewichts eine sehr gute Annäherung darstellt.[80][81][82][83] aber genau genommen ist es immer noch eine Annäherung, theoretisch nicht ideal.
Für Nichtgleichgewichtssituationen im Allgemeinen kann es nützlich sein, statistische mechanische Definitionen anderer Größen zu berücksichtigen, die zweckmäßigerweise als “Entropie” bezeichnet werden können, sie sollten jedoch nicht mit der für den zweiten Hauptsatz richtig definierten thermodynamischen Entropie verwechselt oder in Konflikt gebracht werden. Diese anderen Größen gehören in der Tat zur statistischen Mechanik, nicht zur Thermodynamik, dem Hauptbereich des zweiten Hauptsatzes.
Die Physik makroskopisch beobachtbarer Schwankungen geht über den Rahmen dieses Artikels hinaus.
Pfeil der Zeit[edit]
Der zweite Hauptsatz der Thermodynamik ist ein physikalisches Gesetz, das nicht symmetrisch zur Umkehrung der Zeitrichtung ist. Dies steht nicht im Widerspruch zu den in den Grundgesetzen der Physik beobachteten Symmetrien (insbesondere der CPT-Symmetrie), da das zweite Gesetz statistisch für zeitasymmetrische Randbedingungen gilt.[84] Das zweite Gesetz bezieht sich auf den Unterschied zwischen zeitlichem Vorwärts- und Rückwärtsbewegen oder auf das Prinzip, dass Ursache der Wirkung vorausgeht (der kausale Zeitpfeil oder die Kausalität).[85]
Irreversibilität[edit]
Die Irreversibilität bei thermodynamischen Prozessen ist eine Folge des asymmetrischen Charakters thermodynamischer Operationen und nicht der intern irreversiblen mikroskopischen Eigenschaften der Körper. Thermodynamische Operationen sind makroskopische externe Eingriffe, die den beteiligten Körpern auferlegt werden und nicht aus ihren internen Eigenschaften abgeleitet werden. Es gibt angebliche “Paradoxe” die entstehen, wenn man dies nicht erkennt.
Loschmidts Paradoxon[edit]
Loschmidts Paradoxon, auch als Reversibilitätsparadoxon bekannt, ist der Einwand, dass es nicht möglich sein sollte, einen irreversiblen Prozess aus der zeitsymmetrischen Dynamik abzuleiten, die die mikroskopische Entwicklung eines makroskopischen Systems beschreibt.
Nach Meinung von Schrödinger, “Es ist jetzt ziemlich offensichtlich, auf welche Weise Sie das Entropiegesetz – oder auch alle anderen irreversiblen Aussagen – neu formulieren müssen, damit sie aus reversiblen Modellen abgeleitet werden können. Sie dürfen nicht von einem isolierten System sprechen, sondern von mindestens zwei, die Sie im Moment als isoliert vom Rest der Welt betrachten können, aber nicht immer voneinander.”[86] Die beiden Systeme sind durch die Wand voneinander isoliert, bis sie durch den vom Gesetz vorgesehenen thermodynamischen Betrieb entfernt werden. Der thermodynamische Betrieb wird extern auferlegt und unterliegt nicht den reversiblen mikroskopischen dynamischen Gesetzen, die die Bestandteile der Systeme bestimmen. Es ist die Ursache für die Irreversibilität. Die Gesetzeserklärung in diesem Artikel entspricht dem Rat von Schrödinger. Die Ursache-Wirkungs-Beziehung steht logischerweise vor dem zweiten Gesetz und ist nicht davon abgeleitet.
Poincaré-Wiederholungssatz[edit]
Das Poincaré-Rezidiv-Theorem betrachtet eine theoretische mikroskopische Beschreibung eines isolierten physikalischen Systems. Dies kann als Modell eines thermodynamischen Systems angesehen werden, nachdem ein thermodynamischer Vorgang eine Innenwand entfernt hat. Das System kehrt nach einer ausreichend langen Zeit in einen mikroskopisch definierten Zustand zurück, der dem ursprünglichen sehr nahe kommt. Die Poincaré-Wiederholungszeit ist die Zeitspanne bis zur Rückkehr. Es ist außerordentlich lang, wahrscheinlich länger als das Leben des Universums und hängt empfindlich von der Geometrie der Wand ab, die durch die thermodynamische Operation entfernt wurde. Der Wiederholungssatz kann als scheinbar im Widerspruch zum zweiten Hauptsatz der Thermodynamik stehend angesehen werden. Offensichtlicher ist es jedoch einfach ein mikroskopisches Modell des thermodynamischen Gleichgewichts in einem isolierten System, das durch Entfernen einer Wand zwischen zwei Systemen gebildet wird. Für ein typisches thermodynamisches System ist die Wiederholungszeit so groß (viele, viele Male länger als die Lebensdauer des Universums), dass man die Wiederholung für alle praktischen Zwecke nicht beobachten kann. Man könnte sich dennoch vorstellen, dass man auf die Wiederholung von Poincaré warten und dann die durch den thermodynamischen Vorgang entfernte Wand wieder einsetzen könnte. Es ist dann offensichtlich, dass das Auftreten von Irreversibilität auf die völlige Unvorhersehbarkeit des Poincaré-Wiederauftretens zurückzuführen ist, nur wenn der Ausgangszustand ein thermodynamisches Gleichgewicht war, wie dies in der makroskopischen Thermodynamik der Fall ist. Selbst wenn man darauf warten könnte, hat man keine praktische Möglichkeit, den richtigen Zeitpunkt für das Wiedereinsetzen der Wand auszuwählen. Der Poincaré-Wiederholungssatz bietet eine Lösung für Loschmidts Paradoxon. Wenn ein isoliertes thermodynamisches System über immer mehr Vielfache der durchschnittlichen Poincaré-Wiederholungszeit überwacht werden könnte, würde das thermodynamische Verhalten des Systems unter Zeitumkehr unveränderlich werden.

Maxwells Dämon[edit]
James Clerk Maxwell stellte sich einen Behälter vor, der in zwei Teile geteilt war. EIN und B.. Beide Teile werden bei gleichen Temperaturen mit dem gleichen Gas gefüllt und nebeneinander angeordnet, durch eine Wand getrennt. Ein imaginärer Dämon beobachtet die Moleküle auf beiden Seiten und bewacht eine mikroskopisch kleine Falltür in der Wand. Wenn ein überdurchschnittlich schnelles Molekül aus EIN fliegt auf die Falltür zu, der Dämon öffnet sie und das Molekül fliegt davon EIN zu B.. Die durchschnittliche Geschwindigkeit der Moleküle in B. wird während in erhöht haben EIN Sie werden sich im Durchschnitt verlangsamt haben. Da die durchschnittliche Molekülgeschwindigkeit der Temperatur entspricht, nimmt die Temperatur in ab EIN und nimmt zu B.entgegen dem zweiten Hauptsatz der Thermodynamik.
Eine Antwort auf diese Frage wurde 1929 von Leó Szilárd und später von Léon Brillouin vorgeschlagen. Szilárd wies darauf hin, dass ein realer Maxwell-Dämon ein Mittel zur Messung der molekularen Geschwindigkeit benötigen würde und dass der Erwerb von Informationen einen Energieaufwand erfordern würde.
Maxwells ‘Dämon’ verändert wiederholt die Durchlässigkeit der Wand dazwischen EIN und B.. Es führt daher thermodynamische Operationen im mikroskopischen Maßstab durch und beobachtet nicht nur gewöhnliche spontane oder natürliche makroskopische thermodynamische Prozesse.
Zitate[edit]
Das Gesetz, dass die Entropie immer zunimmt, hat meines Erachtens die höchste Stellung unter den Naturgesetzen. Wenn Sie jemand darauf hinweist, dass Ihre Haustier-Theorie des Universums nicht mit Maxwells Gleichungen übereinstimmt – umso schlimmer für Maxwells Gleichungen. Wenn sich herausstellt, dass dies durch Beobachtung widerlegt wird – nun, diese Experimentatoren verpfuschen manchmal Dinge. Aber wenn sich herausstellt, dass Ihre Theorie gegen den zweiten Hauptsatz der Thermodynamik verstößt, kann ich Ihnen keine Hoffnung geben. es bleibt nichts anderes übrig, als in tiefster Demütigung zusammenzubrechen.
Es gab fast so viele Formulierungen des zweiten Gesetzes wie Diskussionen darüber.
Clausius ist der Autor der sibyllischen Äußerung, “Die Energie des Universums ist konstant; Die Entropie des Universums tendiert zu einem Maximum.” Die Ziele der Kontinuumsthermomechanik bleiben weit hinter der Erklärung der “Universum”, aber innerhalb dieser Theorie können wir leicht eine explizite Aussage ableiten, die in gewisser Weise an Clausius erinnert, sich aber nur auf ein bescheidenes Objekt bezieht: einen isolierten Körper endlicher Größe.
– –Truesdell, C., Muncaster, RG (1980). Grundlagen von Maxwells kinetischer Theorie eines einfachen monatomaren Gases, das als Zweig der rationalen Mechanik behandelt wird, Academic Press, New York, ISBN 0-12-701350-4, p. 17.Siehe auch[edit]
Verweise[edit]
- ^ “5.2 Axiomatische Aussagen der Gesetze der Thermodynamik”. www.web.mit.edu. Massachusetts Institute of Technology.
- ^ Zohuri, Bahman (2016). Dimensionsanalyse jenseits des Pi-Theorems. Springer. p. 111. ISBN 978-3-319-45726-0.
- ^ Jaffe, RL, Taylor, W. (2018). Die Physik der Energie, Cambridge University Press, Cambridge, Großbritannien, Seiten 150, 151, 259, 772, 743.
- ^ David L. Chandler (19.05.2011). “Erklärt: Die Carnot-Grenze”.
- ^ Planck, M. (1897/1903), S. 40–41.
- ^ Munster A. (1970), S. 8–9, 50–51.
- ^ Mandl 1988
- ^ Planck, M. (1897/1903), S. 79–107.
- ^ Bailyn, M. (1994), Section 71, S. 113–154.
- ^ Bailyn, M. (1994), p. 120.
- ^ ein b c Mortimer, RG Physikalische Chemie. 3rd ed., P. 120, Academic Press, 2008.
- ^ Fermi, E. Thermodynamik, Fußnote auf S. 48, Dover Publications, 1956 (noch in gedruckter Form).
- ^ Adkins, CJ (1968/1983), p. 75.
- ^ ein b c Münster, A. (1970), p. 45.
- ^ ein b c Schmidt-Rohr, K. (2014). “Expansionsarbeiten ohne Außendruck und Thermodynamik im Sinne quasistatischer irreversibler Prozesse” J. Chem. Educ. 91: 402-409. https://dx.doi.org/10.1021/ed3008704
- ^ ein b Oxtoby, D. W; Gillis, HP, Butler, LJ (2015).Prinzipien der modernen Chemie, Brooks Cole. p. 617. ISBN 978-1305079113
- ^ Pokrovskii VN (2005) Erweiterte Thermodynamik in einem diskreten Systemansatz, Eur. J. Phys. vol. 26, 769–781.
- ^ Pokrovskii, Vladimir N. (2013). “Eine Ableitung der Hauptbeziehungen der Nichtgleichgewichtsthermodynamik”. ISRN Thermodynamik. 2013: 1–9. doi:10.1155 / 2013/906136.
- ^ JS Dugdale (1996). Entropie und ihre physikalische Bedeutung. Taylor & Francis. p. 13. ISBN 978-0-7484-0569-5.
Dieses Gesetz ist die Grundlage der Temperatur.
- ^ Zemansky, MW (1968), S. 207–209.
- ^ Quinn, TJ (1983), p. 8.
- ^ “Konzept und Aussagen des zweiten Gesetzes”. web.mit.edu. Abgerufen 07.10.2010.
- ^ Carnot, S. (1824/1986).
- ^ Carnot, S. (1824/1986), p. 51.
- ^ Carnot, S. (1824/1986), p. 46.
- ^ Carnot, S. (1824/1986), p. 68.
- ^ Truesdell, C. (1980), Kapitel 5.
- ^ Adkins, CJ (1968/1983), S. 56–58.
- ^ Münster, A. (1970), p. 11.
- ^ Kondepudi, D., Prigogine, I. (1998), S. 67–75.
- ^ Lebon, G., Jou, D., Casas-Vázquez, J. (2008), p. 10.
- ^ Eu, BC (2002), S. 32–35.
- ^ Planck, M. (1897/1903), p. 86.
- ^ Roberts, JK, Miller, AR (1928/1960), p. 319.
- ^ ter Haar, D., Wergeland, H. (1966), p. 17.
- ^ Rao, YVC (1997). Chemische Technik Thermodynamik. Universitätspresse. p. 158. ISBN 978-81-7371-048-3.
- ^ Planck, M. (1897/1903), p. 100.
- ^ Planck, M. (1926), p. 463, Übersetzung von Uffink, J. (2003), p. 131.
- ^ Roberts, JK, Miller, AR (1928/1960), p. 382. Diese Quelle stammt teilweise wörtlich aus Plancks Aussage, zitiert jedoch nicht Planck. Diese Quelle nennt die Aussage das Prinzip der Erhöhung der Entropie.
- ^ Uhlenbeck, GE, Ford, GW (1963), p. 16.
- ^ Carathéodory, C. (1909).
- ^ Buchdahl, HA (1966), p. 68.
- ^ Sychev, VV (1991). Die Differentialgleichungen der Thermodynamik. Taylor & Francis. ISBN 978-1-56032-121-7.
- ^ ein b Planck, M. (1926).
- ^ Buchdahl, HA (1966), p. 69.
- ^ Uffink, J. (2003), S. 129–132.
- ^ Truesdell, C., Muncaster, RG (1980). Grundlagen von Maxwells kinetischer Theorie eines einfachen monatomaren Gases, das als Zweig der rationalen Mechanik behandelt wird, Akademische Presse, New York, ISBN 0-12-701350-4, p. 15.
- ^ Planck, M. (1897/1903), p. 81.
- ^ Planck, M. (1926), p. 457, Übersetzung des Wikipedia-Herausgebers.
- ^ Lieb, EH, Yngvason, J. (2003), p. 149.
- ^ Borgnakke, C., Sonntag., RE (2009), p. 304.
- ^ van Gool, W.; Bruggink, JJC (Hrsg.) (1985). Energie und Zeit in den Wirtschafts- und Physikwissenschaften. Nordholland. S. 41–56. ISBN 978-0-444-87748-2.CS1-Wartung: zusätzlicher Text: Autorenliste (Link)
- ^ Grubbström, Robert W. (2007). “Ein Versuch, Dynamik in allgemeine Exergieüberlegungen einzuführen”. Angewandte Energie. 84 (7–8): 701–718. doi:10.1016 / j.apenergy.2007.01.003.
- ^ Clausius-Theorem bei Wolfram Research
- ^ Denbigh, KG, Denbigh, JS (1985). Entropie in Bezug auf unvollständiges Wissen, Cambridge University Press, Cambridge, Großbritannien ISBN 0-521-25677-1, S. 43–44.
- ^ Grandy, WT, Jr. (2008). Entropie und die zeitliche Entwicklung makroskopischer Systeme, Oxford University Press, Oxford, ISBN 978-0-19-954617-6, S. 55–58.
- ^ Entropie-Sites – Ein Leitfaden Inhalt ausgewählt von Frank L. Lambert
- ^ Gyenis, Balazs (2017). “Maxwell und die Normalverteilung: Eine farbige Geschichte von Wahrscheinlichkeit, Unabhängigkeit und Tendenz zum Gleichgewicht”. Studium der Geschichte und Philosophie der modernen Physik. 57: 53–65. arXiv:1702.01411. Bibcode:2017SHPMP..57 … 53G. doi:10.1016 / j.shpsb.2017.01.001. S2CID 38272381.
- ^ Hawking, SW (1985). “Zeitpfeil in der Kosmologie”. Phys. Rev. D.. 32 (10): 2489–2495. Bibcode:1985PhRvD..32.2489H. doi:10.1103 / PhysRevD.32.2489. PMID 9956019.
- ^ Greene, Brian (2004). Der Stoff des Kosmos. Alfred A. Knopf. p. 171. ISBN 978-0-375-41288-2.
- ^ Lebowitz, Joel L. (September 1993). “Boltzmanns Entropie und Zeitpfeil” (PDF). Physik heute. 46 (9): 32–38. Bibcode:1993PhT …. 46i..32L. doi:10.1063 / 1.881363. Abgerufen 2013-02-22.
- ^ Carroll, S. (2017). Das große Ganze: über die Ursprünge des Lebens, den Sinn und das Universum selbst. Pinguin.
- ^ Greene, B. (2004). Das Gewebe des Kosmos: Raum, Zeit und die Textur der Realität. Knopf.
- ^ Davies, PC (1983). Inflation und Zeitasymmetrie im Universum. Nature, 301 (5899), 398 & ndash; 400.
- ^ Physiker diskutieren Hawkings Idee, dass das Universum keinen Anfang hatte. Wolchover, N. Quantmagazine, 6. Juni 2019. Abgerufen am 28.11.2020
- ^ Léon Brillouin Wissenschafts- und Informationstheorie (Academic Press, 1962) (Dover, 2004)
- ^ Ladyman, J.; Lambert, J.; Weisner, KB Was ist ein komplexes System? EUR. J. Philos. Sci. 2013, 3, 33–67.
- ^ M. Esposito, K. Lindenberg & C. Van den Broeck (2010). Entropieproduktion als Korrelation zwischen System und Reservoir. New Journal of Physics, 12 (1), 013013.
- ^ Baez, John (7. August 2000). “Kann die Schwerkraft die Entropie verringern?”. UC Riverside Department für Mathematik. University of California Riverside. Abgerufen 7. Juni 2020.
… gravitativ gebundener Gaskugel hat eine negative spezifische Wärme!
- ^ ein b Grandy, WT (Jr) (2008), p. 151.
- ^ Callen, HB (1960/1985), p. 15.
- ^ Lieb, EH, Yngvason, J. (2003), p. 190.
- ^ Gyarmati, I. (1967/1970), S. 4-14.
- ^ Glansdorff, P., Prigogine, I. (1971).
- ^ Müller, I. (1985).
- ^ Müller, I. (2003).
- ^ Callender, Craig (29. Juli 2011). “Thermodynamische Asymmetrie in der Zeit”. Stanford Encyclopedia of Philosophy.
- ^ Halliwell, JJ; et al. (1994). Physikalische Ursprünge der Zeitasymmetrie. Cambridge. ISBN 978-0-521-56837-1. Kapitel 6
- ^ Schrödinger, E. (1950), p. 192.
Quellen[edit]
- Adkins, CJ (1968/1983). Gleichgewichtsthermodynamik, (1. Auflage 1968), 3. Auflage 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0.
- Atkins, PW, de Paula, J. (2006). Atkins ‘Physikalische Chemie, achte Ausgabe, WH Freeman, New York, ISBN 978-0-7167-8759-4.
- Attard, P. (2012). Nichtgleichgewichtsthermodynamik und statistische Mechanik: Grundlagen und Anwendungen, Oxford University Press, Oxford Großbritannien, ISBN 978-0-19-966276-0.
- Baierlein, R. (1999). Thermische Physik, Cambridge University Press, Cambridge, Großbritannien ISBN 0-521-59082-5.
- Bailyn, M. (1994). Ein Überblick über die Thermodynamik, Amerikanisches Institut für Physik, New York, ISBN 0-88318-797-3.
- Blundell, Stephen J.; Blundell, Katherine M. (2010). Konzepte in der thermischen Physik (2. Aufl.). Oxford: Oxford University Press. doi:10.1093 / acprof: oso / 9780199562091.001.0001. ISBN 9780199562107. OCLC 607907330.
- Boltzmann, L. (1896/1964). Vorlesungen zur Gastheorie, übersetzt von SG Brush, University of California Press, Berkeley.
- Borgnakke, C., Sonntag., RE (2009). Grundlagen der Thermodynamik, siebte Ausgabe, Wiley, ISBN 978-0-470-04192-5.
- Buchdahl, HA (1966). Die Konzepte der klassischen Thermodynamik, Cambridge University Press, Cambridge, Großbritannien.
- Bridgman, PW (1943). Die Natur der Thermodynamik, Harvard University Press, Cambridge, MA.
- Callen, HB (1960/1985). Thermodynamik und eine Einführung in die Thermostatistik, (1. Auflage 1960) 2. Auflage 1985, Wiley, New York, ISBN 0-471-86256-8.
- C. Carathéodory (1909). “Untersuchungen über die Grundlagen der Thermodynamik”. Mathematische Annalen. 67 (3): 355–386. doi:10.1007 / bf01450409. S2CID 118230148.
Axiom II: In jeder einzelnen Umgebung eines willkürlich wechselnen Anfangszustands gibt es Zustände, die durch adiabatische Qualitätsänderungen nicht jedenig approximiert werden können. (S.363)
. Eine Übersetzung kann gefunden werden Hier. Auch meist meist zuverlässig Übersetzung ist zu finden bei Kestin, J. (1976). Der zweite Hauptsatz der Thermodynamik, Dowden, Hutchinson & Ross, Stroudsburg PA. - Carnot, S. (1824/1986). Reflexionen über die Antriebskraft des Feuers, Manchester University Press, Manchester Großbritannien, ISBN 0-7190-1741-6. Auch hier.
- Chapman, S., Cowling, TG (1939/1970). Die mathematische Theorie ungleichmäßiger Gase. Ein Bericht über die kinetische Theorie von Viskosität, Wärmeleitung und Diffusion in Gasen, dritte Ausgabe 1970, Cambridge University Press, London.
- Clausius, R. (1850). “Ueber Die Bewegende Kraft Der Wärme Und Die Gesetze, Welche Sich Daraus Für Die Wärmelehre Selbst Ableiten Lassen”. Annalen der Physik. 79 (4): 368–397, 500–524. Bibcode:1850AnP … 155..500C. doi:10.1002 / andp.18501550403. hdl:2027 / uc1. $ B242250. Abgerufen 26. Juni 2012. Ins Englische übersetzt: Clausius, R. (Juli 1851). “Über die sich bewegende Kraft der Wärme und die daraus ableitbaren Gesetze zur Natur der Wärme”. London, Edinburgh und Dublin Philosophical Magazine und Journal of Science. 4 .. 2 (VIII): 1–21, 102–119. doi:10.1080 / 14786445108646819. Abgerufen 26. Juni 2012.
- Clausius, R. (1854). “Über eine bestimmte Form des zweiten Hauptsatzes der Wärmetheorie” (PDF). Annalen der Physik. xciii (12): 481–506. Bibcode:1854AnP … 169..481C. doi:10.1002 / andp.18541691202. Abgerufen 24. März 2014. Ins Englische übersetzt: Clausius, R. (Juli 1856). “Über eine modifizierte Form des zweiten Fundamentalsatzes in der mechanischen Theorie der Wärme”. London, Edinburgh und Dublin Philosophical Magazine und Journal of Science. 4 .. 2: 86. Abgerufen 24. März 2014. Nachdruck in: Clausius, R. (1867). Die mechanische Theorie der Wärme – mit ihren Anwendungen auf die Dampfmaschine und auf die physikalischen Eigenschaften von Körpern. London: John van Voorst. Abgerufen 19. Juni 2012.
Ausgaben: PwR_Sbkwa8IC.
- Denbigh, K. (1954/1981). Die Prinzipien des chemischen Gleichgewichts. Mit Anwendungen in Chemie und Chemieingenieurwesen, vierte Ausgabe, Cambridge University Press, Cambridge UK, ISBN 0-521-23682-7.
- Eu, BC (2002). Verallgemeinerte Thermodynamik. Die Thermodynamik irreversibler Prozesse und die verallgemeinerte Hydrodynamik, Kluwer Academic Publishers, Dordrecht, ISBN 1-4020-0788-4.
- Gibbs, JW (1876/1878). Zum Gleichgewicht heterogener Substanzen, Trans. Conn. Acad., 3: 108–248, 343–524, nachgedruckt in Die gesammelten Werke von J. Willard Gibbs, Ph.D., LL. D. D., herausgegeben von WR Longley, RG Van Name, Longmans, Green & Co., New York, 1928, Band 1, S. 55–353.
- Griem, HR (2005). Prinzipien der Plasmaspektroskopie (Cambridge Monographs on Plasma Physics), Cambridge University Press, New York ISBN 0-521-61941-6.
- Glansdorff, P., Prigogine, I. (1971). Thermodynamische Theorie von Struktur, Stabilität und Schwankungen, Wiley-Interscience, London, 1971, ISBN 0-471-30280-5.
- Grandy, WT, Jr. (2008). Entropie und die zeitliche Entwicklung makroskopischer Systeme. Oxford University Press. ISBN 978-0-19-954617-6.
- Greven, A., Keller, G., Warnecke (Herausgeber) (2003). Entropie, Princeton University Press, Princeton, NJ, ISBN 0-691-11338-6.
- Guggenheim, EA (1949). ‘Statistische Grundlagen der Thermodynamik’, Forschung, 2: 450–454.
- Guggenheim, EA (1967). Thermodynamik. Eine fortschrittliche Behandlung für Chemiker und Physiker, fünfte überarbeitete Ausgabe, Nordholland, Amsterdam.
- Gyarmati, I. (1967/1970) Nichtgleichgewichtsthermodynamik. Feldtheorie und Variationsprinzipien, übersetzt von E. Gyarmati und WF Heinz, Springer, New York.
- Kittel, C., Kroemer, H. (1969/1980). Thermische Physik, zweite Ausgabe, Freeman, San Francisco CA, ISBN 0-7167-1088-9.
- Kondepudi, D., Prigogine, I. (1998). Moderne Thermodynamik: Von Wärmekraftmaschinen zu dissipativen Strukturen, John Wiley & Sons, Chichester, ISBN 0-471-97393-9.
- G. Lebon, D. Jou, J. Casas-Vázquez (2008). Nichtgleichgewichtsthermodynamik verstehen: Grundlagen, Anwendungen, Grenzen, Springer-Verlag, Berlin, ISBN 978-3-540-74252-4.
- Lieb, EH; Yngvason, J. (1999). “Die Physik und Mathematik des zweiten Hauptsatzes der Thermodynamik”. Physikberichte. 310 (1): 1–96. arXiv:cond-mat / 9708200. Bibcode:1999PhR … 310 …. 1L. doi:10.1016 / S0370-1573 (98) 00082-9. S2CID 119620408.
- Lieb, EH, Yngvason, J. (2003). Die Entropie der klassischen Thermodynamik, S. 147–195, Kapitel 8 von EntropieA. Greven, G. Keller, Warnecke (Herausgeber) (2003).
- Mandl, F. (1988). Statistische Physik (zweite Ausgabe). Wiley & Sons. ISBN 978-0-471-91533-1.
- Maxwell, JC (1867). “Zur dynamischen Theorie der Gase”. Phil. Trans. R. Soc. Lond. 157: 49–88. doi:10.1098 / rstl.1867.0004. S2CID 96568430.
- Müller, I. (1985). Thermodynamik, Pitman, London, ISBN 0-273-08577-8.
- Müller, I. (2003). Entropie im Nichtgleichgewicht, S. 79–109, Kapitel 5 von EntropieA. Greven, G. Keller, Warnecke (Herausgeber) (2003).
- Münster, A. (1970), Klassische Thermodynamik, übersetzt von ES Halberstadt, Wiley-Interscience, London, ISBN 0-471-62430-6.
- Pippard, AB (1957/1966). Elemente der klassischen Thermodynamik für fortgeschrittene Physikstudenten, Originalveröffentlichung 1957, Nachdruck 1966, Cambridge University Press, Cambridge UK.
- Planck, M. (1897/1903). Abhandlung über Thermodynamik, übersetzt von A. Ogg, Longmans Green, London, p. 100.
- Planck. M. (1914). Die Theorie der Wärmestrahlung, eine Übersetzung von Masius, M. der zweiten deutschen Ausgabe, P. Blakistons Son & Co., Philadelphia.
- Planck, M. (1926). Über die Begründung des zweiten Hauptsatzes der Thermodynamik, Sitzungsberichte der Preußischen Akademie der Wissenschaften: Physikalisch-mathematische Klasse: 453–463.
- Pokrovskii VN (2005) Erweiterte Thermodynamik in einem diskreten Systemansatz, Eur. J. Phys. vol. 26, 769–781.
- Pokrovskii, Vladimir N. (2013). “Eine Ableitung der Hauptbeziehungen der Nichtgleichgewichtsthermodynamik”. ISRN Thermodynamik. 2013: 1–9. doi:10.1155 / 2013/906136.
- Quinn, TJ (1983). Temperatur, Akademische Presse, London, ISBN 0-12-569680-9.
- Rao, YVC (2004). Eine Einführung in die Thermodynamik. Universitätspresse. p. 213. ISBN 978-81-7371-461-0.
- Roberts, JK, Miller, AR (1928/1960). Wärme und Thermodynamik, (Erstausgabe 1928), fünfte Ausgabe, Blackie & Son Limited, Glasgow.
- Schrödinger, E. (1950). Irreversibilität, Proc. R. Ir. Acad., A53: 189–195.
- ter Haar, D., Wergeland, H. (1966). Elemente der Thermodynamik, Addison-Wesley Publishing, Lesen MA.
- Thomson, W. (1851). “Zur dynamischen Theorie der Wärme mit numerischen Ergebnissen, die sich aus Joules Äquivalent einer thermischen Einheit und den Beobachtungen von M. Regnault über Dampf ergeben”. Transaktionen der Royal Society of Edinburgh. XX (Teil II): 261–268, 289–298. Auch veröffentlicht in Thomson, W. (Dezember 1852). “Zur dynamischen Theorie der Wärme mit numerischen Ergebnissen, die sich aus Joules Äquivalent einer thermischen Einheit und den Beobachtungen von M. Regnault über Dampf ergeben”. Philos. Mag. 4. IV (22): 13. Abgerufen 25. Juni 2012.
- Thomson, W. (1852). Über die universelle Tendenz in der Natur zur Ableitung mechanischer Energie Philosophical Magazine, Ser. 4, p. 304.
- Tisza, L. (1966). Verallgemeinerte Thermodynamik, MIT Press, Cambridge, MA.
- Truesdell, C. (1980). Die tragikomische Geschichte der Thermodynamik 1822–1854, Springer, New York, ISBN 0-387-90403-4.
- Uffink, J. (2001). Bluffe deinen Weg im zweiten Hauptsatz der Thermodynamik, Zucht. Hist. Phil. Mod. Phys., 32(3): 305–394.
- Uffink, J. (2003). Irreversibilität und der zweite Hauptsatz der Thermodynamik, Kapitel 7 von Entropie, Greven, A., Keller, G., Warnecke (Herausgeber) (2003), Princeton University Press, Princeton, NJ, ISBN 0-691-11338-6.
- Uhlenbeck, GE, Ford, GW (1963). Vorlesungen in statistischer Mechanik, Amerikanische Mathematische Gesellschaft, Providence RI.
- Zemansky, MW (1968). Wärme und Thermodynamik. Ein Zwischenlehrbuch, fünfte Ausgabe, McGraw-Hill Book Company, New York.
Weiterführende Literatur[edit]
- Goldstein, Martin und Inge F., 1993. Der Kühlschrank und das Universum. Harvard Univ. Drücken Sie. Chpts. 4–9 enthalten eine Einführung in das zweite Gesetz, die etwas weniger technisch ist als dieser Eintrag. ISBN 978-0-674-75324-2
- Leff, Harvey S. und Rex, Andrew F. (Hrsg.) 2003. Maxwells Dämon 2: Entropie, klassische und Quanteninformation, Computer. Bristol UK; Philadelphia PA: Institut für Physik. ISBN 978-0-585-49237-7
- Halliwell, JJ (1994). Physikalische Ursprünge der Zeitasymmetrie. Cambridge. ISBN 978-0-521-56837-1.(technisch).
- Carnot, Sadi (1890). Thurston, Robert Henry (Hrsg.). Überlegungen zur Antriebskraft der Wärme und zu Maschinen, die zur Entwicklung dieser Kraft geeignet sind. New York: J. Wiley & Sons. ((Volltext von 1897 ed.) (html)
- Stephen Jay Kline (1999). Der Überblick über Entropie und interpretative Thermodynamik, La Cañada, CA: DCW Industries. ISBN 1-928729-01-0.
- Kostic, M. (2011). Wiederholung des zweiten Gesetzes des Energieabbaus und der Entropieerzeugung: Von Sadi Carnots genialem Denken zur ganzheitlichen Verallgemeinerung. AIP Conf. Proc. AIP Konferenzbeiträge. 1411. S. 327–350. Bibcode:2011AIPC.1411..327K. CiteSeerX 10.1.1.405.1945. doi:10.1063 / 1.3665247. ISBN 978-0-7354-0985-9. auch bei [1].
Externe Links[edit]
- Stanford Encyclopedia of Philosophy: “Philosophie der statistischen Mechanik” – von Lawrence Sklar.
- Zweiter Hauptsatz der Thermodynamik im MIT-Kurs Einheitliche Thermodynamik und Antrieb von Prof. ZS Spakovszky
- ET Jaynes, 1988, “Die Entwicklung von Carnots Prinzip,” in GJ Erickson und CR Smith (Hrsg.)Maximum-Entropy and Bayesian Methods in Science and Engineering 1: p. 267.
- Caratheodory, C., “Untersuchung der Grundlagen der Thermodynamik,” trans. von DH Delphenich
- Der zweite Hauptsatz der Thermodynamik, BBC Radio 4 Diskussion mit John Gribbin, Peter Atkins & Monica Grady (In unserer Zeit, 16. Dezember 2004)
- Entropy (Zeitschrift), 2004
- Das Journal der Internationalen Gesellschaft für Geschichte der Wissenschaftstheorie, 2012

 T.
T.
 Beschreibung der Abweichung eines thermodynamischen Systems im physikalischen Gleichgewicht (mit dem erforderlichen genau definierten gleichmäßigen Druck P. und Temperatur T.)[15] Aus dem chemischen Gleichgewichtszustand kann man die Gleichheit erfassen
Beschreibung der Abweichung eines thermodynamischen Systems im physikalischen Gleichgewicht (mit dem erforderlichen genau definierten gleichmäßigen Druck P. und Temperatur T.)[15] Aus dem chemischen Gleichgewichtszustand kann man die Gleichheit erfassen

 vom kühleren Reservoir zum heißeren, was gegen die Clausius-Aussage verstößt. (Dies ist eine Folge des ersten Hauptsatzes der Thermodynamik, da die Energie des Gesamtsystems gleich bleibt.
vom kühleren Reservoir zum heißeren, was gegen die Clausius-Aussage verstößt. (Dies ist eine Folge des ersten Hauptsatzes der Thermodynamik, da die Energie des Gesamtsystems gleich bleibt.  , also deshalb
, also deshalb  ). Ein Verstoß gegen die Kelvin-Aussage impliziert also einen Verstoß gegen die Clausius-Aussage, dh die Clausius-Aussage impliziert die Kelvin-Aussage. Wir können auf ähnliche Weise beweisen, dass die Kelvin-Aussage die Clausius-Aussage impliziert, und daher sind die beiden gleichwertig.
). Ein Verstoß gegen die Kelvin-Aussage impliziert also einen Verstoß gegen die Clausius-Aussage, dh die Clausius-Aussage impliziert die Kelvin-Aussage. Wir können auf ähnliche Weise beweisen, dass die Kelvin-Aussage die Clausius-Aussage impliziert, und daher sind die beiden gleichwertig.
 .[48][
.[48][



 ist eine feste Referenztemperatur: die Temperatur des Tripelpunktes von Wasser. Dann für jeden T.2 und T.3,
ist eine feste Referenztemperatur: die Temperatur des Tripelpunktes von Wasser. Dann für jeden T.2 und T.3,




 ist pfadunabhängig für reversible Prozesse.
ist pfadunabhängig für reversible Prozesse.



 , so
, so  .
.














 die Summe der Entropieproduktionsrate aller Prozesse innerhalb des Systems. Der Vorteil dieser Formulierung ist, dass sie den Effekt der Entropieproduktion zeigt. Die Entropieproduktionsrate ist ein sehr wichtiges Konzept, da sie den Wirkungsgrad von thermischen Maschinen bestimmt (begrenzt). Multipliziert mit der Umgebungstemperatur
die Summe der Entropieproduktionsrate aller Prozesse innerhalb des Systems. Der Vorteil dieser Formulierung ist, dass sie den Effekt der Entropieproduktion zeigt. Die Entropieproduktionsrate ist ein sehr wichtiges Konzept, da sie den Wirkungsgrad von thermischen Maschinen bestimmt (begrenzt). Multipliziert mit der Umgebungstemperatur  es gibt die sogenannte dissipierte Energie
es gibt die sogenannte dissipierte Energie  .
.




 ist der Entropiefluss in das System, der mit dem in das System eintretenden Materiefluss verbunden ist. Es sollte nicht mit der zeitlichen Ableitung der Entropie verwechselt werden. Wenn Materie an mehreren Stellen geliefert wird, müssen wir die algebraische Summe dieser Beiträge nehmen.
ist der Entropiefluss in das System, der mit dem in das System eintretenden Materiefluss verbunden ist. Es sollte nicht mit der zeitlichen Ableitung der Entropie verwechselt werden. Wenn Materie an mehreren Stellen geliefert wird, müssen wir die algebraische Summe dieser Beiträge nehmen.
 ist:
ist:
![S = k _ { mathrm B} ln left[Omegaleft(Eright)right],](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb924dffe4f5c2c580cd40461cf5bfc5159ac881)
 ist die Anzahl der Quantenzustände in einem kleinen Intervall zwischen
ist die Anzahl der Quantenzustände in einem kleinen Intervall zwischen  . Hier
. Hier  ist ein makroskopisch kleines Energieintervall, das festgehalten wird. Genau genommen bedeutet dies, dass die Entropie von der Wahl abhängt
ist ein makroskopisch kleines Energieintervall, das festgehalten wird. Genau genommen bedeutet dies, dass die Entropie von der Wahl abhängt  hängt von den Werten dieser Variablen ab. Wenn eine Variable nicht fest ist (z. B. wenn wir einen Kolben nicht in einer bestimmten Position festklemmen), ist die freie Variable im Gleichgewicht so, dass alle zugänglichen Zustände im Gleichgewicht gleich wahrscheinlich sind
hängt von den Werten dieser Variablen ab. Wenn eine Variable nicht fest ist (z. B. wenn wir einen Kolben nicht in einer bestimmten Position festklemmen), ist die freie Variable im Gleichgewicht so, dass alle zugänglichen Zustände im Gleichgewicht gleich wahrscheinlich sind  . Wir haben bereits gesehen, dass im endgültigen Gleichgewichtszustand die Entropie im Vergleich zum vorherigen Gleichgewichtszustand zugenommen hat oder gleich geblieben ist. Boltzmanns H-Theorem beweist jedoch, dass die Menge
. Wir haben bereits gesehen, dass im endgültigen Gleichgewichtszustand die Entropie im Vergleich zum vorherigen Gleichgewichtszustand zugenommen hat oder gleich geblieben ist. Boltzmanns H-Theorem beweist jedoch, dass die Menge 
![frac {1} {k _ { mathrm B} T} equiv beta equiv frac {d ln left[Omegaleft(Eright)right]} {dE}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e720432da60639a2f9cdcefb4ac56845da4f36b0)
 ist die vom System ausgeführte Arbeit, wenn x um einen Betrag dx erhöht wird. Wenn beispielsweise x das Volumen ist, ist X der Druck. Die verallgemeinerte Kraft für ein System, von dem bekannt ist, dass es sich im Energieeigenzustand befindet
ist die vom System ausgeführte Arbeit, wenn x um einen Betrag dx erhöht wird. Wenn beispielsweise x das Volumen ist, ist X der Druck. Die verallgemeinerte Kraft für ein System, von dem bekannt ist, dass es sich im Energieeigenzustand befindet  ist gegeben durch:
ist gegeben durch:


 innerhalb eines Bereichs zwischen
innerhalb eines Bereichs zwischen  und
und  . Diese Nummer anrufen
. Diese Nummer anrufen  , wir haben:
, wir haben:



 Alle diese Energieeigenzustände bewegen sich in den Bereich zwischen
Alle diese Energieeigenzustände bewegen sich in den Bereich zwischen  . Der Unterschied
. Der Unterschied

 und
und 







 für das kanonische Ensemble hier gibt:
für das kanonische Ensemble hier gibt:

Recent Comments