Guanidine là hợp chất có công thức HNC (NH 2 ) 2 . Nó là một chất rắn không màu hòa tan trong dung môi phân cực. Nó là một cơ sở mạnh mẽ được sử dụng trong sản xuất nhựa và chất nổ. Nó được tìm thấy trong nước tiểu như một sản phẩm bình thường của quá trình chuyển hóa protein. Một hợp chất guanidine cũng xuất hiện trong các phân tử hữu cơ lớn hơn, bao gồm cả chuỗi bên của arginine.
Cấu trúc [ chỉnh sửa ]
Guanidine có thể được coi là một chất tương tự nitơ của axit carbonic. Đó là, nhóm C = O trong axit carbonic được thay thế bằng nhóm C = NH và mỗi OH được thay thế bằng nhóm NH
2 . [3] Một phân tích tinh thể chi tiết về guanidine là Làm sáng tỏ 148 năm sau lần tổng hợp đầu tiên, bất chấp sự đơn giản của phân tử. [4] Năm 2013, vị trí của các nguyên tử hydro và các thông số chuyển vị của chúng được xác định chính xác bằng cách sử dụng nhiễu xạ neutron đơn tinh thể. [5]
Sản xuất [ chỉnh sửa ]
Có thể thu được Guanidine từ các nguồn tự nhiên, được phân lập đầu tiên bởi Adolph Strecker thông qua sự thoái biến của guanine. guanine, được phân lập từ guano của Peru. [7] Tuyến thương mại bao gồm một quá trình gồm hai bước bắt đầu bằng phản ứng của dicyandiamide với muối amoni. Thông qua trung gian của biguanidine, bước ammonolysis này tạo ra muối của cation guanidinium (xem bên dưới). Trong bước thứ hai, muối được xử lý bằng bazơ, chẳng hạn như natri methoxide. [6]
muối guanidinium [ chỉnh sửa ]
Với ap K b 0,4, guanidine là một cơ sở mạnh mẽ. Hầu hết các dẫn xuất guanidine trong thực tế là muối có chứa axit liên hợp.
cation guanidinium [ chỉnh sửa ]
Axit liên hợp được gọi là cation guanidinium cation, ( C (NH +
3 ). Mặt phẳng, ion đối xứng này bao gồm ba nhóm amin, mỗi nhóm liên kết với nguyên tử carbon trung tâm với liên kết cộng hóa trị theo thứ tự 4/3. Nó là một cation +1 rất ổn định trong dung dịch nước do sự ổn định cộng hưởng hiệu quả của điện tích và sự hòa tan hiệu quả của các phân tử nước. Kết quả là, p K a là 13,6 [8] có nghĩa là guanidine là một bazơ rất mạnh trong nước; trong nước trung tính, nó tồn tại gần như độc quyền là guanidinium.
Công nghiệp [ chỉnh sửa ]
Muối chính của lợi ích thương mại là nitrat [C( NH
2 ) 3 ] KHÔNG
3 . Nó được sử dụng làm chất đẩy, ví dụ trong túi khí.
Hóa sinh [ chỉnh sửa ]
Guanidine tồn tại proton, như guanidinium, trong dung dịch ở pH sinh lý.
Guanidinium clorua (còn được gọi là guanidine hydrochloride) có đặc tính chaotropic và được sử dụng để làm biến tính protein. Guanidinium clorua được biết là làm biến tính protein với mối quan hệ tuyến tính giữa nồng độ và năng lượng tự do của quá trình phát triển. Trong dung dịch nước có chứa 6 M guanidinium clorua, hầu như tất cả các protein đều mất toàn bộ cấu trúc thứ cấp và trở thành chuỗi peptide cuộn ngẫu nhiên. Guanidinium thiocyanate cũng được sử dụng cho tác dụng biến tính của nó trên các mẫu sinh học khác nhau. Guanidinium clorua [9] được sử dụng như một chất bổ trợ trong điều trị ngộ độc, được giới thiệu vào năm 1968, [10] nhưng bây giờ vai trò của nó được coi là gây tranh cãi [11] – bởi vì ở một số bệnh nhân không có sự cải thiện sau khi dùng thuốc này.
Khác [ chỉnh sửa ]
Guanidinium hydroxide là thành phần hoạt chất trong một số loại thuốc thư giãn tóc không chứa dung dịch kiềm.
Các dẫn xuất của Guanidine [ chỉnh sửa ]
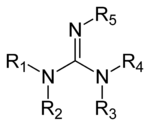
Guanidines là một nhóm các hợp chất hữu cơ có chung một nhóm chức với cấu trúc chung ] (R
1 R
2 N) (R
3 R
4 N) C = N − R
5 ] . Liên kết trung tâm trong nhóm này là của một imine và nhóm có liên quan về mặt cấu trúc với amidan và urê. Ví dụ về guanidine là arginine, triazabicyclodecene, saxitoxin và creatine.
Galegine là isoamylene guanidine. [12]
Xem thêm [ chỉnh sửa ]
Tài liệu tham khảo [ chỉnh sửa – Tóm tắt hợp chất ". Hợp chất PubChem . Hoa Kỳ: Trung tâm Thông tin Công nghệ sinh học Quốc gia. 16 tháng 9 năm 2004. Nhận dạng . Truy cập 29 tháng 2 2012 .
^ "Guanidine hydrochloride". ChemIDplus . Thư viện Y khoa Quốc gia.
^ Goebel, M.; Klapoetke, T. M. (2007). "Đặc tính cấu trúc đầu tiên của guanidine". Hóa. Cộng . 43 (30): 3180 Vang2. doi: 10.1039 / B705100J.
^ Yamada, T.; Lưu, X.; Tiếng Anh, U.; Yamane, H.; Dronskowski, R. (2009). "Cấu trúc trạng thái rắn của guanidine cơ sở tự do cuối cùng đã đạt được". Hóa. Á Âu J . 15 (23): 5651 Ảo5. doi: 10.1002 / chem.200900508. PMID 19388036.
^ Sawinski, P. K.; Meven, M.; Tiếng Anh, U.; Dronskowski, R. (2013). "Nghiên cứu nhiễu xạ neutron đơn tinh thể trên Guanidine, CN 3 H 5 ". C tinh. Tăng trưởng Des . 13 : 1730 Ảo5. doi: 10.1021 / cg400054k.
^ a b Güthner, Thomas; Mertschenk, Bernd; Schulz, Bernd, "gu ). "Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffeïn und Kreatinin" [Studies on the chemical relationships between guanine, xanthine, theobromine, caffeine and creatinine]. Liebigs Ann. Hóa . 118 (2): 151 Linh177. doi: 10.1002 / jlac.18611180203.
^ Perrin, D. D. (1972). Các hằng số phân ly của các bazơ hữu cơ trong dung dịch nước (Bổ sung ed.). Luân Đôn: Butterworths. .
^ Kaplan, J. E.; Davis, L. E.; Naraya, V.; Koster, J.; Katzenstein, D. (1979). "Bệnh ngộ độc, loại A và điều trị bằng guanidine". Biên niên sử Thần kinh học . 6 (1): 69 Tái71. doi: 10.1002 / ana.410060117. PMID 389150.
^ Puggiari, Marcello; Cherington, Michael (1978). "Botulism và Guanidine: Mười năm sau". J. Là. Med. PGS . 240 (21): 2276 Ảo7. doi: 10.1001 / jama.1978.03290210058027. PMID 702753.
^ Brook, Itzhak (2001). Nhiễm trùng kỵ khí ở trẻ em: Chẩn đoán và quản lý (tái bản lần thứ 3). Taylor & Francis. tr. 529. ISBN 0824741862.
^ Witters, L. A. (2001). "Sự nở rộ của hoa tử đinh hương". Tạp chí điều tra lâm sàng . 108 (8): 1105 Tắt7. doi: 10.1172 / JCI14178. PMC 209536 . PMID 11602616.