

Phản ứng chuỗi polymerase thời gian thực ( -Time PCR ), còn được gọi là phản ứng chuỗi polymerase định lượng (qPCR), là một kỹ thuật phòng thí nghiệm sinh học phân tử dựa trên phản ứng chuỗi polymerase (PCR). Nó theo dõi sự khuếch đại của một phân tử DNA được nhắm mục tiêu trong quá trình PCR, tức là trong thời gian thực chứ không phải ở cuối của nó, như trong PCR thông thường. PCR thời gian thực có thể được sử dụng định lượng (PCR thời gian thực định lượng) và bán định lượng, tức là trên / dưới một lượng phân tử DNA nhất định (PCR bán thời gian thực định lượng).
Hai phương pháp phổ biến để phát hiện các sản phẩm PCR trong PCR thời gian thực là: (1) thuốc nhuộm huỳnh quang không đặc hiệu xen kẽ với bất kỳ DNA sợi kép nào và (2) đầu dò DNA đặc hiệu theo trình tự bao gồm oligonucleotide được gắn nhãn với một phóng viên huỳnh quang chỉ cho phép phát hiện sau khi lai đầu dò với trình tự bổ sung của nó.
Thông tin tối thiểu để xuất bản các hướng dẫn thí nghiệm PCR thời gian thực định lượng (MIQE) đề xuất rằng chữ viết tắt qPCR được sử dụng cho PCR thời gian thực định lượng và RT-qPCR được sử dụng để sao chép ngược qPCR. [1] Từ viết tắt "RT-PCR" thường biểu thị phản ứng chuỗi polymerase sao chép ngược và không phải là PCR thời gian thực, nhưng không phải tất cả các tác giả đều tuân thủ quy ước này. [2]
Bối cảnh [ ] sửa ]
Các tế bào trong tất cả các sinh vật điều chỉnh sự biểu hiện gen bằng doanh thu của các bản phiên mã gen (RNA chuỗi đơn): Số lượng gen được biểu hiện trong một tế bào có thể được đo bằng số lượng bản sao của bản sao RNA gen hiện diện trong một mẫu. Để phát hiện và định lượng mạnh mẽ biểu hiện gen từ một lượng nhỏ RNA, việc khuếch đại bản phiên mã là cần thiết. Phản ứng chuỗi polymerase (PCR) là phương pháp phổ biến để khuếch đại DNA; đối với PCR dựa trên RNA, mẫu RNA được phiên mã ngược đầu tiên thành DNA bổ sung (cDNA) với phiên mã ngược.
Để khuếch đại một lượng nhỏ DNA, phương pháp tương tự được sử dụng như trong PCR thông thường sử dụng mẫu DNA, ít nhất một cặp mồi cụ thể, deoxyribonucleotide, dung dịch đệm phù hợp và DNA polymerase ổn định nhiệt. Một chất được đánh dấu bằng fluorophore được thêm vào hỗn hợp này trong một chu trình nhiệt có chứa các cảm biến để đo huỳnh quang của fluorophore sau khi nó được kích thích ở bước sóng cần thiết cho phép đo tốc độ tạo cho một hoặc nhiều sản phẩm cụ thể. Điều này cho phép đo tốc độ tạo ra sản phẩm khuếch đại ở mỗi chu kỳ PCR. Do đó, dữ liệu được tạo ra có thể được phân tích bằng phần mềm máy tính để tính toán biểu hiện gen tương đối (hoặc số bản sao mRNA ) trong một số mẫu. PCR định lượng cũng có thể được áp dụng để phát hiện và định lượng DNA trong các mẫu để xác định sự hiện diện và phong phú của trình tự DNA cụ thể trong các mẫu này. [3] Phép đo này được thực hiện sau mỗi chu kỳ khuếch đại và đây là lý do tại sao phương pháp này được gọi là PCR thời gian thực (nghĩa là PCR tức thời hoặc đồng thời). Trong trường hợp định lượng RNA, mẫu là DNA bổ sung (cDNA), thu được bằng cách phiên mã ngược của axit ribonucleic (RNA). Trong trường hợp này, kỹ thuật được sử dụng là RT-PCR định lượng hoặc Q-RT-PCR.
PCR định lượng và microarray DNA là phương pháp hiện đại để nghiên cứu biểu hiện gen. Các phương pháp cũ hơn đã được sử dụng để đo lường mức độ phong phú của mRNA: Hiển thị vi sai, xét nghiệm bảo vệ RNase và blot phương Bắc. Làm mờ phía bắc thường được sử dụng để ước tính mức độ biểu hiện của gen bằng cách hình dung sự phong phú của bản phiên mã mRNA của nó trong một mẫu. Trong phương pháp này, RNA tinh khiết được phân tách bằng điện di trên gel agarose, được chuyển đến một ma trận rắn (như màng nylon) và được thăm dò bằng một đầu dò DNA hoặc RNA cụ thể bổ sung cho gen quan tâm. Mặc dù kỹ thuật này vẫn được sử dụng để đánh giá biểu hiện gen, nhưng nó đòi hỏi một lượng RNA tương đối lớn và chỉ cung cấp thông tin định lượng hoặc bán định lượng của các mức mRNA. [4] Lỗi ước tính phát sinh từ các biến thể trong phương pháp định lượng có thể là kết quả của tính toàn vẹn DNA, hiệu quả enzyme và nhiều yếu tố khác. Vì lý do này, một số hệ thống tiêu chuẩn hóa (thường được gọi là phương pháp chuẩn hóa) đã được phát triển. Một số đã được phát triển để định lượng tổng số biểu hiện gen, nhưng phổ biến nhất là nhằm định lượng gen cụ thể đang được nghiên cứu liên quan đến một gen khác gọi là gen bình thường hóa, được chọn cho mức độ biểu hiện gần như không đổi. Những gen này thường được chọn từ các gen giữ nhà vì các chức năng của chúng liên quan đến sự sống của tế bào cơ bản thường bao hàm sự biểu hiện gen cấu thành. [5][6] Điều này cho phép các nhà nghiên cứu báo cáo tỷ lệ biểu hiện gen quan tâm chia cho biểu hiện của bộ chuẩn hóa được chọn, do đó cho phép so sánh trước đây mà không thực sự biết mức độ biểu hiện tuyệt đối của nó.
Các gen bình thường hóa được sử dụng phổ biến nhất là các gen mã hóa cho các phân tử sau: tubulin, glyceraldehyd-3-phosphate dehydrogenase, albumin, cyclophilin và RNA ribosome. [4]
Nguyên tắc cơ bản ]]
PCR thời gian thực được thực hiện trong một máy quay vòng nhiệt có khả năng chiếu sáng từng mẫu bằng chùm ánh sáng có ít nhất một bước sóng xác định và phát hiện huỳnh quang phát ra từ fluorophore bị kích thích. Máy quay vòng nhiệt cũng có thể nhanh chóng làm nóng và làm lạnh các mẫu, do đó tận dụng các tính chất hóa lý của axit nucleic và DNA polymerase.
Quá trình PCR thường bao gồm một loạt các thay đổi nhiệt độ được lặp lại 25 – 50 lần. Các chu trình này thường bao gồm ba giai đoạn: giai đoạn đầu tiên, ở khoảng 95 ° C, cho phép tách chuỗi kép của axit nucleic; thứ hai, ở nhiệt độ khoảng 50-60 ° C, cho phép liên kết các mồi với mẫu DNA; [7] thứ ba, ở giữa 68 – 72 ° C, tạo điều kiện cho quá trình trùng hợp được thực hiện bởi DNA polymerase. Do kích thước nhỏ của các mảnh, bước cuối cùng thường được bỏ qua trong loại PCR này vì enzyme có thể tăng số lượng của chúng trong quá trình thay đổi giữa giai đoạn căn chỉnh và giai đoạn biến tính. Ngoài ra, trong bốn bước PCR, huỳnh quang được đo trong giai đoạn nhiệt độ ngắn chỉ kéo dài vài giây trong mỗi chu kỳ, với nhiệt độ, ví dụ, 80 ° C, để giảm tín hiệu gây ra bởi sự giảm âm của mồi Một loại thuốc nhuộm không đặc hiệu được sử dụng. [8] Nhiệt độ và thời gian sử dụng cho mỗi chu kỳ phụ thuộc vào nhiều thông số khác nhau, chẳng hạn như: enzyme được sử dụng để tổng hợp DNA, nồng độ của các ion hóa trị hai và deoxyribonucleotide (dNTPs) trong Phản ứng và nhiệt độ liên kết của các mồi. [9]
Phân loại hóa học [ chỉnh sửa ]
Kỹ thuật PCR thời gian thực có thể được phân loại theo hóa học được sử dụng để phát hiện sản phẩm PCR, cụ thể hoặc fluorochromes không đặc hiệu.
Phát hiện không đặc hiệu: PCR thời gian thực với thuốc nhuộm liên kết DNA sợi đôi như các phóng viên [ chỉnh sửa ]
Thuốc nhuộm gắn DNA liên kết với tất cả các chuỗi kép (DS ) DNA trong PCR, gây ra huỳnh quang của thuốc nhuộm. Do đó, sự gia tăng sản phẩm DNA trong quá trình PCR dẫn đến sự gia tăng cường độ huỳnh quang được đo ở mỗi chu kỳ. Tuy nhiên, thuốc nhuộm DSDNA như SYBR Green sẽ liên kết với tất cả các sản phẩm PCR của DSDNA, bao gồm các sản phẩm PCR không đặc hiệu (như Primer dimer). Điều này có khả năng có thể can thiệp hoặc ngăn chặn, giám sát chính xác chuỗi mục tiêu dự định.
Trong PCR thời gian thực với thuốc nhuộm DSDNA, phản ứng được điều chế như bình thường, với việc bổ sung thuốc nhuộm DSDNA huỳnh quang. Sau đó, phản ứng được chạy trong một thiết bị PCR thời gian thực và sau mỗi chu kỳ, cường độ huỳnh quang được đo bằng máy dò; thuốc nhuộm chỉ phát huỳnh quang khi liên kết với DSDNA (tức là, sản phẩm PCR). Phương pháp này có ưu điểm là chỉ cần một cặp mồi để thực hiện khuếch đại, giúp giảm chi phí; nhiều chuỗi mục tiêu có thể được theo dõi trong một ống bằng cách sử dụng các loại thuốc nhuộm khác nhau.
Phát hiện cụ thể: phương pháp thăm dò phóng viên huỳnh quang [ chỉnh sửa ]
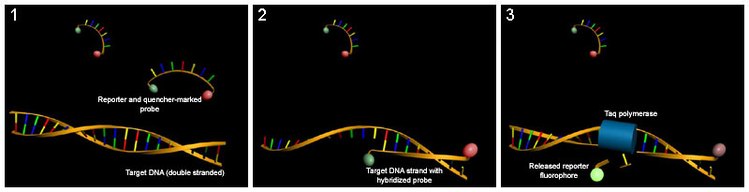
Các đầu dò huỳnh quang chỉ phát hiện DNA chứa chuỗi bổ sung cho đầu dò; do đó, việc sử dụng đầu dò phóng viên làm tăng đáng kể tính đặc hiệu và cho phép thực hiện kỹ thuật ngay cả khi có sự hiện diện của các DSDNA khác. Sử dụng các nhãn có màu khác nhau, các đầu dò huỳnh quang có thể được sử dụng trong các thử nghiệm ghép kênh để theo dõi một số chuỗi mục tiêu trong cùng một ống. Tính đặc hiệu của các đầu dò phóng huỳnh quang cũng ngăn chặn sự can thiệp của các phép đo gây ra bởi các bộ điều chỉnh mồi, đây là sản phẩm phụ không mong muốn trong PCR. Tuy nhiên, các đầu dò phóng huỳnh quang không ngăn chặn tác dụng ức chế của các chất làm mờ mồi, có thể làm giảm sự tích tụ của các sản phẩm mong muốn trong phản ứng.
Phương pháp này dựa vào đầu dò dựa trên DNA với một bộ phóng huỳnh quang ở một đầu và một chất khử huỳnh quang ở đầu đối diện của đầu dò. Sự gần gũi của phóng viên với chất khử chất ngăn chặn sự phát hiện huỳnh quang của nó; sự phá vỡ của đầu dò bởi hoạt động exonuclease 5 'đến 3' của Taq polymerase phá vỡ sự gần gũi của phóng viên và do đó cho phép phát xạ huỳnh quang không bị loại bỏ, có thể được phát hiện sau khi kích thích bằng laser. Do đó, việc tăng sản phẩm được nhắm mục tiêu bởi đầu dò phóng viên ở mỗi chu kỳ PCR do đó gây ra sự gia tăng tỷ lệ huỳnh quang do sự cố của đầu dò và phóng thích phóng viên.
- PCR được chuẩn bị như bình thường (xem PCR), và đầu dò phóng viên được thêm vào.
- Khi phản ứng bắt đầu, trong giai đoạn ủ của PCR cả đầu dò và mồi đều gắn vào mục tiêu DNA.
- Phản ứng trùng hợp của một chuỗi DNA mới được bắt đầu từ các đoạn mồi, và một khi polymerase đến đầu dò, 5'-3'-exonuclease của nó làm suy giảm đầu dò, tách chất phóng xạ huỳnh quang ra khỏi chất khử, dẫn đến tăng huỳnh quang.
- Huỳnh quang được phát hiện và đo trong máy PCR thời gian thực, và mức tăng hình học của nó tương ứng với mức tăng theo cấp số nhân của sản phẩm được sử dụng để xác định chu kỳ định lượng (C q ) trong mỗi phản ứng.
Nhiệt độ kết hợp phân tích [ chỉnh sửa ]

PCR thời gian thực cho phép xác định các đoạn DNA được khuếch đại cụ thể bằng cách sử dụng phân tích nhiệt độ nóng chảy của chúng (còn được gọi là T m giá trị, từ m elting t em Nhiệt độ ). Phương pháp được sử dụng thường là PCR với thuốc nhuộm liên kết DNA sợi đôi làm phóng viên và thuốc nhuộm được sử dụng thường là SYBR Green. Nhiệt độ nóng chảy DNA là đặc trưng cho đoạn khuếch đại. Kết quả của kỹ thuật này thu được bằng cách so sánh các đường cong phân ly của các mẫu DNA được phân tích. [11]
Không giống như PCR thông thường, phương pháp này tránh sử dụng các kỹ thuật điện di trước đây để chứng minh kết quả của tất cả các kỹ thuật điện di. mẫu. Điều này là do, mặc dù là một kỹ thuật động học, PCR định lượng thường được đánh giá ở một điểm cuối khác biệt. Do đó, kỹ thuật này thường cung cấp kết quả nhanh hơn và / hoặc sử dụng ít chất phản ứng hơn so với điện di. Nếu cần phải điện di tiếp theo, chỉ cần kiểm tra các mẫu mà PCR thời gian thực cho thấy có nghi ngờ và / hoặc phê chuẩn kết quả cho các mẫu đã xét nghiệm dương tính với một yếu tố xác định cụ thể.
Mô hình hóa [ chỉnh sửa ]
Không giống như PCR điểm cuối (PCR thông thường), PCR thời gian thực cho phép theo dõi sản phẩm mong muốn tại bất kỳ điểm nào trong quá trình khuếch đại bằng cách đo huỳnh quang (trong thực tế khung thời gian, phép đo được thực hiện ở mức của nó trong một ngưỡng nhất định). Một phương pháp định lượng DNA thường được sử dụng bằng phương pháp PCR thời gian thực dựa trên âm mưu huỳnh quang so với số chu kỳ trên thang logarit. Ngưỡng phát hiện huỳnh quang dựa trên DNA được đặt 3-5 lần độ lệch chuẩn của nhiễu tín hiệu trên nền. Số chu kỳ mà huỳnh quang vượt quá ngưỡng được gọi là chu kỳ ngưỡng (C t ) hoặc, theo hướng dẫn của MIQE, chu trình định lượng (C q ). [12]
Trong giai đoạn khuếch đại theo cấp số nhân, số lượng mẫu DNA đích (khuếch đại) tăng gấp đôi sau mỗi chu kỳ. Ví dụ: một mẫu DNA có C q trước mẫu của 3 chu kỳ khác chứa 2 3 = 8 lần mẫu hơn. Tuy nhiên, hiệu quả của khuếch đại thường thay đổi giữa các mồi và mẫu. Do đó, hiệu quả của sự kết hợp mẫu mồi được đánh giá trong một thí nghiệm chuẩn độ với pha loãng mẫu DNA nối tiếp để tạo ra một đường cong chuẩn của sự thay đổi trong (C q ) với mỗi độ pha loãng. Độ dốc của hồi quy tuyến tính sau đó được sử dụng để xác định hiệu quả của khuếch đại, là 100% nếu độ pha loãng 1: 2 dẫn đến chênh lệch (C q ) là 1. Phương pháp ngưỡng chu kỳ tạo ra một số các giả định về cơ chế phản ứng và có sự phụ thuộc vào dữ liệu từ các vùng nhiễu tín hiệu thấp của cấu hình khuếch đại có thể đưa ra phương sai đáng kể trong quá trình phân tích dữ liệu. [13]
Để định lượng biểu hiện gen, (C q ) đối với RNA hoặc DNA từ gen quan tâm được trừ khỏi (C q ) của RNA / DNA từ một gen giữ nhà trong cùng một mẫu để chuẩn hóa sự biến đổi về số lượng và chất lượng RNA giữa các mẫu khác nhau. Quy trình chuẩn hóa này thường được gọi là C t -method [14] và cho phép so sánh biểu hiện gen quan tâm giữa các mẫu khác nhau. Tuy nhiên, để so sánh như vậy, biểu hiện của gen tham chiếu chuẩn hóa cần phải rất giống nhau trên tất cả các mẫu. Do đó, việc chọn một gen tham chiếu đáp ứng tiêu chí này có tầm quan trọng cao và thường rất khó khăn, bởi vì chỉ có rất ít gen biểu hiện mức độ biểu hiện ngang nhau trong một loạt các điều kiện hoặc mô khác nhau. [15][16] Mặc dù phân tích ngưỡng chu kỳ được tích hợp với nhiều hệ thống phần mềm thương mại , có nhiều phương pháp phân tích dữ liệu hồ sơ khuếch đại chính xác và đáng tin cậy hơn nên được xem xét trong trường hợp độ tái lập là một mối quan tâm. [13]
Các phương pháp định lượng qPCR dựa trên cơ chế cũng đã được đề xuất và lợi thế mà họ không yêu cầu một đường cong tiêu chuẩn để định lượng. Các phương pháp như MAK2 [17] đã được chứng minh là có hiệu suất định lượng bằng hoặc tốt hơn so với các phương pháp đường cong tiêu chuẩn. Các phương pháp dựa trên cơ chế này sử dụng kiến thức về quá trình khuếch đại polymerase để tạo ra các ước tính về nồng độ mẫu ban đầu. Một phần mở rộng của phương pháp này bao gồm một mô hình chính xác của toàn bộ hồ sơ phản ứng PCR, cho phép sử dụng dữ liệu nhiễu tín hiệu cao và khả năng xác nhận chất lượng dữ liệu trước khi phân tích. [13] [19659004] Theo nghiên cứu của Ruijter và cộng sự [18] MAK2 giả định hiệu suất khuếch đại không đổi trong phản ứng PCR. Tuy nhiên, phân tích lý thuyết về phản ứng chuỗi polymerase, từ đó MAK2 được dẫn xuất, đã tiết lộ rằng hiệu quả khuếch đại không phải là hằng số trong suốt quá trình PCR. Trong khi định lượng MAK2 cung cấp các ước tính đáng tin cậy về nồng độ DNA mục tiêu trong một mẫu trong điều kiện qPCR bình thường, MAK2 không định lượng đáng tin cậy nồng độ mục tiêu cho các xét nghiệm qPCR bằng máy đo cạnh.
Ứng dụng [ chỉnh sửa ]
Có rất nhiều ứng dụng cho phản ứng chuỗi polymerase định lượng trong phòng thí nghiệm. Nó thường được sử dụng cho cả nghiên cứu chẩn đoán và cơ bản. Sử dụng kỹ thuật trong công nghiệp bao gồm định lượng tải lượng vi sinh vật trong thực phẩm hoặc thực vật, phát hiện GMO (sinh vật biến đổi gen) và định lượng và kiểu gen của mầm bệnh virus ở người.
Định lượng biểu hiện gen [ chỉnh sửa ]
Định lượng biểu hiện gen bằng phương pháp phát hiện DNA truyền thống là không đáng tin cậy. Phát hiện mRNA trên sản phẩm PCR blot miền Bắc hoặc sản phẩm PCR trên gel hoặc Southern blot không cho phép định lượng chính xác. [19] Ví dụ, trong 20-40 chu kỳ của một PCR điển hình, lượng sản phẩm DNA đạt đến một cao nguyên không phải là tương quan trực tiếp với số lượng DNA mục tiêu trong PCR ban đầu. [20]
PCR thời gian thực có thể được sử dụng để định lượng axit nucleic bằng hai phương pháp phổ biến: định lượng tương đối và định lượng tuyệt đối. [21] Định lượng tuyệt đối đưa ra số lượng chính xác các phân tử DNA mục tiêu bằng cách so sánh với các tiêu chuẩn DNA bằng cách sử dụng đường cong hiệu chuẩn. Do đó, điều cần thiết là PCR của mẫu và tiêu chuẩn có cùng hiệu suất khuếch đại. [22] Định lượng tương đối dựa trên các gen tham chiếu bên trong để xác định sự khác biệt về biểu hiện của gen mục tiêu. Việc định lượng được biểu thị bằng sự thay đổi mức độ biểu hiện của mRNA được hiểu là DNA bổ sung (cDNA, được tạo ra bởi phiên mã ngược của mRNA). Định lượng tương đối dễ thực hiện hơn vì nó không yêu cầu đường chuẩn vì lượng gen được nghiên cứu được so sánh với lượng gen tham chiếu đối chứng.
Vì các đơn vị được sử dụng để thể hiện kết quả định lượng tương đối là không quan trọng, kết quả có thể được so sánh qua một số RTqPCR khác nhau. Lý do sử dụng một hoặc nhiều gen giữ nhà là để điều chỉnh biến thể không đặc hiệu, chẳng hạn như sự khác biệt về số lượng và chất lượng của RNA được sử dụng, có thể ảnh hưởng đến hiệu quả của phiên mã ngược và do đó của toàn bộ quá trình PCR. Tuy nhiên, khía cạnh quan trọng nhất của quá trình là gen tham chiếu phải ổn định. [23]
Việc lựa chọn các gen tham chiếu này theo truyền thống được thực hiện trong sinh học phân tử bằng các nghiên cứu định tính hoặc bán định lượng. chẳng hạn như kiểm tra trực quan các gel RNA, đo mật độ phương bắc blot hoặc PCR bán định lượng (bắt chước PCR). Bây giờ, trong kỷ nguyên gen, có thể thực hiện ước tính chi tiết hơn cho nhiều sinh vật sử dụng công nghệ phiên mã. [24] Tuy nhiên, nghiên cứu đã chỉ ra rằng khuếch đại của phần lớn các gen tham chiếu được sử dụng để định lượng biểu hiện của mRNA thay đổi tùy theo điều kiện thí nghiệm. [25][26][27] Do đó, cần phải thực hiện một nghiên cứu phương pháp thống kê ban đầu để chọn ra gen tham chiếu phù hợp nhất.
Một số thuật toán thống kê đã được phát triển có thể phát hiện gen hoặc gen nào phù hợp nhất để sử dụng trong các điều kiện nhất định. Những người như geNORM hoặc BestKeeper có thể so sánh các cặp hoặc phương tiện hình học cho một ma trận gồm các gen và mô tham chiếu khác nhau. [28][29]
Chẩn đoán sử dụng [ chỉnh sửa ]
PCR định tính chẩn đoán được áp dụng để phát hiện nhanh chóng các axit được chẩn đoán, ví dụ, các bệnh truyền nhiễm, ung thư và bất thường di truyền. Sự ra đời của các xét nghiệm PCR định tính cho phòng thí nghiệm vi sinh lâm sàng đã cải thiện đáng kể chẩn đoán bệnh truyền nhiễm, [30] và được triển khai như một công cụ để phát hiện các bệnh mới nổi, như các chủng cúm mới, trong các xét nghiệm chẩn đoán. [31]
Vi sinh sử dụng [ chỉnh sửa ]
PCR định lượng cũng được sử dụng bởi các nhà vi sinh học làm việc trong lĩnh vực an toàn thực phẩm, làm hỏng thực phẩm và lên men và để đánh giá rủi ro vi khuẩn về chất lượng nước (nước uống và giải trí) và trong bảo vệ sức khỏe cộng đồng. [32]
Phát hiện phytopathogens [ chỉnh sửa ]
Ngành nông nghiệp không ngừng nỗ lực để sản xuất mầm cây hoặc cây giống không có mầm bệnh để tránh thiệt hại về kinh tế. và bảo vệ sức khỏe. Các hệ thống đã được phát triển cho phép phát hiện một lượng nhỏ DNA của Phytophthora ramorum một loài oomycete giết chết Oaks và các loài khác, trộn lẫn với DNA của cây chủ. Sự phân biệt giữa DNA của mầm bệnh và thực vật dựa trên sự khuếch đại trình tự ITS, các miếng đệm nằm trong khu vực mã hóa gen RNA ribosome, đặc trưng cho mỗi taxon. [33] Các phiên bản dựa trên lĩnh vực này của kỹ thuật này cũng đã được phát triển cho xác định cùng một mầm bệnh. [34]
Phát hiện các sinh vật biến đổi gen [ chỉnh sửa ]
qPCR sử dụng phiên mã ngược (RT-qPCR) có thể được sử dụng để phát hiện GMO có độ nhạy và phạm vi động của nó phát hiện DNA. Các lựa chọn thay thế như phân tích DNA hoặc protein thường ít nhạy cảm hơn. Các mồi cụ thể được sử dụng để khuếch đại không phải gen chuyển mà là bộ khởi động, bộ kết thúc hoặc thậm chí các chuỗi trung gian được sử dụng trong quá trình thiết kế vectơ. Vì quá trình tạo ra một cây chuyển gen thường dẫn đến việc chèn nhiều hơn một bản sao của gen chuyển, số lượng của nó cũng thường được đánh giá. Điều này thường được thực hiện bằng cách định lượng tương đối bằng cách sử dụng gen điều khiển từ các loài được điều trị chỉ xuất hiện dưới dạng một bản sao duy nhất. [35][36]
Định lượng lâm sàng và kiểu gen [ chỉnh sửa ]
Virus có thể hiện diện ở người do nhiễm trùng trực tiếp hoặc đồng nhiễm gây khó chẩn đoán khi sử dụng các kỹ thuật cổ điển và có thể dẫn đến tiên lượng và điều trị không chính xác. Việc sử dụng qPCR cho phép cả định lượng và kiểu gen (đặc tính của chủng, được thực hiện bằng cách sử dụng các đường cong nóng chảy) của một loại virut như virut viêm gan B. [37] Mức độ lây nhiễm, được định lượng là bản sao của bộ gen virut trên mỗi đơn vị mô của bệnh nhân, có liên quan trong nhiều trường hợp; ví dụ, xác suất virus herpes simplex loại 1 kích hoạt lại có liên quan đến số lượng tế bào thần kinh bị nhiễm bệnh trong hạch. [38] Việc định lượng này được thực hiện bằng phiên mã ngược hoặc không có nó, như xảy ra nếu virus được tích hợp trong bộ gen của con người tại bất kỳ thời điểm nào trong chu kỳ của nó, chẳng hạn như xảy ra trong trường hợp nhiễm virut HPV (papillomavirus ở người), trong đó một số biến thể của nó có liên quan đến sự xuất hiện của ung thư cổ tử cung. [39]
Tài liệu tham khảo ]]
- ^ Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl MW, Shipley GL, Vandesompele J, Wittwer CT (2009). "Hướng dẫn MIQE: thông tin tối thiểu để xuất bản các thí nghiệm PCR thời gian thực định lượng". Hóa học lâm sàng . 55 (4): 611 Từ22. doi: 10.1373 / clinchem.2008.112797. PMID 19246619.
- ^ được chỉnh sửa bởi Julie Logan; Kirstin Edwards & Nick Saunders. (2009). Logan J, Edwards K, Saunders N, eds. PCR thời gian thực: Công nghệ và ứng dụng hiện tại . Caister Báo chí học thuật. ISBN 97-1-904455-39-4. CS1 duy trì: Văn bản bổ sung: danh sách tác giả (liên kết) CS1 duy trì: Sử dụng tham số biên tập viên (liên kết)
- ^ Watson, J D; Baker, T A; Chuông, S P; Gann, A; Levine, M; Mất, R (2004). Sinh học phân tử của gen (lần thứ năm). San Francisco: Benjamin Cummings. ISBN 0-321-22368-3.
- ^ a b Michael W. Pfaff, Ales Tichopad, Christian Prgomet và Tanja P. Neuvians (2005 ). Xác định các gen giữ nhà ổn định, các gen mục tiêu được quy định khác nhau và tính toàn vẹn của mẫu: BestKeeper – Công cụ dựa trên Excel sử dụng các mối tương quan theo cặp thông minh Công nghệ sinh học 26 : 509-515
- ^ Pfaffl, MW; Horgan, GW; Dempfle, L (2002). "Công cụ phần mềm biểu thức tương đối (REST ©) để so sánh nhóm và phân tích thống kê về kết quả biểu hiện tương đối trong PCR thời gian thực". Axit nucleic Res . 30 : e36. doi: 10.1093 / nar / 30.9.e36.
- ^ Vandesompele, J; De Preter, K; Pattyn, F; Poppe, B; Van Roy, N; De Paepe, A; Người phát ngôn, F (2002). "Chuẩn hóa chính xác dữ liệu RT-PCR định lượng thời gian thực bằng cách lấy trung bình hình học của nhiều gen kiểm soát nội bộ". Gen. Biol . 3 : 1 Từ12.
- ^ Rychlik W, Spencer WJ, Rhoads RE (1990). "Tối ưu hóa nhiệt độ ủ để khuếch đại DNA trong ống nghiệm ". Axit nucleic Res . 18 (21): 6409 Ảo6412. doi: 10.1093 / nar / 18,21.6409. PMC 332522 . PMID 2243783.
- ^ http://gene-quantification.org/biochemica-3-2000.pdf
- ^ Joseph Sambrook & David W. Russel (2001). Nhân bản phân tử: Hướng dẫn thí nghiệm (tái bản lần thứ 3). Cold Spring Harbor, N.Y.: Nhà xuất bản Phòng thí nghiệm Cold Spring Harbor. Sđt 0-87969-576-5.
- ^ Ponchel F; Toomes C; Bransfield K; Lê Fong F.T; Douglas S.H; Lĩnh vực S.L; Chuông S.M; Combaret V; Puisieux A; Mighell A.J (2003). "PCR thời gian thực dựa trên huỳnh quang SYBR-Green I: Một thay thế cho xét nghiệm TaqMan để định lượng tương đối các sắp xếp lại gen, khuếch đại gen và xóa gen vi mô" (w) . BMC Biotechnol . 3 : 18. doi: 10.1186 / 1472-6750-3-18.
- ^ Riri K.M; Rasmussen R.P; Wittwer C.T. (1997). "Phân biệt sản phẩm bằng cách phân tích các đường cong nóng chảy DNA trong phản ứng chuỗi polymerase" (PDF) . Hóa sinh phân tích . 245 (2): 154 Hàng160. doi: 10.1006 / abio.1996.9916. PMID 9056205.
- ^ Stephen A. Bustin; Vladimir Benes; Jeremy A. Garson; Jan Hellemans; Jim Huggett; Mikael Kubista; Reinhold Mueller; Tania Nolan; Michael W. Pfaffl; Gregory L. Shipley; Jo Vandesompele & Carl T. Wittwer. (Tháng 4 năm 2009). "Hướng dẫn MIQE: Thông tin tối thiểu để xuất bản các thí nghiệm PCR thời gian thực định lượng". Lâm sàng. Hóa . 55 (4) :: 611 Từ22. doi: 10.1373 / clinchem.2008.112797. PMID 19246619.
- ^ a b c Carr, A. Moore, S. D. (2012). Lucia, Alejandro, chủ biên. "Định lượng mạnh mẽ các phản ứng chuỗi polymerase bằng cách sử dụng sự phù hợp toàn cầu". XIN MỘT . 7 (5): e37640. doi: 10.1371 / tạp chí.pone.0037640. PMC 3365123 . PMID 22701526.
- ^ Schefe JH, Lehmann KE, Buschmann IR, Unger T, Funke-Kaiser H (2006). "Phân tích dữ liệu RT-PCR thời gian thực định lượng: các khái niệm hiện tại và công thức" sự khác biệt CT biểu hiện gen "mới lạ. J Mol Med . 84 (11): 901 Từ10. doi: 10.1007 / s00109-006-0097-6. PMID 16972087.
- ^ Nailis H, Coenye T, Van Nieuwerburgh F, Deforce D, Nelis HJ (2006). "Phát triển và đánh giá các chiến lược bình thường hóa khác nhau cho các nghiên cứu biểu hiện gen trong màng sinh học Candida albicans bằng phương pháp PCR thời gian thực". BMC Mol. Biol . 7 (1): 25. đổi: 10.1186 / 1471-2199-7-25. PMC 1557526 . PMID 16889665.
- ^ Nolan T, Hands RE, Bustin SA (2006). "Định lượng mRNA bằng RT-PCR thời gian thực". Tự nhiên. Protoc . 1 (3): 1559 Từ1582. doi: 10.1038 / nprot.2006.236. PMID 17406449.
- ^ Boggy G, Woolf PJ (2010). Ravasi, Ti-mô-thê, chủ biên. "Một mô hình cơ chế của PCR để định lượng chính xác dữ liệu PCR định lượng". XIN MỘT . 5 (8): e12355. doi: 10.1371 / tạp chí.pone.0012355. PMC 2930010 . PMID 20814578.
- ^ Ruijter JM, Pfaffl MW, Zhao S, Spiess AN, Boggy G, Blom J, Rutledge RG, Sisti D, Lievens A, De Preter K, Derveaux S, Hellemans 2012). "Đánh giá các phương pháp phân tích đường cong qPCR để phát hiện dấu ấn sinh học đáng tin cậy: sai lệch, độ phân giải, độ chính xác và ý nghĩa". Phương pháp . 59 : e12355. doi: 10.1016 / j.ymeth.2012.08.011. PMID 22975077.
- ^ Bruce Gelerter. "PEMF để điều trị rối loạn giác mạc". Được lưu trữ từ bản gốc vào ngày 2014-06-09.
- ^ Overbergh, Giulietti; et al. (2003). "Việc sử dụng PCR sao chép ngược thời gian thực để định lượng biểu hiện gen cytokine". Tạp chí kỹ thuật phân tử sinh học . 14 (1). CS1 duy trì: Sử dụng triệt để et al. (liên kết)
- ^ S. Dhanasekaran, T. Mark Doherty, John Kenneth và Nhóm nghiên cứu thử nghiệm bệnh lao. (Tháng 3 năm 2010). "So sánh các tiêu chuẩn khác nhau để định lượng tuyệt đối dựa trên PCR thời gian thực". Phương pháp miễn dịch . 354 (1 Vé2): 34 trừ9. doi: 10.1016 / j.jim.2010.01.004. PMID 20109462. CS1 duy trì: Nhiều tên: danh sách tác giả (liên kết)
- ^ Bar, Tzachi; Kubista, Mikael; Tichopad, Ales (2011-10-19). "Xác nhận tính tương tự động học trong qPCR". Nghiên cứu axit nucleic . 40 : gkr778. doi: 10.1093 / nar / gkr778. ISSN 0305-1048. PMC 3287174 . PMID 22013160.
- ^ Ngăm đen, AM; Yakovlev, IA; Strauss, SH (2004). "Xác nhận kiểm soát nội bộ cho các nghiên cứu biểu hiện gen thực vật định lượng". Biol thực vật BMC . 4 : 14.
- ^ McGettigan, Paul A. "Transcriptomics trong kỷ nguyên RNA-seq". Ý kiến hiện tại về sinh học hóa học . 17 (1): 4 bóng11. doi: 10.1016 / j.cbpa.2012.12.008.
- ^ Thellin, O; Zorzi, W; Lakaye, B; De Borman, B; Couman, B; Henne, G; Grisar, T; Igout, A; Heinen, E (1999). "Các gen giữ nhà theo tiêu chuẩn nội bộ: sử dụng và giới hạn". J Biotechnol . 75: 197–200. doi:10.1016/s0168-1656(99)00163-7. PMID 10617337.
- ^ Radonic, A; Thulke, S; Mackay, IM; Landt, O; Siegert, W; Nitsche, A (2004). "Guideline for reference gene selection for quantitative real-time PCR". Biochem Biophys Res Commun. 313: 856–862. doi:10.1016/j.bbrc.2003.11.177. PMID 14706621.
- ^ Dheda, K; Huggett, JF; Bustin, SA; Johnson, MA; Rook, G; Zumla, A (2004). "Validation of housekeeping genes for normalizing RNA expression in real-time PCR". BioTechniques. 37: 112–119.
- ^ Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F (2002) Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes" Genome Biol 37: RESEARCH0034
- ^ Pfaffl, MW; Tichopad, A; Prgomet, C; Neuvians, TP (2004). "Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper—Excel-based tool using pair-wise correlations". Biotechnol Lett. 26: 509–515. doi:10.1023/b:bile.0000019559.84305.47.
- ^ Espy, M.J. (January 2006). "Real-Time PCR in Clinical Microbiology: Applications for Routine Laboratory Testing". Clinical Microbiology Reviews. 19 (3): 165–256. doi:10.1128/CMR.19.1.165-256.2006. PMC 1360278. PMID 16418529.
- ^ [1 9459012]FDA-cleared RT-PCR Assays and Other Molecular Assays for Influenza Viruses
- ^ Filion, M (editor) (2012). Quantitative Real-time PCR in Applied Microbiology. Caister Báo chí học thuật. ISBN 978-1-908230-01-0.CS1 maint: Extra text: authors list (link)
- ^ Baldwin, B.G. (1992). "Phylogenetic utility of the internal transcribed spacers of nuclear ribosomal DNA in plants: An example from the Compositaogy". Phylogenetic phân tử và tiến hóa . 1 (1): 3–16. doi:10.1016/1055-7903(92)90030-K. PMID 1342921.
- ^ Tomlinson, J. A.; Barker, I.; Boonham, N. (2007). "Faster, Simpler, More-Specific Methods for Improved Molecular Detection of Phytophthora ramorum in the Field". Applied and Environmental Microbiology. 73 (12): 4040–4047. doi:10.1128/AEM.00161-07. PMC 1932743. PMID 17449689.
- ^ Holst-jensen A, R{o}nning S.B, L{o}vseth A, Berdal K.G. (2003). "PCR technology for screening and quantification of genetically modified organisms (GMOs)" (PDF). Analytical and Bioanalytical Chemistry. 375 (8): 985–993. doi:10.1007/s00216-003-1767-7.CS1 maint: Uses authors parameter (link)
- ^ Brodmann P.D; Ilg E.C; Berthoud H; Herrmann A. (2002). "… -Time Quantitative Polymerase Chain Reaction Methods for Four Genetically Modified Maize Varieties …". Journal of AOAC International. 85 (3): 646–653. doi:10.5555/jaoi.2002.85.3.646. PMID 12083257.
- ^ Yeh S.H. Tsai C.Y. Kao J.H. Liu C.J. Kuo T.J. Lin M.W. Huang W.L. Lu S.F. Jih J. Chen D.S. Others (2004). "Quantification and genotyping of hepatitis B virus in a single reaction by real-time PCR and melting …". Journal of Hepatology. 41 (4): 659–666. doi:10.1016/j.jhep.2004.06.031. PMID 15464248.
- ^ Sawtell N.M. (1998). "The Probability of in Vivo Reactivation of Herpes Simplex Virus Type 1 Increases with the Number of Latently Infected Neurons in the Ganglia". Journal of Virology. 72 (8): 6888–6892. PMC 109900. PMID 9658140.
- ^ Peter M. Rosty C. Couturier J. Radvanyi F. Teshima H. Sastre-garau X. (2006). "MYC activation associated with the integration of HPV DNA at the MYC locus in genital tumours" (w). Oncogene. 25 (44): 5985–5993. doi:10.1038/sj.onc.1209625. PMID 16682952.
Bibliography[edit]
- Elyse; Houde, Alain (2002). "La PCR en temps réel: principes et applications" (PDF). Reviews in Biology and Biotechnology. 2 (2): 2–11. Archived from the original (PDF) on 2009-06-12.
- Bustin, SA (2000). "Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays". J Mol Endocrinol. 25 (2): 169–93. doi:10.1677/jme.0.0250169. PMID 11013345.
- Higuchi, R.; Dollinger, G.; Walsh, P.S.; Griffith, R. (1992). "Simultaneous amplification and detection of specific DNA-sequences". Bio-Technology. 10 (4): 413–417. doi:10.1038/nbt0492-413. PMID 1368485.
- Holland, P.M.; Abramson, R.D.; Watson, R.; Gelfand, D.H. (1991). "Detection of specific polymerase chain reaction product by utilizing the 50 !30 exonuclease activity of Thermus aquaticus DNA polymerase". Proc. Natl. Học viện Khoa học USA. 88 (16): 7276–7280. doi:10.1073/pnas.88.16.7276. JSTOR 2357665. PMC 52277. PMID 1871133.
- Kubista, M; Andrade, JM; Bengtsson, M; Forootan, A; Jonak, J; Lind, K; Sindelka, R; Sjoback, R; Sjogreen, B; Strombom, L; Stahlberg, A; Zoric, N (2006). "The real-time polymerase chain reaction". Mol Aspects Med. 27 (2–3): 95–125. doi:10.1016/j.mam.2005.12.007. PMID 16460794.
- Higuchi, R.; Fockler, C.; Dollinger, G.; Watson, R. (1993). "Kinetic PCR: Real time monitoring of DNA amplification reactions". Biotechnology. 11: 1026–1030. doi:10.1038/nbt0993-1026.
- Filion, M. (2012). Quantitative Real-time PCR in Applied Microbiology Caister Academic Press. ISBN 978-1-908230-01-0
- Wawrik, B; Paul, JH; Tabita, FR (2002). "Real-time PCR quantification of rbcL (ribulose-1,5-bisphosphate carboxylase/oxygenase) mRNA in diatoms and pelagophytes". Appl. Môi trường. Microbiol. 68: 3771–3779. doi:10.1128/aem.68.8.3771-3779.2002. PMC 123995.
- Logan J, Edwards K, Saunders N (editors) (2009). Real-Time PCR: Current Technology and Applications. Caister Báo chí học thuật. ISBN 978-1-904455-39-4.CS1 maint: Multiple names: authors list (link) CS1 maint: Extra text: authors list (link)