Paal-Knorr-Synthese – Wikipedia
Das Paal-Knorr-Synthese in der organischen Chemie ist eine Reaktion, die entweder Furane, Pyrrole oder Thiophene aus 1,4-Diketonen erzeugt. Es ist eine synthetisch wertvolle Methode zur Gewinnung substituierter Furane und Pyrrole, übliche Strukturkomponenten vieler Naturstoffe. Es wurde ursprünglich 1884 von den deutschen Chemikern Carl Paal und Ludwig Knorr als Methode zur Herstellung von Furanen unabhängig beschrieben und für Pyrrole und Thiophene angepasst.[1][2] Obwohl die Paal-Knorr-Synthese weit verbreitet ist, wurde der Mechanismus erst vollständig verstanden, als er von V. Amarnath aufgeklärt wurde et al. In den 1990ern.[3][4]
Die Furansynthese erfordert einen Säurekatalysator:[5]
An der Pyrrolsynthese ist ein primäres Amin beteiligt:
und in der von Thiophen zum Beispiel die Verbindung Phosphorpentasulfid:
Mechanismen[edit]
Furansynthese[edit]
Die säurekatalysierte Furansynthese erfolgt durch Protonierung eines Carbonyls, das vom sich bildenden Enol des anderen Carbonyls angegriffen wird. Die Dehydratisierung des Halbacetals ergibt das resultierende Furan.[6]

Der Mechanismus der Paal-Knorr-Furansynthese wurde 1995 von V. Amarnath aufgeklärt et al.[3] Amarnaths Arbeit zeigte, dass die Diastereomeren von 3,4-disubstituierten 2,5-Hexandionen unterschiedlich schnell reagieren. In dem allgemein akzeptierten Mechanismus würden diese Dione ein gemeinsames Enol-Intermediat durchlaufen, was bedeutet, dass das Meso und d, l-racemische Isomere würden mit der gleichen Geschwindigkeit cyclisieren, wie sie sich aus einem gemeinsamen Zwischenprodukt bilden. Die unterschiedliche Reaktion impliziert, dass die Cyclisierung in einem konzertierten Schritt mit Enolbildung erfolgen muss. Daher wurde vorgeschlagen, dass der Mechanismus durch Angriff des protonierten Carbonyls mit dem sich bildenden Enol erfolgt. Amarnath fand auch heraus, dass das nicht umgesetzte Dion keine Konformationsisomerisierung erfahren hatte, was auch darauf hinwies, dass ein Enol kein Zwischenprodukt war.
Pyrrolsynthese[edit]
Der Mechanismus für die Synthese des Pyrrols wurde von V. Amarnath untersucht et al. im Jahr 1991.[4] Seine Arbeit legt nahe, dass das protonierte Carbonyl vom Amin angegriffen wird, um das Hemiaminal zu bilden. Das Amin greift das andere Carbonyl an und bildet ein 2,5-Dihydroxytetrahydropyrrol-Derivat, das dehydratisiert wird, um das entsprechende substituierte Pyrrol zu ergeben.[7]

Die Reaktion wird typischerweise unter protischen oder Lewis-sauren Bedingungen mit einem primären Amin durchgeführt. Die Verwendung von Ammoniumhydroxid oder Ammoniumacetat (wie von Paal berichtet) ergibt das N-unsubstituierte Pyrrol.
Thiophensynthese[edit]
Die Thiophensynthese wird über einen Mechanismus erreicht, der der Furansynthese sehr ähnlich ist. Das anfängliche Diketon wird mit einem Schwefelungsmittel in ein Thioketon umgewandelt, das dann den gleichen Mechanismus wie die Furansynthese durchläuft.[8]

Die meisten Schwefelungsmittel sind starke Dehydratoren und treiben die Vervollständigung der Reaktion voran. Frühe Postulate zum Mechanismus der Paal-Knorr-Furansynthese deuteten darauf hin, dass das Thiophen durch Schwefelung des Furanprodukts erreicht wurde. Campaigne und Foye zeigten, dass die Behandlung von isolierten Furanen aus der Paal-Knorr-Furansynthese mit Phosphorpentasulfid inkonsistente Ergebnisse mit der Behandlung von 1,4-Dicarbonylen mit Phosphorpentasulfid ergab, was die Schwefelung eines Furanmechanismus ausschloss und darauf hindeutet, dass die Reaktion abläuft durch Schwefelung eines Dicarbonyls unter Bildung eines Thioketons.[8]

Die Paal-Knorr-Reaktion ist sehr vielseitig. Bei allen Synthesen können fast alle Dicarbonyle in ihren entsprechenden Heterocyclus umgewandelt werden. R2 und R5 können H, Aryl oder Alkyl sein. R3 und R4 können H, Aryl, Alkyl oder ein Ester sein. Bei der Pyrrolsynthese (X = N) kann R 1 H, Aryl, Alkyl, Amino oder Hydroxyl sein.[9]
Eine Vielzahl von Bedingungen kann verwendet werden, um diese Reaktionen durchzuführen, von denen die meisten mild sind. Die Paal-Knorr-Furan-Synthese wird normalerweise unter wässrigen sauren Bedingungen mit protischen Säuren wie wässriger Schwefel- oder Salzsäure oder unter wasserfreien Bedingungen mit einer Lewis-Säure oder einem Dehydratisierungsmittel durchgeführt. Übliche Dehydratisierungsmittel umfassen Phosphorpentoxid, Anhydride oder Zinkchlorid. Die Pyrrolsynthese erfordert ein primäres Amin unter ähnlichen Bedingungen, oder es kann Ammoniak (oder Ammoniakvorläufer) verwendet werden. Die Synthese eines Thiophens erfordert ein Schwefelungsmittel, das typischerweise ein ausreichender Dehydrator ist, wie Phosphorpentasulfid, Lawessons Reagenz oder Schwefelwasserstoff.
Traditionell war der Umfang der Paal-Knorr-Reaktion durch die Verfügbarkeit von 1,4-Diketonen als synthetische Vorläufer begrenzt. Gegenwärtige chemische Verfahren haben die Zugänglichkeit dieser Reagenzien erheblich erweitert, und Variationen des Paal-Knorr ermöglichen nun die Verwendung verschiedener Vorläufer. Der Paal-Knorr wurde auch als durch raue Reaktionsbedingungen wie längeres Erhitzen in Säure begrenzt angesehen, was die empfindlichen Funktionalitäten vieler potenzieller Furanvorläufer beeinträchtigen kann. Gegenwärtige Verfahren ermöglichen mildere Bedingungen, die Hitze insgesamt vermeiden können, einschließlich mikrowellenkatalysierter Cyclisierungen.
Variationen[edit]
Anstelle eines 1,4-Dicarbonyls können mehrere 1,4-Dicarbonyl-Surrogate verwendet werden. Während diese Substitute andere Strukturen aufweisen als ein 1,4-Dicarbonyl, verlaufen ihre Reaktionen über Mechanismen, die denen des Paal-Knorr sehr ähnlich sind.
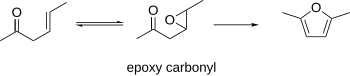
β-Epoxycarbonylgruppen[edit]
Es ist bekannt, dass β-Epoxycarbonylgruppen zu Furanen cyclisieren. Dieses Verfahren kann die β-γ-ungesättigten Carbonyle als Ausgangsmaterialien verwenden, die epoxidiert werden können. Das resultierende Epoxycarbonyl kann unter sauren oder basischen Bedingungen zu einem Furan cyclisiert werden.[10]
1,4-Diol-2-ynes[edit]
1,4-Diol-2-in-Systeme wurden auch für die Paal-Knorr-Chemie verwendet. Mit Palladium kann ein 1,4-Diol-2-in zum entsprechenden 1,4-Diketon isomerisiert werden vor Ort und dann unter Verwendung eines Dehydratisierungsmittels zu dem entsprechenden Furan dehydratisiert.[11]

Die Bedeutung dieser Variation liegt in der Tatsache, dass sie den Anwendungsbereich des Paal-Knorr erweitert, indem sie den Reichtum der vorhandenen Acetylenchemie nutzt, insbesondere für die Erzeugung von Propargylalkoholen.
Acetale[edit]
Acetale haben sich auch als nützliche Ausgangsmaterialien für den Paal-Knorr erwiesen. Ein Keton mit einer Acetal-3-Bindung kann unter genau den gleichen Bedingungen wie ein 1,4-Diketon in den entsprechenden Heterocyclus umgewandelt werden.
Mikrowellenunterstützter Paal-Knorr[edit]
Eine weitere Variante war die Einführung von Mikrowellenstrahlung zur Verbesserung des Paal-Knorr. Traditionelle Paal-Knorr-Bedingungen beinhalteten ein längeres Erhitzen starker Säuren, um die Dehydration zu fördern, die über einen Zeitraum von mehreren Stunden auftrat. Es wurde gezeigt, dass mikrowellenunterstützte Paal-Knorr-Reaktionen auf Zeitskalen in Minuten und in offenen Kolben bei Raumtemperatur auftreten.[12]
Verwandte Reaktionen[edit]
Die Knorr-Pyrrolsynthese, über die Knorr 1884 berichtete, ist die Synthese eines substituierten Pyrrols aus einem Aminoketon und einem Keton.[13]
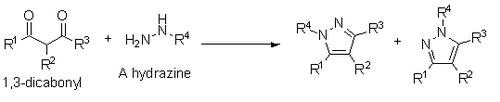
Knorr berichtet auch über eine Synthese von Pyrazolen aus 1,3-Dicarbonylen und Hydrazinen, Hydraziden oder Semibicarbaziden. Diese Synthese erfolgt über einen Kondensationsmechanismus ähnlich dem von Paal-Knorr. Wenn jedoch ein substituiertes Hydrazin verwendet wird, führt dies zu einer Mischung von Regioisomeren, wobei sich das substituierte Heteroatom entweder neben dem R1-Substituenten oder dem R3-Substituenten befindet.[14]
Synthetische Anwendungen[edit]
Im Jahr 2000 wurde BM Trost et al. berichteten über eine formale Synthese des Antibiotikums Roseophilin. Trosts Weg zum makrocyclischen Kern von Roseophilin beruhte wie andere auf einer Paal-Knorr-Pyrrolsynthese, um das kondensierte Pyrrol zu erhalten.[15] Durch Erhitzen des 1,4-Diketons mit Ammoniumacetat in Methanol mit Kampfer-Sulfonsäure und 4-Angström-Molekularsieben wurde das Pyrrol ohne N-Substitution erhalten. Dieses Pyrrol erwies sich als instabil und wurde als solches mit Trimethylsilylethoxymethoxychlorid (SEM-Cl) behandelt, um das Pyrrol vor der Isolierung zu schützen.

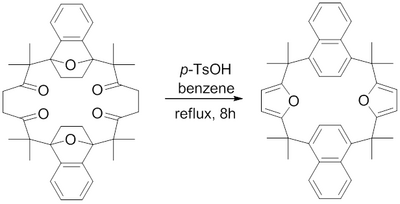
Im Jahr 1982, H. Hart et al. berichteten über eine Synthese eines Makrocyclus mit kondensierten Furanringen unter Verwendung einer Paal-Knorr-Furansynthese.[16] Rückfluss AbsEs wurde gefunden, dass -toluolsulfonsäure in Benzol die 1,4-Diketone zu ihren jeweiligen Furanen dehydratisiert, um die herausfordernden makrocyclischen kondensierten Furane zu erhalten.
Siehe auch[edit]
Verweise[edit]
- ^ Paal, C. (1884), “Über die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters”, Berichte der deutschen Chemie Gesellschaft, 17 (2): 2756–2767, doi:10.1002 / cber.188401702228
- ^ Knorr, L. (1884), “Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester”, Berichte der deutschen Chemie Gesellschaft, 17 (2): 2863–2870, doi:10.1002 / cber.188401702254
- ^ ein b Amarnath, V.; Amarnath, K. (1995), “Intermediates in the Paal-Knorr Synthesis of Furans”, Das Journal of Organic Chemistry, 60 (2): 301–307, doi:10.1021 / jo00107a006
- ^ ein b Amarnath, V.; Anthony, DC; Amarnath, K.; Valentine, WM; Wetterau, LA; Graham, DG (1991), “Intermediates in der Paal-Knorr-Synthese von Pyrrolen”, Das Journal of Organic Chemistry, 56 (24): 6924–6931, doi:10.1021 / jo00024a040
- ^ Thomas L. Gilchrist (1987). Heterocyclische Chemie. Harlow: Longman Scientific. ISBN 0-582-01421-2.
- ^ László Kürti; Barbara Czakó (2005), Strategische Anwendungen benannter Reaktionen in der organischen Synthese, Elsevier Science & Technology Books, ISBN 9780123694836
- ^ Adalbert Wollrab (1999), Organische Chemie Springer-Verlag, p. 850, ISBN 3-540-43998-6
- ^ ein b Campaigne, E.; Foye, WO (1952), “The Synthesis of 2,5-Diarylthiophenes”, Das Journal of Organic Chemistry, 17 (10): 1405–1412, doi:10.1021 / jo50010a023
- ^ Holman, RW (2005), “Strategische Anwendungen benannter Reaktionen in der organischen Synthese: Hintergrund und detaillierte Mechanismen (Kürti, László; Czakó, Barbara)”, Journal of Chemical Education, 82 (12): 1780, Bibcode:2005JChEd..82S1780H, doi:10.1021 / ed082p1780.3
- ^ Cormier, RA; Francis, MD (1981), “The Epoxyketone-Furan Rearrangement”, Synthetische Kommunikation, 11 (5): 365, doi:10.1080 / 00397918108064300
- ^ Ji, J.; Lu, X. (1993), “Einfache Synthese von 2,5-disubstituierten Furanen über Palladiumkomplex und perfluorierte Harzsulfonsäure-katalysierte Isomerisierung-Dehydratisierung von Alkinediolen”, Zeitschrift der Chemical Society, Chemical Communications (9): 764–765, doi:10.1039 / C39930000764
- ^ Minetto, G.; Raveglia, LF; Taddei, M. (2004), “Mikrowellenunterstützte Paal-Knorr-Reaktion. Ein schneller Ansatz für substituierte Pyrrole und Furane”, Bio-Briefe, 6 (3): 389–392, doi:10.1021 / ol0362820, PMID 14748600
- ^ Knorr, L. (1884), “Synthese von Pyrrolderivaten”, Berichte der deutschen Chemie Gesellschaft, 17 (2): 1635–1642, doi:10.1002 / cber.18840170220
- ^ Knorr, L. (1883), “Einwirkung von Acetessigester auf Phenylhydrazin”, Berichte der deutschen Chemie Gesellschaft, 16 (2): 2597–2599, doi:10.1002 / cber.188301602194
- ^ Trost, BM; Doherty, GA (2000), “Eine asymmetrische Synthese des tricyclischen Kerns und eine formale Totalsynthese von Roseophilin über eine Eninmetathese”, Zeitschrift der American Chemical Society, 122 (16): 3801–3810, doi:10.1021 / ja9941781
- ^ Hart, H.; Takehira, Y. (1982), “Addukte aus Furan-Makrocyclen und Benzin”, Das Journal of Organic Chemistry, 47 (22): 4370–4372, doi:10.1021 / jo00143a049



Recent Comments