Ahnenrekonstruktion – Wikipedia
Ahnenrekonstruktion (auch bekannt als Zeichenzuordnung oder Zeichenoptimierung) ist die zeitliche Extrapolation von gemessenen Merkmalen von Individuen (oder Populationen) zu ihren gemeinsamen Vorfahren. Es ist eine wichtige Anwendung der Phylogenetik, der Rekonstruktion und Untersuchung der evolutionären Beziehungen zwischen Individuen, Populationen oder Arten zu ihren Vorfahren. Im Kontext der Evolutionsbiologie kann die Ahnenrekonstruktion verwendet werden, um verschiedene Arten von Ahnencharakterzuständen von Organismen wiederherzustellen, die vor Millionen von Jahren lebten.[1] Diese Zustände umfassen die genetische Sequenz (Rekonstruktion der Ahnensequenz), die Aminosäuresequenz eines Proteins, die Zusammensetzung eines Genoms (z. B. Genreihenfolge), ein messbares Merkmal eines Organismus (Phänotyp) und den geografischen Bereich einer Ahnenpopulation oder Arten (Rekonstruktion des Ahnenbereichs). Dies ist wünschenswert, weil es uns ermöglicht, Teile von phylogenetischen Bäumen zu untersuchen, die der fernen Vergangenheit entsprechen, und die Evolutionsgeschichte der Arten im Baum zu klären. Da moderne genetische Sequenzen im Wesentlichen eine Variation alter Sequenzen sind, kann der Zugang zu alten Sequenzen andere Variationen und Organismen identifizieren, die aus diesen Sequenzen entstanden sein könnten.[2] Zusätzlich zu genetischen Sequenzen könnte man versuchen, die Veränderung eines Charakterzuges zu einem anderen zu verfolgen, beispielsweise Flossen, die sich zu Beinen drehen.
Nicht-biologische Anwendungen umfassen die Rekonstruktion des Wortschatzes oder der Phoneme alter Sprachen.[3] und kulturelle Merkmale alter Gesellschaften wie mündliche Überlieferungen[4] oder Ehepraktiken.[5]
Die Rekonstruktion der Ahnen beruht auf einem ausreichend realistischen statistischen Evolutionsmodell, um die Ahnenzustände genau wiederherzustellen. Diese Modelle verwenden die genetische Information, die bereits durch Methoden wie die Phylogenetik erhalten wurde, um den Weg zu bestimmen, den die Evolution eingeschlagen hat und wann evolutionäre Ereignisse aufgetreten sind.[6] Unabhängig davon, wie gut sich das Modell der tatsächlichen Evolutionsgeschichte annähert, verschlechtert sich die Fähigkeit, einen Vorfahren genau zu rekonstruieren, mit zunehmender Evolutionszeit zwischen diesem Vorfahren und seinen beobachteten Nachkommen. Darüber hinaus sind realistischere Evolutionsmodelle zwangsläufig komplexer und schwer zu berechnen. Fortschritte auf dem Gebiet der Ahnenrekonstruktion beruhten stark auf dem exponentiellen Wachstum der Rechenleistung und der damit einhergehenden Entwicklung effizienter Rechenalgorithmen (z. B. eines dynamischen Programmieralgorithmus für die gemeinsame Rekonstruktion von Ahnensequenzen mit maximaler Wahrscheinlichkeit).[7] Methoden der Ahnenrekonstruktion werden häufig auf einen bestimmten phylogenetischen Baum angewendet, der bereits aus denselben Daten abgeleitet wurde. Dieser Ansatz ist zwar praktisch, hat jedoch den Nachteil, dass seine Ergebnisse von der Genauigkeit eines einzelnen phylogenetischen Baums abhängen. Im Gegensatz dazu einige Forscher[8] befürworten einen rechenintensiveren Bayes’schen Ansatz, der die Unsicherheit bei der Baumrekonstruktion berücksichtigt, indem er die Rekonstruktion der Vorfahren über viele Bäume hinweg bewertet.
Geschichte[edit]
Das Konzept der Ahnenrekonstruktion wird häufig Emile Zuckerkandl und Linus Pauling zugeschrieben. Motiviert durch die Entwicklung von Techniken zur Bestimmung der Primärsequenz (Aminosäure) von Proteinen durch Frederick Sanger im Jahr 1955,[9] Zuckerkandl und Pauling postulierten[10] dass solche Sequenzen verwendet werden könnten, um nicht nur auf die Phylogenie zu schließen, die die beobachteten Proteinsequenzen betrifft, sondern auch auf die angestammte Proteinsequenz am frühesten Punkt (Wurzel) dieses Baumes. Die Idee, Vorfahren aus messbaren biologischen Merkmalen zu rekonstruieren, hatte sich jedoch bereits im Bereich der Kladistik entwickelt, einem der Vorläufer der modernen Phylogenetik. Kladistische Methoden, die bereits 1901 eingeführt wurden, leiten die evolutionären Beziehungen von Arten auf der Grundlage der Verteilung gemeinsamer Merkmale ab, von denen einige als von gemeinsamen Vorfahren abstammend abgeleitet werden. Darüber hinaus artikulierten Theodoseus Dobzhansky und Alfred Sturtevant 1938 die Prinzipien der Ahnenrekonstruktion in einem phylogenetischen Kontext, als sie auf die Evolutionsgeschichte chromosomaler Inversionen in Drosophila pseudoobscura.[11]
Der Wiederaufbau der Vorfahren hat also seine Wurzeln in mehreren Disziplinen. Heute werden Berechnungsmethoden für die Rekonstruktion von Vorfahren weiter ausgebaut und in einer Vielzahl von Umgebungen angewendet, so dass Ahnenzustände nicht nur für biologische Eigenschaften und die molekularen Sequenzen, sondern auch für die Struktur abgeleitet werden[12][13] oder katalytische Eigenschaften[14] der alten versus modernen Proteine, die geografische Lage von Populationen und Arten (Phylogeographie)[15][16] und die Struktur höherer Ordnung von Genomen.[17]
Methoden und Algorithmen[edit]
Jeder Versuch einer Ahnenrekonstruktion beginnt mit einer Phylogenie. Im Allgemeinen ist eine Phylogenie eine baumbasierte Hypothese über die Reihenfolge, in der Populationen (als Taxa bezeichnet) durch Abstammung von gemeinsamen Vorfahren in Beziehung gesetzt werden. Beobachtete Taxa werden durch die vertreten Tipps oder Endknoten des Baumes, die nach und nach durch Zweige mit ihren gemeinsamen Vorfahren verbunden sind, die durch die Verzweigungspunkte des Baumes dargestellt werden, die üblicherweise als die bezeichnet werden Ahnen- oder interne Knoten. Schließlich konvergieren alle Linien zum jüngsten gemeinsamen Vorfahren der gesamten Taxastichprobe. Im Zusammenhang mit der Rekonstruktion von Vorfahren wird eine Phylogenie oft so behandelt, als wäre sie eine bekannte Größe (wobei Bayes’sche Ansätze eine wichtige Ausnahme darstellen). Da es eine enorme Anzahl von Phylogenien geben kann, die bei der Erklärung der Daten nahezu gleich effektiv sind, kann die Reduzierung der von den Daten unterstützten Teilmenge der Phylogenien auf einen einzelnen Vertreter oder eine Punktschätzung eine bequeme und manchmal notwendige vereinfachende Annahme sein.
Die Rekonstruktion der Vorfahren kann als direktes Ergebnis der Anwendung eines hypothetischen Evolutionsmodells auf eine bestimmte Phylogenie angesehen werden. Wenn das Modell einen oder mehrere freie Parameter enthält, besteht das übergeordnete Ziel darin, diese Parameter auf der Grundlage gemessener Merkmale unter den beobachteten Taxa (Sequenzen) zu schätzen, die von gemeinsamen Vorfahren abstammen. Sparsamkeit ist eine wichtige Ausnahme von diesem Paradigma: Obwohl gezeigt wurde, dass es Umstände gibt, unter denen es der Maximum-Likelihood-Schätzer ist,[18] Im Kern basiert es einfach auf der Heuristik, dass Änderungen im Charakterzustand selten sind, ohne zu versuchen, diese Seltenheit zu quantifizieren.
Es gibt drei verschiedene Methodenklassen für die Rekonstruktion von Vorfahren. In der chronologischen Reihenfolge der Entdeckung sind dies maximale Sparsamkeit, maximale Wahrscheinlichkeit und Bayes’sche Inferenz. Maximale Sparsamkeit hält alle evolutionären Ereignisse für gleich wahrscheinlich; Die maximale Wahrscheinlichkeit berücksichtigt die unterschiedliche Wahrscheinlichkeit bestimmter Ereignisklassen. und die Bayeisan-Folgerung bezieht die bedingte Wahrscheinlichkeit eines Ereignisses auf die Wahrscheinlichkeit des Baums sowie auf die Menge an Unsicherheit, die mit diesem Baum verbunden ist. Maximale Sparsamkeit und maximale Wahrscheinlichkeit ergeben ein wahrscheinlichstes Ergebnis, während die Bayes’sche Inferenz Unsicherheiten in den Daten berücksichtigt und eine Stichprobe möglicher Bäume liefert.
Maximale Sparsamkeit[edit]
Sparsamkeit, umgangssprachlich als “Occams Rasiermesser” bekannt, bezieht sich auf das Prinzip der Auswahl der einfachsten konkurrierenden Hypothesen. Im Zusammenhang mit der Ahnenrekonstruktion bemüht sich Parsimony, die Verteilung der Ahnenzustände innerhalb eines bestimmten Baums zu finden, wodurch die Gesamtzahl der Änderungen des Zeichenzustands minimiert wird, die zur Erklärung der an den Baumspitzen beobachteten Zustände erforderlich wären. Diese Methode der maximalen Sparsamkeit[19] ist einer der frühesten formalisierten Algorithmen zur Rekonstruktion von Ahnenzuständen sowie einer der einfachsten.[13]
Maximale Sparsamkeit kann durch einen von mehreren Algorithmen implementiert werden. Eines der frühesten Beispiele ist die Methode von Fitch,[20] Dies weist Ahnencharakterzustände durch Sparsamkeit über zwei Durchquerungen eines verwurzelten Binärbaums zu. Die erste Phase ist eine Nachbestellungsüberquerung, die von den Spitzen zur Wurzel eines Baums führt, indem Nachkommenknoten (Kinderknoten) vor ihren Eltern besucht werden. Zunächst bestimmen wir den Satz möglicher Zeichenzustände S.ich für die ich-th Vorfahr basierend auf den beobachteten Charakterzuständen seiner Nachkommen. Jede Zuordnung ist der festgelegte Schnittpunkt der Zeichenzustände der Nachkommen des Vorfahren. Wenn der Schnittpunkt die leere Menge ist, ist es die Mengenvereinigung. Im letzteren Fall wird impliziert, dass zwischen dem Vorfahren und einem seiner beiden unmittelbaren Nachkommen eine Änderung des Zeichenzustands aufgetreten ist. Jedes dieser Ereignisse zählt für die Kostenfunktion des Algorithmus, die verwendet werden kann, um zwischen alternativen Bäumen auf der Grundlage maximaler Sparsamkeit zu unterscheiden. Als nächstes wird eine Vorbestellungsdurchquerung des Baums durchgeführt, wobei von der Wurzel zu den Spitzen vorgegangen wird. Die Zeichenzustände werden dann jedem Nachkommen zugewiesen, basierend darauf, welche Zeichenzustände er mit seinem übergeordneten Element teilt. Da die Wurzel keinen übergeordneten Knoten hat, kann es erforderlich sein, einen Zeichenzustand willkürlich auszuwählen, insbesondere wenn mehr als ein möglicher Zustand an der Wurzel rekonstruiert wurde.

Stellen Sie sich zum Beispiel eine Phylogenie vor, die für eine Pflanzengattung mit 6 Arten A – F gewonnen wurde, wobei jede Pflanze entweder von einer “Biene”, einem “Kolibri” oder einem “Wind” bestäubt wird. Eine offensichtliche Frage ist, was die Bestäuber an tieferen Knoten in der Phylogenie dieser Pflanzengattung waren. Unter maximaler Sparsamkeit zeigt eine Rekonstruktion des Ahnenzustands für diese Klade, dass “Kolibri” der sparsamste Ahnenzustand für die untere Klade (Pflanzen D, E, F) ist, den die Ahnenzustände für die Knoten in der oberen Klade (Pflanzen A, B, C) sind nicht eindeutig und beide Bestäuber “Kolibri” oder “Biene” sind für den Bestäubungszustand an der Wurzel der Phylogenie gleichermaßen plausibel. Angenommen, wir haben starke Beweise aus dem Fossilienbestand, dass der Wurzelzustand “Kolibri” ist. Die Auflösung der Wurzel in “Kolibri” würde das Muster der Rekonstruktion des Ahnenzustands ergeben, das durch die Symbole an den Knoten dargestellt wird, wobei der Zustand die geringsten eingekreisten Änderungen erfordert.
Parsimony-Methoden sind intuitiv ansprechend und hocheffizient, so dass sie in einigen Fällen immer noch verwendet werden, um Algorithmen zur Optimierung der maximalen Wahrscheinlichkeit mit einer anfänglichen Phylogenie zu erstellen.[21] Die zugrunde liegende Annahme, dass die Evolution so schnell wie möglich ein bestimmtes Endergebnis erreicht hat, ist jedoch ungenau. Natürliche Selektion und Evolution wirken nicht auf ein Ziel hin, sondern wählen einfach für oder gegen zufällig auftretende genetische Veränderungen. Parsimony-Methoden setzen sechs allgemeine Annahmen voraus: dass der von Ihnen verwendete phylogenetische Baum korrekt ist, dass Sie alle relevanten Daten haben, bei denen keine Fehler bei der Codierung gemacht wurden, dass sich alle Zweige des phylogenetischen Baums gleich wahrscheinlich ändern, dass sich der Die Evolutionsrate ist langsam und die Chance, ein Merkmal zu verlieren oder zu gewinnen, ist gleich.[1] In der Realität werden Annahmen häufig verletzt, was zu mehreren Problemen führt:
- Variation der Evolutionsraten. Die Methode von Fitch geht davon aus, dass Änderungen zwischen allen Zeichenzuständen gleich wahrscheinlich sind. Daher verursacht jede Änderung die gleichen Kosten für einen bestimmten Baum. Diese Annahme ist oft unrealistisch und kann die Genauigkeit solcher Methoden einschränken.[8] Beispielsweise treten Übergänge bei der Entwicklung von Nukleinsäuren häufiger auf als Übergänge. Diese Annahme kann gelockert werden, indem bestimmten Zeichenstatusänderungen Differenzkosten zugewiesen werden, was zu einem gewichteten Sparsamkeitsalgorithmus führt.[22]
- Schnelle Entwicklung. Das Ergebnis der Heuristik “Minimum Evolution”, die solchen Methoden zugrunde liegt, ist, dass solche Methoden davon ausgehen, dass Änderungen vorliegen Seltenund sind daher in Fällen unangemessen, in denen Änderungen eher die Norm als die Ausnahme sind.[23][24]
- Zeitliche Variation zwischen den Linien. Parsimony-Methoden gehen implizit davon aus, dass an jedem Ast des Baumes dieselbe Evolutionszeit vergangen ist. Daher berücksichtigen sie keine Variation der Astlängen im Baum, die häufig zur Quantifizierung des Verlaufs der evolutionären oder chronologischen Zeit verwendet werden. Diese Einschränkung lässt die Technik schließen, dass eine Änderung in einem sehr kurzen Zweig statt in mehreren Änderungen beispielsweise in einem sehr langen Zweig aufgetreten ist.[25] Darüber hinaus ist es möglich, dass einige Zweige des Baumes eine höhere Selektions- und Änderungsrate aufweisen als andere, möglicherweise aufgrund sich ändernder Umweltfaktoren. Einige Zeiträume können eine schnellere Entwicklung darstellen als andere, wenn dies geschieht, wird die Sparsamkeit ungenau.[26] Dieses Manko wird durch modellbasierte Methoden (sowohl Maximum-Likelihood- als auch Bayes-Methoden) behoben, die auf den stochastischen Evolutionsprozess schließen, der sich entlang jedes Zweigs eines Baumes entfaltet.[27]
- Statistische Begründung. Ohne ein der Methode zugrunde liegendes statistisches Modell weisen ihre Schätzungen keine genau definierten Unsicherheiten auf.[23][25][28]
- Konvergente Evolution. Bei der Betrachtung eines einzelnen Zeichenzustands geht Sparsamkeit automatisch davon aus, dass zwei Organismen, die dieses Merkmal teilen, enger miteinander verwandt sind als diejenigen, die dies nicht tun. Nur weil Hunde und Affen Fell haben, heißt das nicht, dass sie enger verwandt sind als Affen mit Menschen.
Maximale Wahrscheinlichkeit[edit]
Maximum Likelihood (ML) -Methoden zur Rekonstruktion des Ahnenzustands behandeln die Zeichenzustände an internen Knoten des Baums als Parameter und versuchen, die Parameterwerte zu finden, die die Wahrscheinlichkeit der Daten (die beobachteten Zeichenzustände) unter Berücksichtigung der Hypothese (ein Modell von) maximieren Evolution und eine Phylogenie in Bezug auf die beobachteten Sequenzen oder Taxa). Mit anderen Worten, diese Methode geht davon aus, dass die Ahnenzustände diejenigen sind, die angesichts der beobachteten Phänotypen statistisch am wahrscheinlichsten sind. Einige der frühesten ML-Ansätze zur Rekonstruktion von Vorfahren wurden im Kontext der genetischen Sequenzentwicklung entwickelt;[29][30] Ähnliche Modelle wurden auch für den analogen Fall der diskreten Charakterentwicklung entwickelt.[31]
Die Verwendung eines Evolutionsmodells erklärt die Tatsache, dass nicht alle Ereignisse gleich wahrscheinlich sind. Beispielsweise ist ein Übergang, bei dem es sich um eine Art Punktmutation von einem Purin zu einem anderen oder von einem Pyrimidin zu einem anderen handelt, viel wahrscheinlicher als eine Umwandlung, bei der es sich um die Wahrscheinlichkeit handelt, dass ein Purin zu einem Pyrimidin oder Laster umgeschaltet wird umgekehrt. Diese Unterschiede werden nicht durch maximale Sparsamkeit erfasst. Nur weil einige Ereignisse wahrscheinlicher sind als andere, bedeutet dies nicht, dass sie immer eintreten. Wir wissen, dass es im Laufe der Evolutionsgeschichte Zeiten gab, in denen eine große Lücke zwischen dem, was am wahrscheinlichsten geschah, und dem, was tatsächlich geschah, bestand. Wenn dies der Fall ist, kann maximale Sparsamkeit tatsächlich genauer sein, da sie eher bereit ist, große, unwahrscheinliche Sprünge zu machen als die maximale Wahrscheinlichkeit. Es hat sich gezeigt, dass die maximale Wahrscheinlichkeit bei der Rekonstruktion von Charakterzuständen ziemlich zuverlässig ist, aber es ist nicht so gut, genaue Schätzungen der Stabilität von Proteinen zu liefern. Die maximale Wahrscheinlichkeit überschätzt immer die Stabilität von Proteinen, was sinnvoll ist, da davon ausgegangen wird, dass die hergestellten und verwendeten Proteine die stabilsten und optimalsten waren.[13] Die Vorzüge der maximalen Wahrscheinlichkeit wurden diskutiert, wobei einige zu dem Schluss kamen, dass der Maximum-Likelihood-Test ein gutes Medium zwischen Genauigkeit und Geschwindigkeit darstellt.[32] Andere Studien haben jedoch beanstandet, dass die maximale Wahrscheinlichkeit zu viel Zeit und Rechenleistung erfordert, um in einigen Szenarien nützlich zu sein.[33]
Diese Ansätze verwenden das gleiche probabilistische Gerüst wie für die Schlussfolgerung des phylogenetischen Baums.[34] Kurz gesagt, die Entwicklung einer genetischen Sequenz wird durch einen zeitreversiblen zeitkontinuierlichen Markov-Prozess modelliert. Im einfachsten Fall durchlaufen alle Zeichen unabhängige Zustandsübergänge (wie Nukleotidsubstitutionen) mit einer konstanten Geschwindigkeit über die Zeit. Dieses Grundmodell wird häufig erweitert, um unterschiedliche Raten für jeden Ast des Baums zu ermöglichen. In der Realität können die Mutationsraten auch im Laufe der Zeit variieren (z. B. aufgrund von Umweltveränderungen). Dies kann modelliert werden, indem die Ratenparameter entlang des Baums entwickelt werden, auf Kosten einer erhöhten Anzahl von Parametern. Ein Modell definiert Übergangswahrscheinlichkeiten von Zuständen ich zu j entlang eines Zweigs der Länge t (in Einheiten der Evolutionszeit). Die Wahrscheinlichkeit einer Phylogenie wird aus einer verschachtelten Summe von Übergangswahrscheinlichkeiten berechnet, die der hierarchischen Struktur des vorgeschlagenen Baums entspricht. An jedem Knoten wird die Wahrscheinlichkeit seiner Nachkommen über alle möglichen Ahnenzeichenzustände an diesem Knoten summiert:
wo wir die Wahrscheinlichkeit des am Knoten verwurzelten Teilbaums berechnen x mit direkten Nachkommen y und z,
bezeichnet den Zeichenzustand des ich-ter Knoten,
ist die Verzweigungslänge (Evolutionszeit) zwischen Knoten ich und j, und
ist die Menge aller möglichen Zeichenzustände (zum Beispiel die Nukleotide A, C, G und T).[34] Ziel der Ahnenrekonstruktion ist es daher, die Zuordnung zu zu finden
für alle x interne Knoten, die die Wahrscheinlichkeit der beobachteten Daten für einen bestimmten Baum maximieren.
Grenz- und Gelenkwahrscheinlichkeit[edit]
Anstatt die Gesamtwahrscheinlichkeit für alternative Bäume zu berechnen, besteht das Problem bei der Ahnenrekonstruktion darin, die Kombination von Zeichenzuständen an jedem Ahnenknoten mit der höchsten maximalen Grenzwahrscheinlichkeit zu finden. Generell gibt es zwei Ansätze für dieses Problem. Erstens kann man jedem Vorfahren den wahrscheinlichsten Charakterzustand zuweisen, unabhängig von der Rekonstruktion aller anderen Ahnenzustände. Dieser Ansatz wird als bezeichnet marginale Rekonstruktion. Es ist vergleichbar mit der Summierung aller Kombinationen von Ahnenzuständen an allen anderen Knoten des Baums (einschließlich des Wurzelknotens), außer denen, für die Daten verfügbar sind. Bei der marginalen Rekonstruktion wird der Zustand am aktuellen Knoten gefunden, der die Wahrscheinlichkeit der Integration über alle anderen Zustände an allen Knoten im Verhältnis zu ihrer Wahrscheinlichkeit maximiert. Zweitens kann man stattdessen versuchen, die gemeinsame Kombination von Ahnencharakterzuständen im gesamten Baum zu finden, wodurch die Wahrscheinlichkeit des gesamten Datensatzes gemeinsam maximiert wird. Daher wird dieser Ansatz als gemeinsame Rekonstruktion bezeichnet.[29] Es überrascht nicht, dass die gemeinsame Rekonstruktion rechenintensiver ist als die marginale Rekonstruktion. Trotzdem wurden effiziente Algorithmen für die gemeinsame Rekonstruktion mit einer zeitlichen Komplexität entwickelt, die im Allgemeinen linear mit der Anzahl der beobachteten Taxa oder Sequenzen ist.[7]
ML-basierte Methoden zur Ahnenrekonstruktion bieten tendenziell eine größere Genauigkeit als MP-Methoden, wenn die Evolutionsraten zwischen den Zeichen (oder zwischen Standorten in einem Genom) variieren.[35][36] Diese Verfahren sind jedoch noch nicht in der Lage, zeitliche Schwankungen der Evolutionsraten zu berücksichtigen, was auch als Heterotachie bekannt ist. Wenn sich die Evolutionsrate für einen bestimmten Charakter in einem Zweig der Phylogenie beschleunigt, wird das Ausmaß der Evolution, das in diesem Zweig stattgefunden hat, für eine bestimmte Länge des Zweigs unterschätzt und eine konstante Evolutionsrate für diesen Charakter angenommen. Darüber hinaus ist es schwierig, Heterotachie von Variation zwischen Charakteren in Bezug auf die Evolutionsraten zu unterscheiden.[37]
Da ML (im Gegensatz zu maximaler Sparsamkeit) vom Prüfer die Angabe eines Evolutionsmodells verlangt, kann seine Genauigkeit durch die Verwendung eines grob inkorrekten Modells beeinträchtigt werden (Modellfehlspezifikation). Darüber hinaus kann ML nur eine einzige Rekonstruktion von Zeichenzuständen liefern (was oft als “Punktschätzung” bezeichnet wird) – wenn die Wahrscheinlichkeitsfläche stark nicht konvex ist und mehrere Peaks (lokale Optima) umfasst, kann eine einzelne Punktschätzung dies nicht bieten eine angemessene Darstellung, und ein Bayes’scher Ansatz kann geeigneter sein.
Bayesianische Folgerung[edit]
Die Bayes’sche Inferenz verwendet die Wahrscheinlichkeit beobachteter Daten, um die Überzeugung des Untersuchers oder die vorherige Verteilung zu aktualisieren und die hintere Verteilung zu erhalten. Im Kontext der Ahnenrekonstruktion besteht das Ziel darin, die hinteren Wahrscheinlichkeiten der Ahnencharakterzustände an jedem internen Knoten eines bestimmten Baums abzuleiten. Darüber hinaus kann man diese Wahrscheinlichkeiten über die posterioren Verteilungen über die Parameter des Evolutionsmodells und den Raum aller möglichen Bäume integrieren. Dies kann als Anwendung des Bayes-Theorems ausgedrückt werden:
wo S. repräsentiert die Ahnenzustände, D. entspricht den beobachteten Daten und
repräsentiert sowohl das Evolutionsmodell als auch den phylogenetischen Baum.
ist die Wahrscheinlichkeit der beobachteten Daten, die mit dem oben angegebenen Beschneidungsalgorithmus von Felsenstein berechnet werden können.
ist die vorherige Wahrscheinlichkeit der Ahnenzustände für ein bestimmtes Modell und einen bestimmten Baum. Schließlich,
ist die Wahrscheinlichkeit der Daten für ein bestimmtes Modell und einen bestimmten Baum, die über alle möglichen Ahnenzustände integriert sind.
Die Bayes’sche Folgerung ist die Methode, die viele für die genaueste gehalten haben.[8] Im Allgemeinen ermöglichen Bayes’sche statistische Methoden den Forschern, bereits vorhandene Informationen mit neuen Hypothesen zu kombinieren. Im Falle der Evolution wird die Wahrscheinlichkeit der beobachteten Daten mit der Wahrscheinlichkeit kombiniert, dass die Ereignisse in der Reihenfolge aufgetreten sind, in der sie aufgetreten sind, und gleichzeitig das Fehler- und Unsicherheitspotenzial erkannt. Insgesamt ist es die genaueste Methode zur Rekonstruktion der genetischen Sequenzen der Vorfahren sowie der Proteinstabilität.[25] Im Gegensatz zu den beiden anderen Methoden liefert die Bayes’sche Inferenz eine Verteilung möglicher Bäume, was genauere und leicht interpretierbare Schätzungen der Varianz möglicher Ergebnisse ermöglicht.[38]
Wir haben oben zwei Formulierungen angegeben, um die zwei unterschiedlichen Anwendungen des Bayes-Theorems hervorzuheben, die wir im folgenden Abschnitt diskutieren.
Empirische und hierarchische Bayes[edit]
Eine der ersten Implementierungen eines Bayes’schen Ansatzes zur Rekonstruktion von Ahnensequenzen wurde von Yang und Kollegen entwickelt.[29] wobei die Maximum-Likelihood-Schätzungen des Evolutionsmodells bzw. des Baums verwendet wurden, um die vorherigen Verteilungen zu definieren. Ihr Ansatz ist somit ein Beispiel für eine empirische Bayes-Methode zur Berechnung der posterioren Wahrscheinlichkeiten von Ahnencharakterzuständen; Diese Methode wurde erstmals im Softwarepaket PAML implementiert.[39] In Bezug auf die obige Bayes’sche Regelformulierung behebt die empirische Bayes-Methode
zu den empirischen Schätzungen des Modells und des Baums, die aus den Daten erhalten wurden, die effektiv fallen
von der hinteren Wahrscheinlichkeit und früheren Begriffen der Formel. Darüber hinaus Yang und Kollegen[29] verwendeten die empirische Verteilung von Ortsmustern (dh die Zuordnung von Nukleotiden zu Baumspitzen) bei ihrer Ausrichtung der beobachteten Nukleotidsequenzen im Nenner anstelle einer erschöpfenden Berechnung
über alle möglichen Werte von S. gegeben
. Computergestützt ähnelt die empirische Bayes-Methode der Maximum-Likelihood-Rekonstruktion von Ahnenzuständen, mit der Ausnahme, dass die Wahrscheinlichkeitsverteilungen selbst direkt gemeldet werden, anstatt nach der ML-Zuordnung von Zuständen basierend auf ihren jeweiligen Wahrscheinlichkeitsverteilungen an jedem internen Knoten zu suchen.
Empirische Bayes-Methoden zur Rekonstruktion von Vorfahren erfordern, dass der Forscher davon ausgeht, dass die Parameter und der Baum des Evolutionsmodells fehlerfrei bekannt sind. Wenn die Größe oder Komplexität der Daten dies zu einer unrealistischen Annahme macht, ist es möglicherweise vorsichtiger, den vollständig hierarchischen Bayes’schen Ansatz zu übernehmen und auf die gemeinsame posteriore Verteilung über die Zustände, das Modell und den Baum der Ahnencharaktere zu schließen.[40] Huelsenbeck und Bollback schlugen zuerst vor[40] Eine hierarchische Bayes-Methode zur Rekonstruktion von Vorfahren unter Verwendung von Markov-Ketten-Monte-Carlo-Methoden (MCMC), um Ahnensequenzen aus dieser gemeinsamen posterioren Verteilung abzutasten. Ein ähnlicher Ansatz wurde auch verwendet, um die Entwicklung der Symbiose mit Algen bei Pilzarten zu rekonstruieren (Lichenisierung).[41] Beispielsweise untersucht der Metropolis-Hastings-Algorithmus für MCMC die gemeinsame posteriore Verteilung, indem er Parameterzuweisungen auf der Grundlage des Verhältnisses der posterioren Wahrscheinlichkeiten akzeptiert oder ablehnt.
Einfach ausgedrückt berechnet der empirische Bayes-Ansatz die Wahrscheinlichkeiten verschiedener Ahnenzustände für einen bestimmten Baum und ein bestimmtes Evolutionsmodell. Indem man die Rekonstruktion von Ahnenzuständen als eine Reihe von Wahrscheinlichkeiten ausdrückt, kann man die Unsicherheit für die Zuordnung eines bestimmten Zustands zu einem Ahnen direkt quantifizieren. Andererseits mittelt der hierarchische Bayes-Ansatz diese Wahrscheinlichkeiten über alle möglichen Bäume und Evolutionsmodelle im Verhältnis zu der Wahrscheinlichkeit, mit der diese Bäume und Modelle angesichts der beobachteten Daten wahrscheinlich sind.
Ob die hierarchische Bayes-Methode in der Praxis einen wesentlichen Vorteil bringt, bleibt jedoch umstritten.[42] Darüber hinaus beschränkt sich dieser vollständig Bayes’sche Ansatz auf die Analyse einer relativ kleinen Anzahl von Sequenzen oder Taxa, da der Raum aller möglichen Bäume schnell zu groß wird, was es rechnerisch unmöglich macht, dass Kettenproben in angemessener Zeit konvergieren.
Kalibrierung[edit]
Die Rekonstruktion der Vorfahren kann anhand der beobachteten Zustände in historischen Proben bekannten Alters wie Fossilien oder Archivproben ermittelt werden. Da die Genauigkeit der Ahnenrekonstruktion im Allgemeinen mit zunehmender Zeit abnimmt, liefert die Verwendung solcher Exemplare Daten, die näher an den zu rekonstruierenden Ahnen liegen und höchstwahrscheinlich die Analyse verbessern, insbesondere wenn sich die Änderungsraten der Zeichen im Laufe der Zeit ändern. Dieses Konzept wurde durch eine experimentelle Evolutionsstudie bestätigt, in der replizierte Populationen des Bakteriophagen T7 vermehrt wurden, um eine künstliche Phylogenie zu erzeugen.[43] Bei der Überprüfung dieser experimentellen Daten haben Oakley und Cunningham[44] fanden heraus, dass maximale Sparsamkeitsmethoden den bekannten Ahnenzustand eines kontinuierlichen Charakters (Plaquegröße) nicht genau rekonstruieren konnten; Diese Ergebnisse wurden durch Computersimulation verifiziert. Dieses Versagen der Ahnenrekonstruktion wurde auf eine Richtungsverzerrung in der Entwicklung der Plaquegröße (von großen zu kleinen Plaquedurchmessern) zurückgeführt, die die Einbeziehung “versteinerter” Proben zur Adressierung erforderte.
Studien an beiden Fleischfressern von Säugetieren[45] und Fische[46] haben gezeigt, dass die rekonstruierten Schätzungen der Körpergrößen der Vorfahren ohne Einbeziehung fossiler Daten unrealistisch groß sind. Darüber hinaus zeigten Graham Slater und Kollegen[47] Die Verwendung von caniform carivivans, bei denen fossile Daten in frühere Verteilungen einbezogen wurden, verbesserte sowohl die Bayes’sche Schlussfolgerung der Ahnenzustände als auch die Auswahl des Evolutionsmodells im Vergleich zu Analysen, bei denen nur zeitgleiche Daten verwendet wurden.
Viele Modelle wurden entwickelt, um Ahnenzustände diskreter und kontinuierlicher Zeichen von vorhandenen Nachkommen abzuschätzen.[48] Solche Modelle gehen davon aus, dass die Entwicklung eines Merkmals im Laufe der Zeit als stochastischer Prozess modelliert werden kann. Bei Merkmalen mit diskreten Werten (wie “Bestäubertyp”) wird dieser Prozess normalerweise als Markov-Kette angesehen. Für kontinuierlich bewertete Merkmale (wie “Gehirngröße”) wird der Prozess häufig als Brownsche Bewegung oder als Ornstein-Uhlenbeck-Prozess angesehen. Auf der Grundlage dieses Modells als Grundlage für statistische Inferenz können nun Maximum-Likelihood-Methoden oder Bayes’sche Inferenz verwendet werden, um die Ahnenzustände abzuschätzen.
Modelle mit diskreten Zuständen[edit]
Angenommen, das betreffende Merkmal könnte in eines der folgenden Merkmale fallen
Zustände, beschriftet
. Das typische Mittel zur Modellierung der Evolution dieses Merkmals ist eine zeitkontinuierliche Markov-Kette, die kurz wie folgt beschrieben werden kann. Jedem Staat sind Übergangsraten zu allen anderen Staaten zugeordnet. Das Merkmal wird als Schritt zwischen dem modelliert
Zustände; Wenn es einen bestimmten Zustand erreicht, startet es eine exponentielle “Uhr” für jeden der anderen Zustände, zu denen es springen kann. Es “rast” dann die Uhren gegeneinander und macht einen Schritt in Richtung des Staates, dessen Uhr als erste klingelt. In einem solchen Modell sind die Parameter die Übergangsraten
Dies kann beispielsweise unter Verwendung von Maximum-Likelihood-Methoden geschätzt werden, bei denen über die Menge aller möglichen Zustandskonfigurationen der Ahnenknoten maximiert wird.

Um den Zustand eines bestimmten Ahnenknotens in der Phylogenie wiederherzustellen (nennen Sie diesen Knoten
) Nach maximaler Wahrscheinlichkeit lautet das Verfahren: Finden Sie die maximale Wahrscheinlichkeitsschätzung
von
;; Berechnen Sie dann die Wahrscheinlichkeit jedes möglichen Zustands für
Konditionierung auf
;; Wählen Sie schließlich den Ahnenzustand, der dies maximiert.[23] Man kann dieses Substitutionsmodell auch als Grundlage für ein Bayes’sches Inferenzverfahren verwenden, bei dem der hintere Glaube an den Zustand eines Ahnenknotens bei einem vom Benutzer ausgewählten Prior berücksichtigt wird.
Weil solche Modelle so viele haben können wie
Parameter, Überanpassung kann ein Problem sein. Einige gebräuchliche Optionen, die den Parameterraum reduzieren, sind:
- Markov -Status 1 Parametermodell: Dieses Modell ist die Zeitumkehr -Staatliches Gegenstück zum Jukes-Cantor-Modell. In diesem Modell haben alle Übergänge die gleiche Rate , unabhängig von ihrem Start- und Endzustand. Einige Übergänge können nicht zugelassen werden, indem erklärt wird, dass ihre Raten einfach 0 sind. Dies kann beispielsweise der Fall sein, wenn bestimmte Zustände nicht in einem einzigen Übergang von anderen Zuständen aus erreicht werden können.
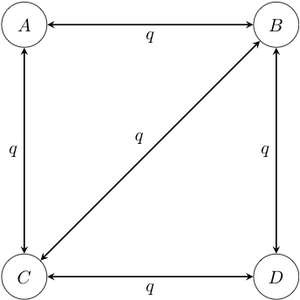 Beispiel eines 1-Parameter-Markov-Kettenmodells mit vier Zuständen. Beachten Sie, dass in diesem Diagramm Übergänge zwischen den Zuständen A und D nicht zulässig sind. Es ist üblich, den Pfeil nicht zu zeichnen, sondern mit einer Rate von 0.
Beispiel eines 1-Parameter-Markov-Kettenmodells mit vier Zuständen. Beachten Sie, dass in diesem Diagramm Übergänge zwischen den Zuständen A und D nicht zulässig sind. Es ist üblich, den Pfeil nicht zu zeichnen, sondern mit einer Rate von 0. - Asymmetrischer Markov -Status 2 Parametermodell: In diesem Modell ist der Zustandsraum geordnet (so dass beispielsweise Zustand 1 kleiner als Zustand 2 ist, der kleiner als Zustand 3 ist), und Übergänge können nur zwischen benachbarten Zuständen auftreten. Dieses Modell enthält zwei Parameter und : eine für die Rate der Zustandszunahme (z. B. 0 zu 1, 1 zu 2 usw.) und eine für die Rate der Zustandsabnahme (z. B. von 2 zu 1, 1 zu 0 usw.).
 Grafische Darstellung eines asymmetrischen Markov-Kettenmodells mit fünf Zuständen und zwei Parametern.
Grafische Darstellung eines asymmetrischen Markov-Kettenmodells mit fünf Zuständen und zwei Parametern.
Beispiel: Binärzustandsspeziation und Extinktionsmodell[edit]
Das binäre Zustandsspezifikations- und Extinktionsmodell[49] (BiSSE) ist ein diskretes Raummodell, das nicht direkt dem oben genannten Rahmen folgt. Es ermöglicht die Schätzung von binären Zeichenzuständen der Vorfahren zusammen mit Diversifikationsraten, die mit verschiedenen Zeichenzuständen verbunden sind. Es kann auch direkt auf ein allgemeineres Modell mit mehreren diskreten Zuständen erweitert werden. In seiner grundlegendsten Form umfasst dieses Modell sechs Parameter: zwei Speziationsraten (jeweils eine für Linien in den Zuständen 0 und 1); ähnlich zwei Extinktionsraten; und zwei Raten der Zeichenänderung. Dieses Modell ermöglicht das Testen von Hypothesen zu den Raten von Speziation / Extinktion / Charakteränderung auf Kosten der Erhöhung der Anzahl von Parametern.
Modelle mit kontinuierlichem Zustand[edit]
In dem Fall, in dem das Merkmal stattdessen nicht diskrete Werte annimmt, muss man sich stattdessen einem Modell zuwenden, in dem sich das Merkmal als kontinuierlicher Prozess entwickelt. Die Inferenz von Ahnenzuständen durch maximale Wahrscheinlichkeit (oder durch Bayes’sche Methoden) würde wie oben ablaufen, wobei jedoch die Wahrscheinlichkeit von Zustandsübergängen zwischen benachbarten Knoten durch eine andere kontinuierliche Wahrscheinlichkeitsverteilung gegeben wäre.

- Brownsche Bewegung: in diesem Fall, wenn Knoten und sind in der Phylogenie benachbart (sagen wir ist der Vorfahr von ) und durch einen Ast der Länge getrennt , die Wahrscheinlichkeit eines Übergangs von im Zustand sein zu im Zustand sein ist gegeben durch eine Gaußsche Dichte mit Mittelwert und Varianz In diesem Fall gibt es nur einen Parameter (), und das Modell geht davon aus, dass sich das Merkmal frei entwickelt, ohne eine Tendenz zur Zunahme oder Abnahme zu haben, und dass die Änderungsrate über die Zweige des phylogenetischen Baums konstant ist.[50]
- Ornstein-Uhlenbeck-Prozess: Kurz gesagt, ein Ornstein-Uhlenbeck-Prozess ist ein kontinuierlicher stochastischer Prozess, der sich wie eine Brownsche Bewegung verhält, jedoch zu einem zentralen Wert hingezogen wird, bei dem die Stärke der Anziehung mit der Entfernung von diesem Wert zunimmt.[51][52][53] Dies ist nützlich für die Modellierung von Szenarien, denen das Merkmal unterliegt stabilisierend Auswahl um einen bestimmten Wert (sagen wir ). Unter diesem Modell ist der oben beschriebene Übergang von im Zustand sein zu im Zustand sein hätte eine Wahrscheinlichkeit, die durch die Übergangsdichte eines Ornstein-Uhlenbeck-Prozesses mit zwei Parametern definiert wird: , die die Varianz der treibenden Brownschen Bewegung beschreibt, und , die die Stärke seiner Anziehungskraft auf beschreibt . Wie neigt dazu wird der Prozess durch seine Anziehungskraft auf immer weniger eingeschränkt und der Prozess wird zu einer Brownschen Bewegung. Aus diesem Grund können die Modelle verschachtelt sein, und es können Tests des Log-Likelihood-Verhältnisses durchgeführt werden, um festzustellen, welches der beiden Modelle geeignet ist.[50]
- Stabile Modelle der kontinuierlichen Charakterentwicklung:[54] Obwohl die Brownsche Bewegung als Modell kontinuierlicher Evolution ansprechend und nachvollziehbar ist, erlaubt sie weder eine Nichtneutralität in ihrer Grundform noch sieht sie eine Variation der Evolutionsrate im Laufe der Zeit vor. Stattdessen kann man einen stabilen Prozess verwenden, dessen Werte zu festen Zeiten als stabile Verteilungen verteilt werden, um die Entwicklung von Merkmalen zu modellieren. Stabile Prozesse verhalten sich grob gesagt wie Brownsche Bewegungen, die auch diskontinuierliche Sprünge beinhalten. Dies ermöglicht die geeignete Modellierung von Szenarien, in denen kurze Ausbrüche der schnellen Entwicklung von Merkmalen erwartet werden. In dieser Einstellung sind Maximum-Likelihood-Methoden aufgrund einer rauen Likelihood-Oberfläche und weil die Wahrscheinlichkeit beliebig groß gemacht werden kann, schlecht geeignet, so dass Bayes’sche Methoden besser geeignet sind.[54]
Anwendungen[edit]
Charakterentwicklung[edit]
Ahnenrekonstruktion wird häufig verwendet, um auf die ökologischen, phänotypischen oder biogeografischen Merkmale zu schließen, die mit Ahnenknoten in einem phylogenetischen Baum verbunden sind. Alle Methoden zur Rekonstruktion von Ahnenmerkmalen weisen Fallstricke auf, da sie mithilfe mathematischer Modelle vorhersagen, wie sich Merkmale mit großen Mengen fehlender Daten geändert haben. Diese fehlenden Daten umfassen die Zustände ausgestorbener Arten, die relativen Raten evolutionärer Veränderungen, die Kenntnis der anfänglichen Charakterzustände und die Genauigkeit phylogenetischer Bäume. In allen Fällen, in denen die Rekonstruktion von Ahnenmerkmalen verwendet wird, sollten die Ergebnisse mit einer Untersuchung der biologischen Daten begründet werden, die modellbasierte Schlussfolgerungen stützen. Griffith OW et al.[55]
Die Rekonstruktion der Vorfahren ermöglicht die Untersuchung von Evolutionswegen, adaptiver Selektion, Entwicklungsgenexpression,[56][57] und funktionale Divergenz der evolutionären Vergangenheit. Für eine Übersicht über biologische und rechnerische Techniken der Ahnenrekonstruktion siehe Chang et al..[58] Zur Kritik an Berechnungsmethoden für die Rekonstruktion von Vorfahren siehe Williams PD et al..[13]
Verhalten und Entwicklung der Lebensgeschichte[edit]
In gehörnten Eidechsen (Gattung Phrynosoma) hat sich die Viviparität (Lebendgeburt) auf der Grundlage von Methoden zur Rekonstruktion der Vorfahren mehrfach entwickelt.[59]
Diät-Rekonstruktion in Galapagos-Finken[edit]
Für die Bestrahlung von Finken auf den Galapagos-Inseln liegen sowohl phylogenetische als auch Charakterdaten vor. Diese Daten ermöglichen das Testen von Hypothesen bezüglich des Zeitpunkts und der Reihenfolge von Änderungen des Zeichenzustands im Laufe der Zeit über die Rekonstruktion des Ahnenzustands. Während der Trockenzeit können die Diäten der 13 Arten von Galapagos-Finken in drei große Diätkategorien eingeteilt werden: Erstens werden diejenigen, die getreideähnliche Lebensmittel konsumieren, als “Granivoren” betrachtet, diejenigen, die Arthropoden aufnehmen, werden als “Insektenfresser” bezeichnet und diejenigen, die konsumieren Vegetation werden als “Folivoren” klassifiziert.[23] Die Rekonstruktion des Ahnenzustands in der Nahrung unter Verwendung maximaler Sparsamkeit stellt zwei Hauptverschiebungen von einem insektenfressenden Zustand wieder her: eine in Granivorie und eine in Blattfrucht. Die Rekonstruktion des Ahnenzustands mit maximaler Wahrscheinlichkeit liefert weitgehend ähnliche Ergebnisse mit einem signifikanten Unterschied: dem gemeinsamen Vorfahren des Baumfinkes (Camarhynchus) und gemahlener Fink (Geospiza) Kladen sind höchstwahrscheinlich eher granivor als insektenfressend (gemessen an Sparsamkeit). In diesem Fall tritt dieser Unterschied zwischen Ahnenzuständen, die durch maximale Sparsamkeit und maximale Wahrscheinlichkeit zurückgegeben werden, wahrscheinlich aufgrund der Tatsache auf, dass ML-Schätzungen Verzweigungslängen des phylogenetischen Baums berücksichtigen.[23]
Morphologische und physiologische Charakterentwicklung[edit]
Phrynosomatide Eidechsen zeigen eine bemerkenswerte morphologische Vielfalt, einschließlich der relativen Zusammensetzung des Muskelfasertyps in ihren Hinterbeinmuskeln. Ahnenrekonstruktion basierend auf Sparsamkeit im Quadratwechsel (entspricht der maximalen Wahrscheinlichkeit unter der Entwicklung des Brownschen Bewegungscharakters[60]) weist darauf hin, dass gehörnte Eidechsen, eine der drei Hauptunterklassen der Linie, einen starken evolutionären Anstieg des Anteils schnell oxidierender glykolytischer Fasern in ihren Iliofibularis-Muskeln erfahren haben.[61]
Körpermasse von Säugetieren[edit]
In einer Analyse der Körpermasse von 1.679 plazentaren Säugetierspezies verglichen Elliot und Mooers stabile Modelle der kontinuierlichen Charakterentwicklung mit Brownschen Bewegungsmodellen[54] zeigten, dass der Evolutionsprozess, der die Entwicklung der Körpermasse von Säugetieren beschreibt, am besten durch ein stabiles Modell der kontinuierlichen Charakterentwicklung charakterisiert wird, das seltene Veränderungen von großem Ausmaß berücksichtigt. Unter einem stabilen Modell behielten Säugetiere der Vorfahren durch frühe Diversifizierung eine geringe Körpermasse bei, wobei ein starker Anstieg der Körpermasse mit dem Ursprung mehrerer Ordnungen von Arten mit großer Körpermasse (z. B. Huftiere) zusammenfiel. Im Gegensatz dazu ergab die Simulation unter einem Brownschen Bewegungsmodell eine weniger realistische, um eine Größenordnung größere Körpermasse bei angestammten Säugetieren, was eine signifikante Verringerung der Körpergröße vor der Entwicklung von Ordnungen mit geringer Körpergröße (z. B. Rodentia) erforderlich machte. Auf diese Weise erhalten stabile Modelle ein realistischeres Bild der Entwicklung der Körpermasse von Säugetieren, indem sie große Transformationen auf einer kleinen Teilmenge von Zweigen ermöglichen.[54]
[edit]
Phylogenetische Vergleichsmethoden (Schlussfolgerungen aus dem Vergleich verwandter Taxa) werden häufig verwendet, um biologische Merkmale zu identifizieren, die sich nicht unabhängig voneinander entwickeln und eine zugrunde liegende Abhängigkeit aufzeigen können. Zum Beispiel kann die Entwicklung der Form des Schnabels eines Finken mit seinem Futtersuchverhalten verbunden sein. Es ist jedoch nicht ratsam, diese Assoziationen durch direkten Vergleich von Messungen oder genetischen Sequenzen zu suchen, da diese Beobachtungen aufgrund ihrer Abstammung von gemeinsamen Vorfahren nicht unabhängig sind. Bei diskreten Zeichen wurde dieses Problem zunächst im Rahmen maximaler Sparsamkeit angegangen, indem bewertet wurde, ob zwei Zeichen dazu neigten, sich an denselben Zweigen des Baums zu ändern.[62][63]Felsenstein identifizierte dieses Problem für die kontinuierliche Charakterentwicklung und schlug eine Lösung ähnlich der Ahnenrekonstruktion vor, bei der die phylogenetische Struktur der Daten statistisch berücksichtigt wurde, indem die Analyse durch Berechnung von “unabhängigen Kontrasten” zwischen Knoten des Baums gesteuert wurde, die durch nicht überlappende Zweige verbunden sind .[28]
Molekulare Evolution[edit]
Auf molekularer Ebene können sich Aminosäurereste an verschiedenen Stellen eines Proteins nicht unabhängig voneinander entwickeln, da sie eine direkte physikochemische Wechselwirkung haben oder indirekt durch ihre Wechselwirkungen mit einem gemeinsamen Substrat oder durch weitreichende Wechselwirkungen in der Proteinstruktur. Umgekehrt könnte die gefaltete Struktur eines Proteins möglicherweise aus der Verteilung der Restwechselwirkungen abgeleitet werden.[64] Eine der frühesten Anwendungen der Ahnenrekonstruktion zur Vorhersage der dreidimensionalen Struktur eines Proteins durch Rückstandskontakte wurde von Shindyalov und Kollegen veröffentlicht.[65] Phylogenien, die 67 verschiedene Proteinfamilien betreffen, wurden durch eine entfernungsbasierte Clustering-Methode (ungewichtete Paargruppenmethode mit arithmetischem Mittelwert, UPGMA) erzeugt, und Ahnensequenzen wurden durch Sparsamkeit rekonstruiert. Die Autoren berichteten über eine schwache, aber signifikante Tendenz, dass sich gemeinsam entwickelnde Restpaare in der bekannten dreidimensionalen Struktur der Proteine befinden.
Die Rekonstruktion alter Proteine und DNA-Sequenzen ist erst seit kurzem ein bedeutendes wissenschaftliches Unterfangen. Die Entwicklung umfangreicher Genomsequenzdatenbanken in Verbindung mit Fortschritten in der Biotechnologie und phylogenetischen Inferenzmethoden hat die Rekonstruktion von Vorfahren billig, schnell und wissenschaftlich praktikabel gemacht. Dieses Konzept wurde angewendet, um sich gemeinsam entwickelnde Reste in Proteinsequenzen unter Verwendung fortschrittlicherer Methoden zur Rekonstruktion von Phylogenien und Ahnensequenzen zu identifizieren. Zum Beispiel wurde die Ahnenrekonstruktion verwendet, um sich gemeinsam entwickelnde Reste in Proteinen zu identifizieren, die von RNA-Virusgenomen codiert werden, insbesondere in HIV.[66][67][68]
Die Rekonstruktion von Ahnenproteinen und DNA ermöglicht die Wiederherstellung der Protein- und DNA-Evolution im Labor, so dass diese direkt untersucht werden kann.[58] In Bezug auf Proteine ermöglicht dies die Untersuchung der Entwicklung der heutigen molekularen Struktur und Funktion. Darüber hinaus kann die Rekonstruktion von Ahnenproteinen zur Entdeckung neuer biochemischer Funktionen führen, die in modernen Proteinen verloren gegangen sind.[69][70] Es ermöglicht auch Einblicke in die Biologie und Ökologie ausgestorbener Organismen.[71] Obwohl sich die Mehrzahl der Rekonstruktionen der Vorfahren mit Proteinen befasst hat, wurde es auch verwendet, um Evolutionsmechanismen auf der Ebene der Bakteriengenome zu testen[72] und Primatengensequenzen.[73]
Impfstoffdesign[edit]
RNA-Viren wie das Human Immunodeficiency Virus (HIV) entwickeln sich extrem schnell und um Größenordnungen schneller als Säugetiere oder Vögel. Für diese Organismen kann die Ahnenrekonstruktion auf einer viel kürzeren Zeitskala angewendet werden; Zum Beispiel, um den globalen oder regionalen Vorläufer einer Epidemie zu rekonstruieren, die sich über Jahrzehnte und nicht über Millionen von Jahren erstreckt hat. Ein Team um Brian Gaschen schlug vor[74] dass solche rekonstruierten Stämme als Ziele für Impfstoffdesignbemühungen verwendet werden, im Gegensatz zu Sequenzen, die heutzutage aus Patienten isoliert wurden. Da HIV äußerst vielfältig ist, funktioniert ein Impfstoff, der für die Viruspopulation eines Patienten entwickelt wurde, möglicherweise nicht für einen anderen Patienten, da der evolutionäre Abstand zwischen diesen beiden Viren möglicherweise groß ist. Ihr jüngster gemeinsamer Vorfahr ist jedoch näher an jedem der beiden Viren als aneinander. Ein Impfstoff, der für einen gemeinsamen Vorfahren entwickelt wurde, könnte daher eine bessere Chance haben, bei einem größeren Anteil zirkulierender Stämme wirksam zu sein. Ein anderes Team hat diese Idee weiterentwickelt und eine Methode zur Rekonstruktion des Baumzentrums entwickelt, um eine Sequenz zu erzeugen, deren evolutionärer Gesamtabstand zu zeitgenössischen Stämmen so gering wie möglich ist.[75] Genau genommen war diese Methode nicht Ahnen- Rekonstruktion, da die COT-Sequenz (Center-of-Tree) nicht unbedingt eine Sequenz darstellt, die jemals in der Evolutionsgeschichte des Virus existiert hat. Rolland und Kollegen stellten jedoch fest, dass im Fall von HIV das COT-Virus bei der Synthese funktionsfähig war. Ähnliche Experimente mit synthetischen Ahnensequenzen, die durch Rekonstruktion mit maximaler Wahrscheinlichkeit erhalten wurden, haben ebenfalls gezeigt, dass diese Ahnen sowohl funktionell als auch immunogen sind.[76][77] diesen Methoden Glaubwürdigkeit verleihen. Darüber hinaus kann die Rekonstruktion der Vorfahren möglicherweise verwendet werden, um auf die genetische Sequenz der übertragenen HIV-Varianten zu schließen, die zur Etablierung der nächsten Infektion herangezogen wurden, mit dem Ziel, Unterscheidungsmerkmale dieser Varianten zu identifizieren (als nicht zufällige Auswahl der übertragenen Population von Viren), die für das Impfstoffdesign bestimmt sein können.[78]
Genomumlagerungen[edit]
Anstatt auf die DNA-Sequenz der Vorfahren zu schließen, könnte man sich für die größere molekulare Struktur und den Inhalt eines Genoms der Vorfahren interessieren. Dieses Problem wird häufig in einem kombinatorischen Rahmen angegangen, indem Genome als Permutationen von Genen oder homologen Regionen modelliert werden. Für diese Permutationen sind verschiedene Operationen zulässig, z. B. eine Inversion (ein Segment der Permutation wird an Ort und Stelle umgekehrt), ein Löschen (ein Segment wird entfernt), eine Transposition (ein Segment wird aus einem Teil der Permutation entfernt und an einer anderen Stelle gespleißt) ) oder Gewinn an genetischem Inhalt durch Rekombination, Duplikation oder horizontalen Gentransfer. Das “Problem der Genomumlagerung”, das zuerst von Watterson und Kollegen gestellt wurde,[17] fragt: Was ist bei zwei Genomen (Permutationen) und einer Reihe zulässiger Operationen die kürzeste Sequenz von Operationen, die ein Genom in das andere transformieren? Eine Verallgemeinerung dieses Problems, das auf die Rekonstruktion von Vorfahren anwendbar ist, ist das “Problem der Umlagerung mehrerer Genome”:[79] Finden Sie bei einer Reihe von Genomen und einer Reihe zulässiger Operationen (i) einen binären Baum mit den gegebenen Genomen als Blättern und (ii) eine Zuordnung von Genomen zu den internen Knoten des Baums, so dass die Gesamtzahl der Operationen über den gesamten Baum wird minimiert. Dieser Ansatz ähnelt der Sparsamkeit, außer dass der Baum zusammen mit den Ahnensequenzen abgeleitet wird. Leider ist sogar das Problem der Umlagerung einzelner Genome NP-schwer,[80] obwohl es in Mathematik und Informatik viel Aufmerksamkeit erhalten hat (für eine Übersicht siehe Fertin und Kollegen[81]).
Die Rekonstruktion von Ahnengenomen wird auch als Karyotyprekonstruktion bezeichnet. Die Chromosomenmalerei ist derzeit die wichtigste experimentelle Technik.[82][83] Kürzlich haben Forscher Berechnungsmethoden entwickelt, um den Karyotyp der Vorfahren zu rekonstruieren, indem sie die vergleichende Genomik nutzen.[84][85] Darüber hinaus wurde eine vergleichende Genomik und Rekonstruktion des Ahnengenoms angewendet, um alte horizontale Gentransferereignisse beim letzten gemeinsamen Vorfahren einer Linie zu identifizieren (z Candidatus Accumulibacter phosphatis[86]) um die evolutionäre Basis für den Erwerb von Merkmalen zu identifizieren.
Raumanwendungen[edit]
Migration[edit]
Die Rekonstruktion der Vorfahren ist nicht auf biologische Merkmale beschränkt. Die räumliche Lage ist ebenfalls ein Merkmal, und Methoden zur Rekonstruktion der Vorfahren können auf die Standorte der Vorfahren der betrachteten Personen schließen. Solche Techniken wurden von Lemey und Kollegen verwendet[16] geografische Verfolgung der Vorfahren von 192 Aviären Influenza A-H5N1-Stämmen, die aus zwanzig Orten in Europa und Asien entnommen wurden, und von 101 Tollwutvirus-Sequenzen, die in zwölf afrikanischen Ländern entnommen wurden.
Die Behandlung von Standorten als diskrete Staaten (Länder, Städte usw.) ermöglicht die Anwendung der oben beschriebenen Modelle für diskrete Staaten. Anders als in einem Modell, in dem der Zustandsraum für das Merkmal klein ist, kann es jedoch viele Orte geben, und Übergänge zwischen bestimmten Zustandspaaren können selten oder nie auftreten. Beispielsweise kann die Migration zwischen entfernten Orten niemals direkt erfolgen, wenn kein Flugverkehr zwischen den beiden Orten besteht. Daher müssen solche Migrationen zuerst zwischen Zwischenorten verlaufen. Dies bedeutet, dass das Modell viele Parameter enthalten kann, die Null oder nahe Null sind. Zu diesem Zweck verwendeten Lemey und Kollegen ein Bayes’sches Verfahren, um nicht nur die Parameter und Ahnenzustände zu schätzen, sondern auch auszuwählen, welche Migrationsparameter nicht Null sind. Ihre Arbeit legt nahe, dass dieses Verfahren zu einer effizienteren Nutzung der Daten führt. Sie untersuchen auch die Verwendung früherer Verteilungen, die geografische Strukturen oder Hypothesen zur Migrationsdynamik enthalten, und stellen fest, dass diejenigen, die sie in Betracht zogen, nur geringe Auswirkungen auf die Ergebnisse hatten.
Mithilfe dieser Analyse stellte das Team um Lemey fest, dass Guangdong das wahrscheinlichste Diffusionszentrum für A-H5N1 ist, wobei Hongkong auch Unterstützung von hinten erhält. Darüber hinaus stützen ihre Ergebnisse die Hypothese einer langjährigen Präsenz afrikanischer Tollwut in Westafrika.
Artenbereiche[edit]
Der Rückschluss auf historische biogeografische Muster erfordert häufig die Rekonstruktion von Artenbereichen der Vorfahren auf phylogenetischen Bäumen.[87] Zum Beispiel eine gut aufgelöste Phylogenie von Pflanzenarten in der Gattung Cyrtandra[87] wurde zusammen mit Informationen über ihre geografischen Bereiche verwendet, um vier Methoden zur Rekonstruktion des Ahnenbereichs zu vergleichen. Das Team verglich Fitch Sparsamkeit,[20] (FP; Sparsamkeit) stochastische Kartierung[88] (SM; maximale Wahrscheinlichkeit), Dispersions-Vikarianz-Analyse[89] (DIVA; Sparsamkeit) und Dispersions-Extinktions-Cladogenese[15][90] (DEC; Maximum-Likelihood). Die Ergebnisse zeigten, dass beide Parsimony-Methoden schlecht abschnitten, was wahrscheinlich darauf zurückzuführen war, dass bei Parsimony-Methoden die Verzweigungslängen nicht berücksichtigt wurden. Beide Maximum-Likelihood-Methoden zeigten eine bessere Leistung. DEC-Analysen, die zusätzlich die Einbeziehung geologischer Prioritäten ermöglichen, ergaben jedoch realistischere Rückschlüsse auf die Bereichsentwicklung in Cyrtandra relativ zu anderen Methoden.[87]
Eine andere Maximum-Likelihood-Methode stellt die phylogeografische Vorgeschichte eines Gens wieder her[91] durch Rekonstruktion der Ahnenorte der in die Stichprobe einbezogenen Taxa. Diese Methode setzt ein räumlich explizites Zufallsmodell der Migration voraus, um die Standorte der Vorfahren anhand der geografischen Koordinaten der Personen zu rekonstruieren, die durch die Spitzen des phylogenetischen Baums dargestellt werden. Bei Anwendung auf einen phylogenetischen Baum von Chorfröschen Pseudacris feriarumMit dieser Methode wurden die jüngste Expansion nach Norden, eine größere Ausbreitungsentfernung pro Generation in der kürzlich kolonisierten Region, ein nicht zentraler Stammort und eine gerichtete Migration wiederhergestellt.[91]

Die erste Betrachtung des Problems der multiplen Genomumlagerung, lange vor seiner Formalisierung im Hinblick auf Permutationen, wurde 1936 von Sturtevant und Dobzhansky vorgestellt.[92] Sie untersuchten das Genom mehrerer Fruchtfliegenstämme aus verschiedenen geografischen Regionen und stellten fest, dass eine Konfiguration, die sie als “Standard” bezeichneten, in allen untersuchten Gebieten am häufigsten vorkam. Bemerkenswerterweise stellten sie auch fest, dass vier verschiedene Stämme durch eine einzige Inversion aus der Standardsequenz erhalten werden konnten und zwei andere durch eine zweite Inversion in Beziehung gesetzt werden konnten. Dies ermöglichte es ihnen, eine Phylogenie für die Sequenzen zu vermuten und daraus zu schließen, dass die Standardsequenz wahrscheinlich auch die der Vorfahren war.
Sprachliche Entwicklung[edit]
Rekonstruktionen der Wörter und Phänomene alter Proto-Sprachen wie Proto-Indo-European wurden basierend auf den beobachteten Analoga in heutigen Sprachen durchgeführt. Typischerweise werden diese Analysen manuell unter Verwendung der “Vergleichsmethode” durchgeführt.[93] Zunächst werden Wörter aus verschiedenen Sprachen mit einer gemeinsamen Etymologie (verwandte) in den untersuchten zeitgenössischen Sprachen identifiziert, analog zur Identifizierung orthologer biologischer Sequenzen. Zweitens werden Entsprechungen zwischen einzelnen Geräuschen in den Verwandten identifiziert, ein Schritt ähnlich der Ausrichtung der biologischen Sequenz, obwohl er manuell durchgeführt wird. Schließlich werden wahrscheinliche Ahnengeräusche durch manuelle Inspektion und verschiedene Heuristiken angenommen (wie die Tatsache, dass die meisten Sprachen sowohl nasale als auch nicht-nasale Vokale haben).[93]
Software[edit]
Es sind viele Softwarepakete verfügbar, mit denen die Rekonstruktion des Ahnenzustands durchgeführt werden kann. Im Allgemeinen wurden diese Softwarepakete durch die Bemühungen von Wissenschaftlern auf verwandten Gebieten entwickelt und gewartet und unter Lizenzen für freie Software veröffentlicht. Die folgende Tabelle ist nicht als umfassende Auflistung aller verfügbaren Pakete gedacht, sondern bietet eine repräsentative Auswahl der umfangreichen Paketvielfalt, die Methoden zur Rekonstruktion von Vorfahren mit unterschiedlichen Stärken und Merkmalen implementiert.
| Name | Methoden | Plattform | Eingänge | ! Zeichentypen | Kontinuierliche (C) oder diskrete Zeichen (D) | Softwarelizenz |
|---|---|---|---|---|---|---|
| PAML | Maximale Wahrscheinlichkeit | Unix, Mac, Win | PHYLIP, NEXUS, FASTA | Nukleotid, Protein | D. | GNU General Public License, Version 3 |
| TIER | Bayesian | Unix, Mac, Win | NEXUS, BEAST XML | Nucleotid, Protein, geographisch | C, D. | GNU Lesser General Public License |
| Phytools | Maximale Wahrscheinlichkeit | Unix, Mac, Win | Newick, Nexus | Qualitative und quantitative Merkmale | C, D. | GNU General Public License |
| AFFE | Maximale Wahrscheinlichkeit | Unix, Mac, Win | NEXUS, FASTA, CLUSTAL | Nukleotid, Protein | C, D. | GNU General Public License |
| Diversitree | Maximale Wahrscheinlichkeit | Unix, Mac, Win | NEXUS | Qualitative und quantitative Merkmale, geografisch | C, D. | GNU General Public License, Version 2 |
| HyPhy | Maximale Wahrscheinlichkeit | Unix, Mac, Win | MEGA, NEXUS, FASTA, PHYLIP | Nucleotid, Protein (anpassbar) | D. | GNU Free Documentation License 1.3 |
| BayesTraits | Bayesian | Unix, Mac, Win | TSV oder durch Leerzeichen getrennte Tabelle. Zeilen sind Arten, Spalten sind Merkmale. | Qualitative und quantitative Merkmale | C, D. | Creative Commons Namensnennung-Lizenz |
| Lagrange | Maximale Wahrscheinlichkeit | Linux, Mac, Win | TSV / CSV von Artenregionen. Zeilen sind Arten und Spalten sind geografische Regionen | Geografisch | – – | GNU General Public License, Version 2 |
| Mesquite | Sparsamkeit, maximale Wahrscheinlichkeit | Unix, Mac, Win | Fasta, NBRF, Genbank, PHYLIP, CLUSTAL, TSV | Nukleotid, Protein, Geografisch | C, D. | Creative Commons Attribution 3.0-Lizenz |
| Phylomapper | Maximale Wahrscheinlichkeit, Bayesian (ab Version 2) | Unix, Mac, Win | NEXUS | Geografische, ökologische Nische | C, D. | – – |
| Vorfahren | Maximale Wahrscheinlichkeit | Netz | Fasta | Nucleotid (Indels) | D. | – – |
| Phyrex | Maximale Sparsamkeit | Linux | Fasta | Genexpression | C, D. | Proprietär |
| SIMMAP | Stochastisches Mapping | Mac | XML-ähnliches Format | Nukleotid, qualitative Merkmale | D. | Proprietär |
| MrBayes | Bayesian | Unix, Mac, Win | NEXUS | Nukleotid, Protein | D. | GNU General Public License |
| PARANA | Maximale Sparsamkeit | Unix, Mac, Win | Newick | Biologische Netzwerke | D. | Apache-Lizenz |
| PHAST (PREQUEL) | Maximale Wahrscheinlichkeit | Unix, Mac, Win | Mehrfachausrichtung | Nukleotid | D. | BSD-Lizenz |
| RASPEL | Maximale Wahrscheinlichkeit, Bayesian | Unix, Mac, Win | Newick | Geografisch | D. | – – |
| VIP | Maximale Sparsamkeit | Linux, Win | Newick | Geografisch | D (Gitter) | GPL Creative Commons |
| FastML | Maximale Wahrscheinlichkeit | Web, Unix | Fasta | Nukleotid, Protein | D. | Urheberrechte © |
| MLGO | Maximale Wahrscheinlichkeit | Netz | Benutzerdefiniert | Permutation der Genordnung | D. | GNU |
| DACHS | Bayesian | Unix, Mac, Win | Benutzerdefiniert | Permutation der Genordnung | D. | GNU GPL Version 2 |
| ANZAHL | Maximale Sparsamkeit, maximale Wahrscheinlichkeit | Unix, Mac, Win | Tabulatorgetrennte Textdatei mit Zeilen für Taxa und Zähldaten in Spalten. | Zählen Sie (numerische) Daten (z. B. Größe der Homologenfamilie). | D. | BSD |
| MEGA | Maximale Sparsamkeit, maximale Wahrscheinlichkeit. | Mac, Win | MEGA | Nukleotid, Protein | D. | Proprietär |
| WINKEL | Lokale Sparsamkeit | Unix | Benutzerdefiniert | Genomkarten | D. | GNU General Public License, Version 3 |
| ENTZIFFERN | Maximale Wahrscheinlichkeit | Unix, Mac, Win | FASTA, GenBank | Nukleotid | D. | GNU General Public License, Version 3 |
| EREM | Maximale Wahrscheinlichkeit. | Win, Unix, Matlab-Modul | Benutzerdefiniertes Textformat für Modellparameter, Baum, beobachtete Zeichenwerte. | Binär | D. | Keine Angabe, obwohl die Website angibt, dass Software frei verfügbar ist. |
Paketbeschreibungen[edit]
Molekulare Evolution[edit]
Die meisten dieser Softwarepakete dienen zur Analyse genetischer Sequenzdaten. Zum Beispiel PAML[94] ist eine Sammlung von Programmen zur phylogenetischen Analyse von DNA- und Proteinsequenz-Alignments mit maximaler Wahrscheinlichkeit. Die Rekonstruktion der Vorfahren kann mit dem durchgeführt werden codeml Programm. Darüber hinaus ist LAZARUS eine Sammlung von Python-Skripten, die die Ahnenrekonstruktionsfunktionen von PAML für die Stapelverarbeitung und eine einfachere Verwendung umschließen.[95] Softwarepakete wie MEGA, HyPhy und Mesquite führen ebenfalls eine phylogenetische Analyse von Sequenzdaten durch, sind jedoch modularer und anpassbarer gestaltet. HyPhy[96] implementiert eine gemeinsame Maximum-Likelihood-Methode zur Rekonstruktion von Ahnensequenzen[7] Dies kann leicht angepasst werden, um einen allgemeineren Bereich diskreter Ahnencharakterzustände wie geografische Standorte zu rekonstruieren, indem ein benutzerdefiniertes Modell in seiner Stapelsprache angegeben wird. Mesquite[97] bietet Methoden zur Rekonstruktion des Ahnenzustands sowohl für diskrete als auch für kontinuierliche Zeichen unter Verwendung von Methoden mit maximaler Sparsamkeit und maximaler Wahrscheinlichkeit. Es bietet auch verschiedene Visualisierungswerkzeuge zur Interpretation der Ergebnisse der Ahnenrekonstruktion. MEGA[98] ist ebenfalls ein modulares System, legt jedoch größeren Wert auf Benutzerfreundlichkeit als auf die Anpassung von Analysen. Ab Version 5 ermöglicht MEGA dem Benutzer die Rekonstruktion von Ahnenzuständen mit maximaler Sparsamkeit, maximaler Wahrscheinlichkeit und empirischen Bayes-Methoden.[98]
Die Bayes’sche Analyse genetischer Sequenzen kann der Fehlspezifikation des Modells eine größere Robustheit verleihen. MrBayes[99] ermöglicht die Inferenz von Ahnenzuständen an Ahnenknoten unter Verwendung des vollständigen hierarchischen Bayes’schen Ansatzes. Das im PHAST-Paket verteilte PREQUEL-Programm[100] führt eine vergleichende evolutionäre Genomik unter Verwendung der Rekonstruktion der Ahnensequenz durch. SIMMAP[101] kartiert stochastisch Mutationen auf Phylogenien. BayesTraits[31] analysiert diskrete oder kontinuierliche Zeichen in einem Bayes’schen Rahmen, um Evolutionsmodelle zu bewerten, Ahnenzustände zu rekonstruieren und korrelierte Evolution zwischen Merkmalspaaren zu erkennen.
Andere Zeichentypen[edit]
Andere Softwarepakete sind eher auf die Analyse qualitativer und quantitativer Merkmale (Phänotypen) ausgerichtet. Zum Beispiel die Affe Paket[102] In der statistischen Rechenumgebung bietet R auch Methoden zur Rekonstruktion des Ahnenzustands sowohl für diskrete als auch für kontinuierliche Zeichen durch die ‘As‘Funktion, einschließlich maximaler Wahrscheinlichkeit. Phyrex implementiert einen auf maximaler Sparsamkeit basierenden Algorithmus zur Rekonstruktion von Genexpressionsprofilen der Vorfahren sowie eine Maximum-Likelihood-Methode zur Rekonstruktion genetischer Sequenzen der Vorfahren (durch Umwickeln der Baseml-Funktion in PAML).[103]
Mehrere Softwarepakete rekonstruieren auch die Phylogeographie. BEAST (Bayesianische Evolutionsanalyse durch Probenahme von Bäumen)[104] bietet Tools zum Rekonstruieren von geografischen Standorten von Vorfahren aus beobachteten Sequenzen, die mit Standortdaten versehen sind, unter Verwendung von Bayesian MCMC-Stichprobenverfahren. Diversitree[105] ist ein R-Paket, das Methoden zur Rekonstruktion des Ahnenzustands unter Mk2 (ein zeitkontinuierliches Markov-Modell der binären Zeichenentwicklung) bereitstellt.[106] und BiSSE-Modelle (Binary State Speciation and Extinction). Lagrange führt Analysen zur Rekonstruktion der Entwicklung des geografischen Bereichs an phylogenetischen Bäumen durch.[15] Phylomapper[91] ist ein statistischer Rahmen zur Schätzung historischer Muster des Genflusses und der geografischen Standorte der Vorfahren. RASPEL[107] leitet Ahnenzustände unter Verwendung statistischer Dispersions-Vikarianz-Analyse-, Lagrange-, Bayes-Lagrange-, BayArea- und BBM-Methoden ab. VIP[108] leitet die historische Biogeographie ab, indem disjunkte geografische Verteilungen untersucht werden.
Genomumlagerungen liefern wertvolle Informationen für die vergleichende Genomik zwischen Arten. WINKEL[109] vergleicht vorhandene verwandte Genome durch Rekonstruktion genetischer Marker durch Vorfahren. DACHS[110] verwendet einen Bayes’schen Ansatz zur Untersuchung der Geschichte der Genumlagerung. Anzahl[111] rekonstruiert die Entwicklung der Größe von Genfamilien. EREM[112] analysiert den Gewinn und Verlust genetischer Merkmale, die durch binäre Zeichen codiert werden. PARANA[113] führt eine auf Sparsamkeit basierende Inferenz von biologischen Netzwerken der Vorfahren durch, die Genverlust und Duplikation darstellen.
Web Applikationen[edit]
Schließlich gibt es mehrere Webserver-basierte Anwendungen, mit denen Ermittler Maximum-Likelihood-Methoden für die Ahnenrekonstruktion verschiedener Zeichentypen verwenden können, ohne Software installieren zu müssen. Zum Beispiel Vorfahren[114] ist ein Webserver für die Rekonstruktion des Ahnengenoms durch Identifizierung und Anordnung syntenischer Regionen. FastML[115] ist ein Webserver zur probabilistischen Rekonstruktion von Ahnensequenzen mit maximaler Wahrscheinlichkeit, der ein Lückenzeichenmodell zur Rekonstruktion der Indelvariation verwendet. MLGO[116] ist ein Webserver für die Analyse der Genreihenfolge mit maximaler Wahrscheinlichkeit.
Zukünftige Richtungen[edit]
Die Entwicklung und Anwendung von Berechnungsalgorithmen für die Rekonstruktion von Vorfahren ist weiterhin ein aktives Forschungsgebiet über Disziplinen hinweg. Beispielsweise ist die Rekonstruktion von Sequenzinsertionen und -deletionen (Indels) hinter der einfacheren Anwendung von Substitutionsmodellen zurückgeblieben. Bouchard-Côté und Jordan haben kürzlich ein neues Modell beschrieben (den Poisson Indel-Prozess).[117] Dies ist ein wichtiger Fortschritt gegenüber dem archetypischen Thorne-Kishino-Felsenstein-Modell der Indel-Evolution.[118] Darüber hinaus wird das Gebiet durch schnelle Fortschritte auf dem Gebiet der Sequenzierungstechnologie der nächsten Generation vorangetrieben, bei der Sequenzen aus Millionen von Nukleinsäuretemplaten durch umfassende Parallelisierung von Sequenzierungsreaktionen in einem kundenspezifischen Gerät erzeugt werden. Diese Fortschritte haben es möglich gemacht, eine “tiefe” Momentaufnahme der genetischen Zusammensetzung einer sich schnell entwickelnden Population wie RNA-Viren zu erstellen[119] oder Tumorzellen,[120] in relativ kurzer Zeit. Gleichzeitig hat die enorme Datenmenge und die plattformspezifischen Sequenzierungsfehlerprofile neue bioinformatische Herausforderungen für die Verarbeitung dieser Daten für die Rekonstruktion von Ahnensequenzen geschaffen.
Siehe auch[edit]
Verweise[edit]
![]() Dieser Artikel wurde aus der folgenden Quelle unter a angepasst CC BY 4.0 Lizenz (2015) (Gutachterberichte): “Ahnenrekonstruktion”. PLOS Computational Biology. 12 (7): e1004763. 12. Juli 2016. doi:10.1371 / JOURNAL.PCBI.1004763. ISSN 1553-734X. PMC 4942178. PMID 27404731. Wikidata Q28596371.
Dieser Artikel wurde aus der folgenden Quelle unter a angepasst CC BY 4.0 Lizenz (2015) (Gutachterberichte): “Ahnenrekonstruktion”. PLOS Computational Biology. 12 (7): e1004763. 12. Juli 2016. doi:10.1371 / JOURNAL.PCBI.1004763. ISSN 1553-734X. PMC 4942178. PMID 27404731. Wikidata Q28596371.
- ^ ein b Omland, Kevin E. (1999). “Die Annahmen und Herausforderungen der Rekonstruktion des Ahnenstaates”. Systematische Biologie. 48 (3): 604–611. doi:10.1080 / 106351599260175. ISSN 1063-5157.
- ^ Cai, Wei; Pei, Jimin; Grishin, Nick V (2004). “Rekonstruktion von Proteinsequenzen der Vorfahren und ihre Anwendungen”. BMC Evolutionsbiologie. 4 (1): 33. doi:10.1186 / 1471-2148-4-33. ISSN 1471-2148. PMC 522809. PMID 15377393.
- ^ Platnick, Norman I.; Cameron, H. Don (1977). “Kladistische Methoden in der textuellen, sprachlichen und phylogenetischen Analyse”. Systematische Zoologie. 26 (4): 380. doi:10.2307 / 2412794. ISSN 0039-7989. JSTOR 2412794.
- ^ Bentley, R. Alexander; Teherani, Jamshid J. (2013). “Die Phylogenie des Rotkäppchens”. PLUS EINS. 8 (11): e78871. Bibcode:2013PLoSO … 878871T. doi:10.1371 / journal.pone.0078871. ISSN 1932-6203. PMC 3827309. PMID 24236061.
- ^ Michalak, Pawel; Walker, Robert S.; Hill, Kim R.; Flinn, Mark V.; Ellsworth, Ryan M. (2011). “Evolutionsgeschichte der Ehepraktiken von Jägern und Sammlern”. PLUS EINS. 6 (4): e19066. Bibcode:2011PLoSO … 619066W. doi:10.1371 / journal.pone.0019066. ISSN 1932-6203. PMC 3083418. PMID 21556360.
- ^ Brooks, Daniel R (1999). “Phylogenien und die Vergleichsmethode im Tierverhalten, herausgegeben von Emı̀ia P. Martins, Oxford University Press, 1996. X + 415 pp.” Verhaltensprozesse. 47 (2): 135–136. doi:10.1016 / S0376-6357 (99) 00038-8. ISBN 978-0-19-509210-3. ISSN 0376-6357. PMID 24896936. S2CID 9872907.
- ^ ein b c Pupko, T.; Pe, I.; Shamir, R.; Graur, D. (2000). “Ein schneller Algorithmus zur gemeinsamen Rekonstruktion von Aminosäuresequenzen der Vorfahren”. Molekularbiologie und Evolution. 17 (6): 890–896. doi:10.1093 / oxfordjournals.molbev.a026369. ISSN 0737-4038. PMID 10833195.
- ^ ein b c Pagel, Mark; Meade, Andrew; Barker, Daniel (2004). “Bayesianische Schätzung von Ahnencharakterzuständen auf Phylogenien”. Systematische Biologie. 53 (5): 673–684. doi:10.1080 / 10635150490522232. ISSN 1063-5157. PMID 15545248.
- ^ Sanger, F.; Thompson, EOP; Kitai, Ruth (1955). “Die Amidgruppen von Insulin”. Biochemical Journal. 59 (3): 509–518. doi:10.1042 / bj0590509. ISSN 0264-6021. PMC 1216278. PMID 14363129.
- ^ Pauling, Linus; Zuckerkandl, Emile; Henriksen, Thormod; Lövstad, Rolf (1963). “Chemische Paläogenetik. Molekulare” Restaurationsstudien “ausgestorbener Lebensformen”. Acta Chemica Scandinavica. 17 supl.: 9–16. doi:10.3891 / acta.chem.scand.17s-0009. ISSN 0904-213X.
- ^ ein b Dobzhansky, Theodosius; Sturtevant, Alfred (1938). “Inversionen in den Chromosomen von Drosophila pseudoobscura”. Genetik. 23 (1): 28–64. PMC 1209001. PMID 17246876.
- ^ Harms, Michael J; Thornton, Joseph W. (2010). “Analyse der Proteinstruktur und -funktion mithilfe der Genrekonstruktion der Vorfahren”. Aktuelle Meinung in der Strukturbiologie. 20 (3): 360–366. doi:10.1016 / j.sbi.2010.03.005. ISSN 0959-440X. PMC 2916957. PMID 20413295.
- ^ ein b c d Williams, Paul D.; Pollock, David D.; Blackburne, Benjamin P.; Goldstein, Richard A. (2006). “Bewertung der Genauigkeit von Methoden zur Rekonstruktion von Ahnenproteinen”. PLOS Computational Biology. 2 (6): e69. Bibcode:2006PLSCB … 2 … 69W. doi:10.1371 / journal.pcbi.0020069. ISSN 1553-734X. PMC 1480538. PMID 16789817.
- ^ Ronquist, F (2004). “Bayesianische Folgerung der Charakterentwicklung”. Trends in Ökologie & Evolution. 19 (9): 475–481. doi:10.1016 / j.tree.2004.07.002. ISSN 0169-5347. PMID 16701310.
- ^ ein b c Ree, RH; Smith, SA (2008). “Maximum-Likelihood-Inferenz der Entwicklung des geografischen Bereichs durch Ausbreitung, lokales Aussterben und Cladogenese”. Systematische Biologie. 57 (1): 4–14. doi:10.1080 / 10635150701883881. ISSN 1063-5157. PMID 18253896.
- ^ ein b Fraser, Christophe; Lemey, Philippe; Rambaut, Andrew; Drummond, Alexei J.; Suchard, Marc A. (2009). “Bayesianische Phylogeographie findet ihre Wurzeln”. PLOS Computational Biology. 5 (9): e1000520. Bibcode:2009PLSCB … 5E0520L. doi:10.1371 / journal.pcbi.1000520. ISSN 1553-7358. PMC 2740835. PMID 19779555.
- ^ ein b Watterson, GA; Ewens, WJ; Hall, TE; Morgan, A. (1982). “Das Chromosomeninversionsproblem”. Zeitschrift für Theoretische Biologie. 99 (1): 1–7. doi:10.1016 / 0022-5193 (82) 90384-8. ISSN 0022-5193.
- ^ Tuffley, Chris; Steel, Mike (1997). “Verbindungen zwischen maximaler Wahrscheinlichkeit und maximaler Sparsamkeit unter einem einfachen Modell der Standortsubstitution”. Bulletin of Mathematical Biology. 59 (3): 581–607. doi:10.1007 / BF02459467. ISSN 0092-8240. PMID 9172826. S2CID 189885872.
- ^ Swofford, David L.; Maddison, Wayne P. (1987). “Rekonstruktion von Ahnencharakterzuständen unter Wagner-Sparsamkeit”. Mathematische Biowissenschaften. 87 (2): 199–229. doi:10.1016 / 0025-5564 (87) 90074-5. ISSN 0025-5564.
- ^ ein b Fitch, Walter M. (1971). “Auf dem Weg zur Definition des Evolutionsverlaufs: Minimale Änderung für eine bestimmte Baumtopologie”. Systematische Zoologie. 20 (4): 406–416. doi:10.2307 / 2412116. ISSN 0039-7989. JSTOR 2412116.
- ^ Stamatakis, A. (2006). “RAxML-VI-HPC: Maximum-Likelihood-basierte phylogenetische Analysen mit Tausenden von Taxa und gemischten Modellen” (PDF). Bioinformatik. 22 (21): 2688–2690. doi:10.1093 / bioinformatics / btl446. ISSN 1367-4803. PMID 16928733.
- ^ Sankoff, David (1975). “Minimale Mutationsbäume von Sequenzen”. SIAM Journal für Angewandte Mathematik. 28 (1): 35–42. CiteSeerX 10.1.1.665.9596. doi:10.1137 / 0128004. ISSN 0036-1399.
- ^ ein b c d e Schluter, Dolph; Preis, Trevor; Mooers, Arne O.; Ludwig, Donald (1997). “Wahrscheinlichkeit von Ahnenzuständen bei adaptiver Strahlung”. Evolution. 51 (6): 1699–1711. doi:10.2307 / 2410994. ISSN 0014-3820. JSTOR 2410994. PMID 28565128.
- ^ Felsenstein, Joseph (1973). “Maximum-Likelihood- und Minimum-Steps-Methoden zur Schätzung von Evolutionsbäumen anhand von Daten zu diskreten Zeichen”. Systematische Zoologie. 22 (3): 240–249. doi:10.2307 / 2412304. ISSN 0039-7989. JSTOR 2412304.
- ^ ein b c Cunningham, Clifford W.; Omland, Kevin E.; Oakley, Todd H. (1998). “Rekonstruktion von Ahnencharakterzuständen: eine kritische Neubewertung”. Trends in Ökologie & Evolution. 13 (9): 361–366. doi:10.1016 / S0169-5347 (98) 01382-2. ISSN 0169-5347. PMID 21238344.
- ^ Schluter, Arne O. Mooers, Dolph (1999). “Rekonstruktion von Ahnenstaaten mit maximaler Wahrscheinlichkeit: Unterstützung für Ein- und Zwei-Raten-Modelle”. Systematische Biologie. 48 (3): 623–633. CiteSeerX 10.1.1.594.175. doi:10.1080 / 106351599260193. ISSN 1063-5157.
- ^ Li, Guoliang; Stahl, Mike; Zhang, Louxin (2008). “Mehr Taxa sind für die Rekonstruktion von Ahnencharakterzuständen nicht unbedingt besser”. Systematische Biologie. 57 (4): 647–653. arXiv:0803.0195. doi:10.1080 / 10635150802203898. ISSN 1063-5157. PMID 18709600. S2CID 1373201.
- ^ ein b Felsenstein, Joseph (1985). “Phylogenien und die Vergleichsmethode”. Der amerikanische Naturforscher. 125 (1): 1–15. doi:10.1086 / 284325. ISSN 0003-0147. S2CID 9731499.
- ^ ein b c d Yang, Ziheng; Kumar, Sudhir; Nei, Masatoshi (1995). “Eine neue Methode zur Inferenz von Nukleotid- und Aminosäuresequenzen der Vorfahren”. Genetik. 141 (4): 1641–50. PMC 1206894. PMID 8601501.
- ^ Koshi, Jeffrey M.; Goldstein, Richard A. (1996). “Probabilistische Rekonstruktion von Proteinsequenzen der Vorfahren”. Journal of Molecular Evolution. 42 (2): 313–320. Bibcode:1996JMolE..42..313K. CiteSeerX 10.1.1.1031.2646. doi:10.1007 / BF02198858. ISSN 0022-2844. PMID 8919883. S2CID 15997589.
- ^ ein b Pagel, Mark (1999). “Der Maximum-Likelihood-Ansatz zur Rekonstruktion von Ahnencharakterzuständen diskreter Charaktere auf Phylogenien”. Systematische Biologie. 48 (3): 612–622. doi:10.1080 / 106351599260184. ISSN 1063-5157.
- ^ Guindon, Stéphane; Gascuel, Olivier (2003). “Ein einfacher, schneller und genauer Algorithmus zur Schätzung großer Phylogenien nach maximaler Wahrscheinlichkeit”. Systematische Biologie. 52 (5): 696–704. doi:10.1080 / 10635150390235520. ISSN 1063-5157. PMID 14530136.
- ^ Doornik, Jürgen A.; Ooms, Marius (2003). “Berechnungsaspekte der Maximum-Likelihood-Schätzung von autoregressiven fraktional integrierten gleitenden Durchschnittsmodellen”. Computerstatistik & Datenanalyse. 42 (3): 333–348. doi:10.1016 / S0167-9473 (02) 00212-8. ISSN 0167-9473.
- ^ ein b Felsenstein, Joseph (1981). “Evolutionsbäume aus DNA-Sequenzen: Ein Ansatz mit maximaler Wahrscheinlichkeit”. Journal of Molecular Evolution. 17 (6): 368–376. Bibcode:1981JMolE..17..368F. doi:10.1007 / BF01734359. ISSN 0022-2844. PMID 7288891. S2CID 8024924.
- ^ Eyre-Walker, Adam (1998). “Probleme mit Sparsamkeit in Sequenzen voreingenommener Basenzusammensetzung”. Journal of Molecular Evolution. 47 (6): 686–690. Bibcode:1998JMolE..47..686E. doi:10.1007 / PL00006427. ISSN 0022-2844. PMID 9847410. S2CID 26128712.
- ^ Pupko, T.; Pe’er, I.; Hasegawa, M.; Graur, D.; Friedman, N. (2002). “Ein Branch-and-Bound-Algorithmus zur Inferenz von Aminosäuresequenzen der Vorfahren, wenn die Ersatzrate zwischen den Standorten variiert: Anwendung auf die Evolution von fünf Genfamilien”. Bioinformatik. 18 (8): 1116–1123. doi:10.1093 / bioinformatics / 18.8.1116. ISSN 1367-4803. PMID 12176835.
- ^ Gruenheit, N.; Lockhart, PJ; Steel, M.; Martin, W. (2008). “Schwierigkeiten beim Testen auf Covarion-ähnliche Eigenschaften von Sequenzen unter dem verwirrenden Einfluss sich ändernder Anteile variabler Stellen” (PDF). Molekularbiologie und Evolution. 25 (7): 1512–1520. doi:10.1093 / molbev / msn098. ISSN 0737-4038. PMID 18424773.
- ^ Huelsenbeck, JP; Ronquist, F. (2001). “MRBAYES: Bayesianische Folgerung phylogenetischer Bäume”. Bioinformatik. 17 (8): 754–755. doi:10.1093 / bioinformatics / 17.8.754. ISSN 1367-4803. PMID 11524383.
- ^ Yang, Ziheng (1997). “PAML: ein Programmpaket für die phylogenetische Analyse mit maximaler Wahrscheinlichkeit”. Bioinformatik. 13 (5): 555–556. doi:10.1093 / bioinformatics / 13.5.555. ISSN 1367-4803. PMID 9367129.
- ^ ein b Huelsenbeck, John P.; Bollback, Jonathan P. (2001). “Empirische und hierarchische Bayes’sche Schätzung von Ahnenzuständen”. Systematische Biologie. 50 (3): 351–366. CiteSeerX 10.1.1.319.4271. doi:10.1080 / 106351501300317978. ISSN 1076-836X. PMID 12116580.
- ^ Lutzoni, François; Pagel, Mark; Reeb, Valérie (2001). “Wichtige Pilzlinien stammen von flechtensymbiotischen Vorfahren”. Natur. 411 (6840): 937–940. Bibcode:2001Natur.411..937L. doi:10.1038 / 35082053. ISSN 0028-0836. PMID 11418855. S2CID 4414913.
- ^ Hanson-Smith, V.; Kolaczkowski, B.; Thornton, JW (2010). “Robustheit der Rekonstruktion der Ahnensequenz zur phylogenetischen Unsicherheit”. Molekularbiologie und Evolution. 27 (9): 1988–1999. doi:10.1093 / molbev / msq081. ISSN 0737-4038. PMC 2922618. PMID 20368266.
- ^ Hillis, D.; Bull, J.; White, M.; Badgett, M.; Molineux, I. (1992). “Experimentelle Phylogenetik: Erzeugung einer bekannten Phylogenie”. Wissenschaft. 255 (5044): 589–592. Bibcode:1992Sci … 255..589H. doi:10.1126 / science.1736360. ISSN 0036-8075. PMID 1736360.
- ^ Oakley, Todd H.; Cunningham, Clifford W. (2000). “Unabhängige Kontraste sind erfolgreich, wenn die Rekonstruktion der Vorfahren bei einer bekannten Bakteriophagen-Phylogenie fehlschlägt.” Evolution. 54 (2): 397–405. doi:10.1554 / 0014-3820 (2000) 054[0397:ICSWAR]2.0.CO; 2. ISSN 0014-3820. PMID 10937216.
- ^ Finarelli, John A.; Flynn, John J. (2006). “Rekonstruktion der Körpergröße in der Caniformia (Carnivora, Mammalia) durch den Ahnenstaat: Die Auswirkungen der Einbeziehung von Daten aus dem Fossilienbestand”. Systematische Biologie. 55 (2): 301–313. doi:10.1080 / 10635150500541698. ISSN 1063-5157. PMID 16611601.
- ^ Albert, James S.; Johnson, Derek M.; Knouft, Jason H. (2009). “Fossilien liefern bessere Schätzungen der Körpergröße der Vorfahren als vorhandene Taxa bei Fischen”. Acta Zoologica. 90: 357–384. doi:10.1111 / j.1463-6395.2008.00364.x. ISSN 0001-7272.
- ^ Slater, Graham J.; Harmon, Luke J.; Alfaro, Michael E. (2012). “Die Integration von Fossilien in molekulare Phylogenien verbessert den Rückschluss auf die Entwicklung von Merkmalen”. Evolution. 66 (12): 3931–3944. doi:10.1111 / j.1558-5646.2012.01723.x. ISSN 0014-3820. PMID 23206147. S2CID 24390146.
- ^ Webster, AJ; Purvis, A. (2002). “Testen der Genauigkeit von Methoden zur Rekonstruktion von Ahnenzuständen fortlaufender Zeichen”. Verfahren der Royal Society B: Biological Sciences. 269 (1487): 143–149. doi:10.1098 / rspb.2001.1873. ISSN 0962-8452. PMC 1690869. PMID 11798429.
- ^ Maddison, Wayne; Midford, Peter; Otto, Sarah (2007). “Abschätzung der Auswirkung eines binären Charakters auf Speziation und Aussterben”. Systematische Biologie. 56 (5): 701–710. doi:10.1080 / 10635150701607033. ISSN 1063-5157. PMID 17849325.
- ^ ein b Martins, Emilia P (1994). “”‘Schätzung der Geschwindigkeit der phänotypischen Entwicklung anhand von Vergleichsdaten “. Amerikanischer Naturforscher. 144 (2): 193–209. doi:10.1086 / 285670. S2CID 85300707.
- ^ Felsenstein, J. (1988). “Phylogenien und quantitative Merkmale”. Jahresrückblick auf Ökologie und Systematik. 19: 445–471. doi:10.1146 / annurev.ecolsys.19.1.445.
- ^ Garland, T. Jr.; Dickerman, AW; Janis, CM; Jones, JA (1993). “Phylogenetische Analyse der Kovarianz durch Computersimulation”. Systematische Biologie. 42 (3): 265–292. doi:10.1093 / sysbio / 42.3.265.
- ^ Cooper, N., GH Thomas, C. Venditti, A. Meade und RP Freckleton. 2015. Ein Warnhinweis zur Verwendung von Ornstein-Uhlenbeck-Modellen in makroevolutionären Studien. Biologisches Journal der Linnean Society.
- ^ ein b c d Elliot, Michael G; Mooers, Arne Ø (2014). “Ableiten von Ahnenzuständen ohne Annahme von Neutralität oder Gradualismus unter Verwendung eines stabilen Modells der kontinuierlichen Charakterentwicklung”. BMC Evolutionsbiologie. 14 (1): 226. doi:10.1186 / s12862-014-0226-8. ISSN 1471-2148. PMC 4266906. PMID 25427971.
- ^ Griffith, Oliver W.; Blackburn, Daniel G.; Brandley, Matthew C.; Van Dyke, James U.; Whittington, Camilla M.; Thompson, Michael B. (2015). “Rekonstruktionen des Ahnenzustands erfordern biologische Beweise, um Evolutionshypothesen zu testen: Eine Fallstudie, die die Evolution des Fortpflanzungsmodus bei Squamate-Reptilien untersucht.” Journal of Experimental Zoology Teil B: Molekulare und Entwicklungsentwicklung. 324 (6): 493–503. doi:10.1002 / jez.b.22614. ISSN 1552-5007. PMID 25732809.
- ^ Erkenbrack, EM; Ako-Asare, K.; Miller, E.; Tekelenburg, S.; Thompson, JR; Romano, L. (2016). “Rekonstruktion des Ahnenzustands durch vergleichende Analyse eines in Stachelhäutern arbeitenden GRN-Kerns”. Entwicklungsgene und Evolution. 226 (1): 37–45. doi:10.1007 / s00427-015-0527-y. ISSN 0949-944X. PMID 26781941. S2CID 6067524.
- ^ Erkenbrack, EM; Thompson, JR (2019). “Die Phylogenetik des Zelltyps informiert über den evolutionären Ursprung der skelettogenen Zellidentität von Stachelhäuterlarven.”. Kommunikationsbiologie. 2: 160. doi:10.1038 / s42003-019-0417-3. ISSN 2399-3642. PMC 6499829. PMID 31069269.
- ^ ein b Chang, Belinda SW; Ugalde, Juan A.; Matz, Mikhail V. (2005). “Anwendungen der Rekonstruktion von Ahnenproteinen zum Verständnis der Proteinfunktion: GFP-ähnliche Proteine”. Methoden der Enzymologie. 395:: 652–670. doi:10.1016 / S0076-6879 (05) 95034-9. ISBN 9780121828004. ISSN 0076-6879. PMID 15865989.
- ^ Hodges, WL (2004). “Evolution der Viviparität bei gehörnten Eidechsen (Phrynosoma): Testen der Kaltklimahypothese “. Zeitschrift für Evolutionsbiologie. 17 (6): 1230–1237. doi:10.1111 / j.1420-9101.2004.00770.x. PMID 15525408. S2CID 25069395.
- ^ Maddison, WP (1991). “Parsimony-Rekonstruktionen von Ahnenzuständen mit quadratischer Veränderung für kontinuierlich bewertete Charaktere auf einem phylogenetischen Baum”. Systematische Biologie. 40 (3): 304–314. doi:10.1093 / sysbio / 40.3.304.
- ^ Bonine, KE (2005). “Variation des Muskelfasertyps bei Eidechsen (Squamata) und phylogenetische Rekonstruktion hypothetischer Ahnenzustände”. Journal of Experimental Biology. 208 (23): 4529–4547. doi:10.1242 / jeb.01903. PMID 16339872.
- ^ Ridley, Mark (1983). Die Erklärung der organischen Vielfalt: die Vergleichsmethode und Anpassungen für die Paarung. Oxford: Clarendon Press.
- ^ Maddison, Wayne P. (1990). “Eine Methode zum Testen der korrelierten Entwicklung zweier binärer Zeichen: Konzentrieren sich Gewinne oder Verluste auf bestimmte Zweige eines phylogenetischen Baums?” Evolution. 44 (3): 539–557. doi:10.2307 / 2409434. ISSN 0014-3820. JSTOR 2409434. PMID 28567979.
- ^ Göbel, Ulrike; Sander, Chris; Schneider, Reinhard; Valencia, Alfonso (1994). “Korrelierte Mutationen und Restkontakte in Proteinen”. Proteine: Struktur, Funktion und Genetik. 18 (4): 309–317. doi:10.1002 / prot.340180402. ISSN 0887-3585. PMID 8208723. S2CID 14978727.
- ^ Shindyalov, IN; Kolchanov, NA; Sander, C. (1994). “Können dreidimensionale Kontakte in Proteinstrukturen durch Analyse korrelierter Mutationen vorhergesagt werden?” Protein Engineering, Design und Auswahl. 7 (3): 349–358. doi:10.1093 / Protein / 7.3.349. ISSN 1741-0126. PMID 8177884.
- ^ Korber, BT; Farber, RM; Wolpert, DH; Lapedes, AS (1993). “Kovariation von Mutationen in der V3-Schleife des Hüllproteins des humanen Immundefizienzvirus Typ 1: eine informationstheoretische Analyse”. Verfahren der Nationalen Akademie der Wissenschaften. 90 (15): 7176–7180. Bibcode:1993PNAS … 90.7176K. doi:10.1073 / pnas.90.15.7176. ISSN 0027-8424. PMC 47099. PMID 8346232.
- ^ Shapiro, B. (2006). “Eine phylogenetische Methode zum Nachweis einer positiven Epistase in Gensequenzen und ihre Anwendung auf die RNA-Virus-Evolution”. Molekularbiologie und Evolution. 23 (9): 1724–1730. doi:10.1093 / molbev / msl037. ISSN 0737-4038. PMID 16774976.
- ^ Poon, Art FY; Lewis, Fraser I.; Teich, Sergei L. Kosakovsky; Frost, Simon DW (2007). “Ein evolutionäres Netzwerkmodell zeigt geschichtete Wechselwirkungen in der V3-Schleife der HIV-1-Hülle”. PLOS Computational Biology. 3 (11): e231. Bibcode:2007PLSCB … 3..231P. doi:10.1371 / journal.pcbi.0030231. ISSN 1553-734X. PMC 2082504. PMID 18039027.
- ^ Jermann, Thomas M.; Opitz, Jochen G.; Stackhouse, Joseph; Benner, Steven A. (1995). “Rekonstruktion der Evolutionsgeschichte der Artiodactyl-Ribonuklease-Superfamilie”. Natur. 374 (6517): 57–59. Bibcode:1995Natur.374 … 57J. doi:10.1038 / 374057a0. ISSN 0028-0836. PMID 7532788. S2CID 4315312.
- ^ Sadqi, M.; de Alba, E.; Perez-Jimenez, R.; Sanchez-Ruiz, JM; Munoz, V. (2009). “Ein entworfenes Protein als experimentelles Modell der Urfaltung”. Verfahren der Nationalen Akademie der Wissenschaften. 106 (11): 4127–4132. Bibcode:2009PNAS..106.4127S. doi:10.1073 / pnas.0812108106. ISSN 0027-8424. PMC 2647338. PMID 19240216.
- ^ Chang, BSW; Jonsson, K.; Kazmi, MA; Donoghue, MJ; Sakmar, TP (2002). “Wiederherstellung eines funktionellen visuellen Pigmentes eines Ahnen-Archosauriers”. Molekularbiologie und Evolution. 19 (9): 1483–1489. doi:10.1093 / oxfordjournals.molbev.a004211. ISSN 0737-4038. PMID 12200476.
- ^ Zhang, C.; Zhang, M.; Ju, J.; Nietfeldt, J.; Wise, J.; Terry, PM; Olson, M.; Kachman, SD; Wiedmann, M.; Samadpour, M.; Benson, AK (2003). “Genomdiversifikation in phylogenetischen Linien I und II von Listeria monocytogenes: Identifizierung von Segmenten, die nur in Populationen der Linie II vorkommen”. Journal of Bacteriology. 185 (18): 5573–5584. doi:10.1128 / JB.185.18.5573-5584.2003. ISSN 0021-9193. PMC 193770. PMID 12949110.
- ^ Krishnan, NM (2004). “Rekonstruktion der Ahnensequenz in mitochondrialer DNA von Primaten: Verzerrung der Zusammensetzung und Auswirkung auf die funktionelle Inferenz”. Molekularbiologie und Evolution. 21 (10): 1871–1883. doi:10.1093 / molbev / msh198. ISSN 0737-4038. PMID 15229290.
- ^ Gaschen, B. (2002). “Überlegungen zur Vielfalt bei der Auswahl von HIV-1-Impfstoffen”. Wissenschaft. 296 (5577): 2354–2360. Bibcode:2002Sci … 296.2354G. doi:10.1126 / science.1070441. ISSN 0036-8075. PMID 12089434. S2CID 39452987.
- ^ Rolland, M.; Jensen, MA; Nickle, DC; Yan, J.; Lerne, GH; Heath, L.; Weiner, D.; Mullins, JI (2007). “Rekonstruktion und Funktion von Proteinen des humanen Immundefizienzvirus Typ 1 des Stammzentrums des Baumes”. Zeitschrift für Virologie. 81 (16): 8507–8514. doi:10.1128 / JVI.02683-06. ISSN 0022-538X. PMC 1951385. PMID 17537854.
- ^ Kothe, Denise L.; Li, Yingying; Decker, Julie M.; Bibollet-Ruche, Frederic; Zammit, Kenneth P.; Salazar, Maria G.; Chen, Yalu; Weng, Zhiping; Weaver, Eric A.; Gao, Feng; Haynes, Barton F.; Shaw, George M.; Korber, Bette TM; Hahn, Beatrice H. (2006). “Ahnen- und Konsensus-Hüllimmunogene für HIV-1-Subtyp C”. Virologie. 352 (2): 438–449. doi:10.1016 / j.virol.2006.05.011. ISSN 0042-6822. PMID 16780913.
- ^ Mullins, JI; Haigwood, NL; Barnett, SW; Montefiori, D.; Edmonson, PF; McLaughlin, S.; Hensel, MT; Mahalanabis, M.; Li, F. (01.09.2005). “Humanes Immundefizienzvirus Typ 1 Subtyp B Ancestral Envelope Protein ist funktionell und löst bei Kaninchen neutralisierende Antikörper aus, ähnlich denen, die durch eine zirkulierende Subtyp B-Hülle hervorgerufen werden.”. Zeitschrift für Virologie. 79 (17): 11214–11224. doi:10.1128 / JVI.79.17.11214-11224.2005. ISSN 0022-538X. PMC 1193599. PMID 16103173.
- ^ McCloskey, RM; Liang, RH; Harrigan, PR; Brumme, ZL; Poon, AFY (2014). “Eine Bewertung phylogenetischer Methoden zur Rekonstruktion übertragener HIV-Varianten unter Verwendung von longitudinalen klonalen HIV-Sequenzdaten”. Zeitschrift für Virologie. 88 (11): 6181–6194. doi:10.1128 / JVI.00483-14. ISSN 0022-538X. PMC 4093844. PMID 24648453.
- ^ Borque, Guillaume; Pevzner, Pavel A. (2012). “Evolution im Genommaßstab: Rekonstruktion von Genordnungen in den Ahnenarten”. Genomforschung. 12 (1): 26–36. PMC 155248. PMID 11779828.
- ^ Sogar S; Goldreich, O. (1981). “Das Problem der Generatorsequenz mit minimaler Länge ist NP-hart”. Journal of Algorithms. 2 (3): 311–313. doi:10.1016 / 0196-6774 (81) 90029-8. ISSN 0196-6774.
- ^ Fertin, Guillaume; Labarre, Anthony; Rusu, Irena; Tannier, Eric; Vialette, Stéphane (2009). Kombinatorik von Genomumlagerungen. MIT Press. doi:10.7551 / mitpress / 9780262062824.001.0001. ISBN 9780262258753.
- ^ Wienberg, Johannes (2004). “Die Evolution der eutherischen Chromosomen”. Aktuelle Meinung in Genetik & Entwicklung. 14 (6): 657–666. doi:10.1016 / j.gde.2004.10.001. ISSN 0959-437X. PMID 15531161.
- ^ Froenicke, Lutz; Garcia Caldés, Montserrat; Graphodatsky, Alexander; Müller, Stefan; Lyons, Leslie; Robinson, Terence; Volleth, Marianne; Yang, Fengtang; Wienberg, Johannes (2006). “Schlagen molekulare Zytogenetik und Bioinformatik unterschiedliche Modelle des Genoms von Säugetieren der Vorfahren vor?”. Genomforschung. 16 (3): 306–310. doi:10.1101 / gr.3955206. ISSN 1088-9051. PMC 1415215. PMID 16510895.
- ^ Murphy, WJ (2005). “Dynamik der Säugetierchromosomenentwicklung aus Multispezies-Vergleichskarten abgeleitet”. Wissenschaft. 309 (5734): 613–617. Bibcode:2005Sci … 309..613M. doi:10.1126 / science.1111387. ISSN 0036-8075. PMID 16040707. S2CID 32314883.
- ^ Ma, J.; Zhang, L.; Suh, BB; Raney, BJ; Burhans, RC; Kent, WJ; Blanchette, M.; Haussler, D.; Miller, W. (2006). “Rekonstruktion zusammenhängender Regionen eines Ahnengenoms”. Genomforschung. 16 (12): 1557–1565. doi:10.1101 / gr.5383506. ISSN 1088-9051. PMC 1665639. PMID 16983148.
- ^ Oyserman, Ben O.; Moya, Francisco; Lawson, Christopher E.; Garcia, Antonio L.; Vogt, Mark; Heffernen, Mitchell; Noguera, Daniel R.; McMahon, Katherine D. (29.04.2016). “Die Rekonstruktion des Ahnengenoms identifiziert die evolutionäre Grundlage für die Erfassung von Merkmalen in Polyphosphat-akkumulierenden Bakterien.”. Das ISME Journal. 10 (12): 2931–2945. doi:10.1038 / ismej.2016.67. ISSN 1751-7370. PMC 5148189. PMID 27128993.
- ^ ein b c Clark, John; Ree, Richard; Alfaro, Michael; König, Matthäus; Wagner, Warren; Roalson, Eric (2008). “Eine vergleichende Studie zu Methoden zur Rekonstruktion des Ahnenbereichs: Rückverfolgung der unsicheren Geschichte von Insellinien”. Systematische Biologie. 57 (5): 693–707. doi:10.1080 / 10635150802426473. ISSN 1063-5157. PMID 18853357.
- ^ Huelsenbeck, John P.; Nielsen, Rasmus; Bollback, Jonathan P. (2003). “Stochastische Kartierung morphologischer Zeichen”. Systematische Biologie. 52 (2): 131–158. doi:10.1080 / 10635150390192780. ISSN 1063-5157. PMID 12746144.
- ^ Ronquist, Fredrik (1996). “DIVA Version 1.1”.
Computerprogramm und Handbuch per anonymem FTP von der Universität Uppsala erhältlich
[permanent dead link] - ^ Ree, Richard H.; Moore, Brian R.; Webb, Campbell O.; Donoghue, Michael J. (2005). “Ein Wahrscheinlichkeitsrahmen für den Rückschluss auf die Entwicklung der geografischen Reichweite von phylogenetischen Bäumen”. Evolution. 59 (11): 2299–2311. doi:10.1111 / j.0014-3820.2005.tb00940.x. ISSN 0014-3820. PMID 16396171. S2CID 23245573.
- ^ ein b c Lemmon, Alan; Lemmon, Emily Moriarty (2008). “Ein Wahrscheinlichkeitsrahmen für die Schätzung der phylogeografischen Geschichte in einer kontinuierlichen Landschaft”. Systematische Biologie. 57 (4): 544–561. doi:10.1080 / 10635150802304761. ISSN 1063-5157. PMID 18686193.
- ^ ein b Sturtevant, AH; Dobzhansky, T. (1936). “Inversionen im dritten Chromosom wilder Rassen von Drosophila Pseudoobscura und ihre Verwendung bei der Untersuchung der Geschichte der Arten” (PDF). Verfahren der Nationalen Akademie der Wissenschaften. 22 (7): 448–450. Bibcode:1936PNAS … 22..448S. doi:10.1073 / pnas.22.7.448. ISSN 0027-8424. PMC 1076803. PMID 16577723.
- ^ ein b Campbell, Lyle (1998). Historische Linguistik: eine Einführung. Edinburgh: Edinburgh University Press.
- ^ Yang, Z. (2007). “PAML 4: Phylogenetische Analyse nach maximaler Wahrscheinlichkeit”. Molekularbiologie und Evolution. 24 (8): 1586–1591. CiteSeerX 10.1.1.322.1650. doi:10.1093 / molbev / msm088. ISSN 0737-4038. PMID 17483113.
- ^ “Lazarus: ein Software-Tool zur Rekonstruktion von Proteinsequenzen der Vorfahren”. markov.uoregon.edu. Archiviert von das Original am 07.03.2015. Abgerufen 2019-03-07.
- ^ Teich, SLK; Frost, SDW; Muse, SV (2004). “HyPhy: Hypothesentest mit Phylogenien”. Bioinformatik. 21 (5): 676–679. doi:10.1093 / bioinformatics / bti079. ISSN 1367-4803. PMID 15509596.
- ^ Maddison, WP; Maddison, DR (2015). “Mesquite: ein modulares System für die Evolutionsanalyse. Version 2.75”.
- ^ ein b Tamura, K.; Stecher, G.; Peterson, D.; Filipski, A.; Kumar, S. (2013). MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0. Molekularbiologie und Evolution. 30 (12): 2725–2729. doi:10.1093 / molbev / mst197. ISSN 0737-4038. PMC 3840312. PMID 24132122.
- ^ Ronquist, F.; Huelsenbeck, JP (2003). “MrBayes 3: Bayesianische phylogenetische Inferenz unter gemischten Modellen”. Bioinformatik. 19 (12): 1572–1574. doi:10.1093 / bioinformatics / btg180. ISSN 1367-4803. PMID 12912839.
- ^ Hubisz, MJ; Pollard, KS; Siepel, A. (2010). “PHAST und RPHAST: phylogenetische Analyse mit Raum / Zeit-Modellen”. Briefings in Bioinformatik. 12 (1): 41–51. doi:10.1093 / bib / bbq072. ISSN 1467-5463. PMC 3030812. PMID 21278375.
- ^ Bollback, Jonathan P (2006). “SIMMAP: Stochastische Charakterabbildung diskreter Merkmale auf Phylogenien”. BMC Bioinformatik. 7 (1): 88. doi:10.1186 / 1471-2105-7-88. ISSN 1471-2105. PMC 1403802. PMID 16504105.
- ^ Paradis, Emmanuel (2012). Analyse der Phylogenetik und Evolution mit R.. New York: Springer-Verlag.
- ^ Rossnes, Roald; Eidhammer, Ingvar; Liberles, David A (2005). “Phylogenetische Rekonstruktion von Ahnencharakterzuständen für Genexpressions- und mRNA-Spleißdaten”. BMC Bioinformatik. 6 (1): 127. doi:10.1186 / 1471-2105-6-127. ISSN 1471-2105. PMC 1166541. PMID 15921519.
- ^ Drummond, AJ; Suchard, MA; Xie, D.; Rambaut, A. (2012). “Bayesianische Phylogenetik mit BEAUti und dem BEAST 1.7”. Molekularbiologie und Evolution. 29 (8): 1969–1973. doi:10.1093 / molbev / mss075. ISSN 0737-4038. PMC 3408070. PMID 22367748.
- ^ FitzJohn, Richard G. (2012). “Diversitree: Vergleichende phylogenetische Analysen der Diversifikation in R”. Methoden in Ökologie und Evolution. 3 (6): 1084–1092. doi:10.1111 / j.2041-210X.2012.00234.x. ISSN 2041-210X.
- ^ Pagel, M. (1994). “Detektion korrelierter Evolution auf Phylogenien: Eine allgemeine Methode zur vergleichenden Analyse diskreter Zeichen”. Verfahren der Royal Society B: Biological Sciences. 255 (1342): 37–45. Bibcode:1994RSPSB.255 … 37P. doi:10.1098 / rspb.1994.0006. ISSN 0962-8452. S2CID 85903564.
- ^ Yu, Yan; Harris, AJ; Er, Xingjin (2010). “S-DIVA (Statistical Dispersal-Vicariance Analysis): Ein Werkzeug zur Schlussfolgerung biogeografischer Geschichten”. Molekulare Phylogenetik und Evolution. 56 (2): 848–850. doi:10.1016 / j.ympev.2010.04.011. ISSN 1055-7903. PMID 20399277.
- ^ Arias, J. Salvador; Szumik, Claudia A.; Goloboff, Pablo A. (2011). “Räumliche Analyse der Vikarianz: eine Methode zur Verwendung direkter geografischer Informationen in der historischen Biogeographie”. Kladistik. 27 (6): 617–628. doi:10.1111 / j.1096-0031.2011.00353.x. ISSN 0748-3007. S2CID 85747431.
- ^ Jones, BR; Rajaraman, A.; Tannier, E.; Chauve, C. (2012). “ANGES: Rekonstruktion von ANcestral GEnomeS-Karten”. Bioinformatik. 28 (18): 2388–2390. doi:10.1093 / bioinformatics / bts457. ISSN 1367-4803. PMID 22820205.
- ^ Larget, Bret; Kadane, Joseph B.; Simon, Donald L. (2005). “Ein Bayes’scher Ansatz zur Abschätzung der Genomanordnungen der Vorfahren”. Molekulare Phylogenetik und Evolution. 36 (2): 214–223. doi:10.1016 / j.ympev.2005.03.026. ISSN 1055-7903. PMID 15893477.
- ^ Csuos, M. (2010). “Count: Evolutionsanalyse phylogenetischer Profile mit Sparsamkeit und Wahrscheinlichkeit”. Bioinformatik. 26 (15): 1910–1912. doi:10.1093 / bioinformatics / btq315. ISSN 1367-4803. PMID 20551134.
- ^ Carmel, Liran; Wolf, Yuri I.; Rogozin, Igor B.; Koonin, Eugene V. (2010). “EREM: Parameterschätzung und Ahnenrekonstruktion durch Erwartungsmaximierungsalgorithmus für ein probabilistisches Modell der Evolution genomischer Binärcharaktere”. Fortschritte in der Bioinformatik. 2010: 1–4. doi:10.1155 / 2010/167408. ISSN 1687-8027. PMC 2866244. PMID 20467467.
- ^ Patro, Rob; Sefer, Emre; Malin, Justin; Marçais, Guillaume; Navlakha, Saket; Kingsford, Carl (2012). “Sparsame Rekonstruktion der Netzwerkentwicklung”. Algorithmen für die Molekularbiologie. 7 (1): 25. doi:10.1186 / 1748-7188-7-25. ISSN 1748-7188. PMC 3492119. PMID 22992218.
- ^ Diallo, AB; Makarenkov, V.; Blanchette, M. (2009). “Ancestors 1.0: Ein Webserver für die Rekonstruktion von Ahnensequenzen”. Bioinformatik. 26 (1): 130–131. doi:10.1093 / bioinformatics / btp600. ISSN 1367-4803. PMID 19850756.
- ^ Ashkenazy, H.; Penn, O.; Doron-Faigenboim, A.; Cohen, O.; Cannarozzi, G.; Zomer, O.; Pupko, T. (2012). “FastML: ein Webserver zur probabilistischen Rekonstruktion von Ahnensequenzen”. Nukleinsäureforschung. 40 (W1): W580 – W584. doi:10.1093 / nar / gks498. ISSN 0305-1048. PMC 3394241. PMID 22661579.
- ^ Hu, Fei; Lin, Yu; Tang, Jijun (2014). “MLGO: Rekonstruktion der Phylogenie und Rückschluss der Vorfahren aus Daten der Genordnung”. BMC Bioinformatik. 15 (1): 354. doi:10.1186 / s12859-014-0354-6. ISSN 1471-2105. PMC 4236499. PMID 25376663.
- ^ Bouchard-Cote, A.; Jordan, MI (2012). “Evolutionäre Folgerung über den Poisson-Indel-Prozess”. Verfahren der Nationalen Akademie der Wissenschaften. 110 (4): 1160–1166. arXiv:1207,6327. Bibcode:2013PNAS..110.1160B. doi:10.1073 / pnas.1220450110. ISSN 0027-8424. PMC 3557041. PMID 23275296.
- ^ Thorne, Jeffrey L.; Kishino, Hirohisa; Felsenstein, Joseph (1991). “Ein Evolutionsmodell für das Maximum-Likelihood-Alignment von DNA-Sequenzen”. Journal of Molecular Evolution. 33 (2): 114–124. Bibcode:1991JMolE..33..114T. doi:10.1007 / BF02193625. ISSN 0022-2844. PMID 1920447. S2CID 13333056.
- ^ Fraser, Christophe; Poon, Art FY; Swenson, Luke C.; Bunnik, Evelien M.; Edo-Matas, Diana; Schuitemaker, Hanneke; van ‘t Wout, Angélique B.; Harrigan, P. Richard (2012). “Rekonstruktion der Dynamik der HIV-Evolution in Wirten aus seriellen Deep-Sequence-Daten”. PLOS Computational Biology. 8 (11): e1002753. Bibcode:2012PLSCB … 8E2753P. doi:10.1371 / journal.pcbi.1002753. ISSN 1553-7358. PMC 3486858. PMID 23133358.
- ^ Beerenwinkel, Niko; Schwarz, Roland F.; Trinh, Anne; Sipos, Botond; Brenton, James D.; Goldman, Nick; Markowetz, Florian (2014). “Phylogenetische Quantifizierung der Intra-Tumor-Heterogenität”. PLOS Computational Biology. 10 (4): e1003535. arXiv:1306.1685. Bibcode:2014PLSCB..10E3535S. doi:10.1371 / journal.pcbi.1003535. ISSN 1553-7358. PMC 3990475. PMID 24743184.

 bezeichnet den Zeichenzustand des ich-ter Knoten,
bezeichnet den Zeichenzustand des ich-ter Knoten,  ist die Verzweigungslänge (Evolutionszeit) zwischen Knoten ich und j, und
ist die Verzweigungslänge (Evolutionszeit) zwischen Knoten ich und j, und  ist die Menge aller möglichen Zeichenzustände (zum Beispiel die Nukleotide A, C, G und T).[34] Ziel der Ahnenrekonstruktion ist es daher, die Zuordnung zu zu finden
ist die Menge aller möglichen Zeichenzustände (zum Beispiel die Nukleotide A, C, G und T).[34] Ziel der Ahnenrekonstruktion ist es daher, die Zuordnung zu zu finden  für alle x interne Knoten, die die Wahrscheinlichkeit der beobachteten Daten für einen bestimmten Baum maximieren.
für alle x interne Knoten, die die Wahrscheinlichkeit der beobachteten Daten für einen bestimmten Baum maximieren.

 repräsentiert sowohl das Evolutionsmodell als auch den phylogenetischen Baum.
repräsentiert sowohl das Evolutionsmodell als auch den phylogenetischen Baum.  ist die Wahrscheinlichkeit der beobachteten Daten, die mit dem oben angegebenen Beschneidungsalgorithmus von Felsenstein berechnet werden können.
ist die Wahrscheinlichkeit der beobachteten Daten, die mit dem oben angegebenen Beschneidungsalgorithmus von Felsenstein berechnet werden können.  ist die vorherige Wahrscheinlichkeit der Ahnenzustände für ein bestimmtes Modell und einen bestimmten Baum. Schließlich,
ist die vorherige Wahrscheinlichkeit der Ahnenzustände für ein bestimmtes Modell und einen bestimmten Baum. Schließlich,  ist die Wahrscheinlichkeit der Daten für ein bestimmtes Modell und einen bestimmten Baum, die über alle möglichen Ahnenzustände integriert sind.
ist die Wahrscheinlichkeit der Daten für ein bestimmtes Modell und einen bestimmten Baum, die über alle möglichen Ahnenzustände integriert sind.
 über alle möglichen Werte von S. gegeben
über alle möglichen Werte von S. gegeben  Zustände, beschriftet
Zustände, beschriftet  . Das typische Mittel zur Modellierung der Evolution dieses Merkmals ist eine zeitkontinuierliche Markov-Kette, die kurz wie folgt beschrieben werden kann. Jedem Staat sind Übergangsraten zu allen anderen Staaten zugeordnet. Das Merkmal wird als Schritt zwischen dem modelliert
. Das typische Mittel zur Modellierung der Evolution dieses Merkmals ist eine zeitkontinuierliche Markov-Kette, die kurz wie folgt beschrieben werden kann. Jedem Staat sind Übergangsraten zu allen anderen Staaten zugeordnet. Das Merkmal wird als Schritt zwischen dem modelliert  Dies kann beispielsweise unter Verwendung von Maximum-Likelihood-Methoden geschätzt werden, bei denen über die Menge aller möglichen Zustandskonfigurationen der Ahnenknoten maximiert wird.
Dies kann beispielsweise unter Verwendung von Maximum-Likelihood-Methoden geschätzt werden, bei denen über die Menge aller möglichen Zustandskonfigurationen der Ahnenknoten maximiert wird.  ) Nach maximaler Wahrscheinlichkeit lautet das Verfahren: Finden Sie die maximale Wahrscheinlichkeitsschätzung
) Nach maximaler Wahrscheinlichkeit lautet das Verfahren: Finden Sie die maximale Wahrscheinlichkeitsschätzung  von
von  ;; Berechnen Sie dann die Wahrscheinlichkeit jedes möglichen Zustands für
;; Berechnen Sie dann die Wahrscheinlichkeit jedes möglichen Zustands für  ;; Wählen Sie schließlich den Ahnenzustand, der dies maximiert.[23] Man kann dieses Substitutionsmodell auch als Grundlage für ein Bayes’sches Inferenzverfahren verwenden, bei dem der hintere Glaube an den Zustand eines Ahnenknotens bei einem vom Benutzer ausgewählten Prior berücksichtigt wird.
;; Wählen Sie schließlich den Ahnenzustand, der dies maximiert.[23] Man kann dieses Substitutionsmodell auch als Grundlage für ein Bayes’sches Inferenzverfahren verwenden, bei dem der hintere Glaube an den Zustand eines Ahnenknotens bei einem vom Benutzer ausgewählten Prior berücksichtigt wird.
 Parameter, Überanpassung kann ein Problem sein. Einige gebräuchliche Optionen, die den Parameterraum reduzieren, sind:
Parameter, Überanpassung kann ein Problem sein. Einige gebräuchliche Optionen, die den Parameterraum reduzieren, sind:











Recent Comments