Chemische Synthese – Wikipedia
Geplante Reihe chemischer Reaktionen zur Herstellung einer gewünschten Substanz
|
|
Dieser Artikel braucht die Aufmerksamkeit eines Experten für Chemie. Das spezifische Problem ist: Kurzer und kaum beschaffener Aufsatz. ((März 2016)
|
In Chemie, chemische Synthese ist die künstliche Ausführung nützlicher chemischer Reaktionen, um ein oder mehrere Produkte zu erhalten.[1] Dies geschieht durch physikalische und chemische Manipulationen, die normalerweise eine oder mehrere Reaktionen beinhalten. In modernen Laboranwendungen ist der Prozess reproduzierbar und zuverlässig.
Eine chemische Synthese beinhaltet eine oder mehrere Verbindungen (bekannt als Reagenzien oder Reaktanten), die unter bestimmten Bedingungen eine Transformation erfahren. Verschiedene Reaktionstypen können angewendet werden, um ein gewünschtes Produkt zu formulieren. Dies erfordert das Mischen der Verbindungen in einem Reaktionsgefäß, wie einem chemischen Reaktor oder einem einfachen Rundkolben. Viele Reaktionen erfordern irgendeine Form von Aufarbeitungs- oder Reinigungsverfahren, um das Endprodukt zu isolieren.[1]
Die Menge an Produkt, die bei einer chemischen Synthese erzeugt wird, ist bekannt als Reaktionsausbeute. Typischerweise werden chemische Ausbeuten als Masse in Gramm (in einer Laborumgebung) oder als Prozentsatz der theoretischen Gesamtmenge des Produkts ausgedrückt, die basierend auf dem Grenzreagenz hergestellt werden könnte. EIN Nebenreaktion ist eine unerwünschte chemische Reaktion, die die Ausbeute des gewünschten Produkts verringert. Das Wort Synthese wurde zuerst vom Chemiker Hermann Kolbe verwendet.[2]
Strategien[edit]
In der chemischen Synthese gibt es viele Strategien, die über die Umwandlung von Reaktant A in Reaktionsprodukt B in einem einzigen Schritt hinausgehen. Im mehrstufige Synthesewird eine chemische Verbindung durch eine Reihe einzelner chemischer Reaktionen synthetisiert, von denen jede ihre eigene Aufarbeitung hat.[3] Beispielsweise kann eine Laborsynthese von Paracetamol aus drei einzelnen Syntheseschritten bestehen. Bei Kaskadenreaktionen finden mehrere chemische Umwandlungen innerhalb eines einzelnen Reaktanten statt, bei Mehrkomponentenreaktionen bilden bis zu 11 verschiedene Reaktanten ein einziges Reaktionsprodukt und bei einer Teleskopsynthese durchläuft ein Reaktant mehrere Umwandlungen ohne Isolierung von Zwischenprodukten.
Organische Synthese[edit]
Die organische Synthese ist ein spezieller Zweig der chemischen Synthese, der sich mit der Synthese organischer Verbindungen befasst. Bei der Totalsynthese eines komplexen Produkts können mehrere Schritte erforderlich sein, um das interessierende Produkt und übermäßig viel Zeit zu synthetisieren. Die Fähigkeit zur organischen Synthese wird von Chemikern geschätzt und die Synthese von außergewöhnlich wertvollen oder schwierigen Verbindungen hat Chemikern wie Robert Burns Woodward den Nobelpreis für Chemie eingebracht. Wenn eine chemische Synthese von basischen Laborverbindungen ausgeht, wird sie als rein synthetischer Prozess angesehen. Wenn es von einem aus Pflanzen oder Tieren isolierten Produkt ausgeht und dann zu neuen Verbindungen übergeht, wird die Synthese als halbsynthetischer Prozess beschrieben.
Anorganische Synthese[edit]
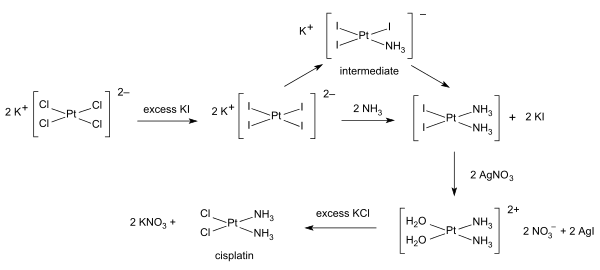
Anorganische Synthese und metallorganische Synthese werden zur Herstellung von Verbindungen mit signifikantem anorganischem Gehalt angewendet. Ein anschauliches Beispiel ist die Herstellung des Krebsmedikaments Cisplatin aus Kaliumtetrachloroplatinat.[4]
Siehe auch[edit]
Verweise[edit]
- ^ ein b Vogel, AI, Tatchell, AR, Furnis, BS, Hannaford, AJ und PWG Smith. Vogel’s Lehrbuch für Praktische Organische Chemie, 5. Auflage. Prentice Hall, 1996. ISBN 0-582-46236-3.
- ^ Kolbe, H. (1845). “Beiträge zur Kenntnisniss der gepaarten Verbindungen”. Annalen der Chemie und Pharmacie. 54 (2): 145–188. doi:10.1002 / jlac.18450540202. ISSN 0075-4617.
- ^ Fortgeschrittene Organische Chemie Teil B: Reaktionen und Synthese Francis A. Carey, Richard J. Sundberg Springer 2013
- ^ Alderden, Rebecca A.; Hall, Matthew D.; Hambley, Trevor W. (2006). “Die Entdeckung und Entwicklung von Cisplatin”. J. Chem. Educ. 83 (5): 728. Bibcode:2006JChEd..83..728A. doi:10.1021 / ed083p728.
Externe Links[edit]
Recent Comments