N-Acetylglutaminsäure – Wikipedia
|
|
| Namen | |
|---|---|
| IUPAC-Name
2-Acetamidopentandisäure[1]
|
|
| Andere Namen | |
| Bezeichner | |
| 3DMet | |
| Abkürzungen | |
| 1727473 S | |
| ChEBI | |
| ChemSpider | |
| Arzneimittelbank | |
| ECHA-InfoCard | 100.024.899 |
| EG-Nummer | |
| KEGG | |
| Gittergewebe | N-Acetylglutamat |
| RTECS-Nummer | |
| UNII | |
|
|
| Eigenschaften | |
| C7h11nÖ5 | |
| Molmasse | 189.167 g·mol-1 |
| Aussehen | Weiße Kristalle |
| Dichte | 1 g ml-1 |
| Schmelzpunkt | 191 bis 194 °C (376 bis 381 °F; 464 bis 467 K) |
| 36 g Liter-1 | |
| Gefahren | |
| Letale Dosis oder Konzentration (LD, LC): | |
| >7 g kg-1(mündlich, Ratte) | |
| Verwandte Verbindungen | |
|
Verwandte Alkansäuren |
|
|
Verwandte Verbindungen |
|
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
|
|
| Infobox-Referenzen | |
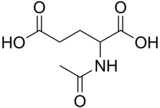
Chemische Verbindung
n-Acetylglutaminsäure (auch bezeichnet als n-Acetylglutamat, abgekürzt GAUL, chemische Formel C7h11NEIN5)[2] wird aus Glutamat und Acetylornithin durch Ornithin-Acetyltransferase und aus Glutaminsäure und Acetyl-CoA durch das Enzym biosynthetisiert n-Acetylglutamat-Synthase. Die Rückreaktion, die Hydrolyse der Acetylgruppe, wird durch eine spezielle Hydrolase katalysiert. Es ist das erste Zwischenprodukt, das an der Biosynthese von Arginin in Prokaryoten und einfachen Eukaryoten beteiligt ist, und ein Regulator in dem als Harnstoffzyklus bekannten Prozess, der bei Wirbeltieren giftiges Ammoniak in Harnstoff umwandelt, der aus dem Körper ausgeschieden wird.
Entdeckung[edit]
n-Acetylglutaminsäure ist ein extrazellulärer Metabolit, der aus dem Prokaryoten Rhizobium trifolii isoliert wurde und mit vielen Strukturbestimmungstechniken wie der protonenkernmagnetischen Resonanz charakterisiert wurde (1H NMR) Spektroskopie, Fourier-Transformations-Infrarotspektroskopie und Gaschromatographie-Massenspektrometrie.
In Rhizobium, extrazellulärer Aufbau von n-Acetylglutaminsäure ist auf einen Metabolismus zurückzuführen, an dem Nod-Faktor-Gene auf einem symbiotischen Plasmid beteiligt sind. Wenn die Nickfaktoren mutiert sind, weniger n-Acetylglutaminsäure wird produziert.[3]
Biosynthese[edit]
Prokaryoten und einfache Eukaryoten[edit]
Bei Prokaryoten und einfachen Eukaryoten n-Acetylglutaminsäure kann hergestellt werden durch n-Acetylglutamat-Synthase (NAGS) oder Ornithin-Acetyltransferase (OAT).
Ornithin-Acetyltransferase (OAT)-Synthese[edit]
OAT synthetisiert n-Acetylglutaminsäure aus Glutamat und Acetylornithin und ist die Methode der Wahl für die Produktion in Prokaryonten, die die Fähigkeit haben, die Verbindung Ornithin zu synthetisieren.[4]
n-Synthese von Acetylglutamat-Synthase (NAGS)[edit]
n-Acetylglutamat-Synthase ist ein Enzym, das als Auffrischer von . dient n-Acetylglutaminsäure zur Ergänzung jeglicher n-Acetylglutaminsäure, die von der Zelle durch Mitose oder Abbau verloren geht. NAGS synthetisiert n-Acetylglutaminsäure durch Katalysieren der Addition einer Acetylgruppe von Acetyl-Coenzym A an Glutamat. Bei Prokaryoten mit nicht-zyklischer Ornithinproduktion ist NAGS die einzige Methode zur n-Acetylglutaminsäure-Synthese und wird durch Arginin gehemmt.[4] Es wird angenommen, dass die Acetylierung von Glutamat verhindert, dass Glutamat durch die Prolin-Biosynthese verwendet wird.[5]
Wirbeltiere[edit]
Im Gegensatz zu Prokaryoten wird NAGS bei Säugetieren durch Arginin zusammen mit Protaminen verstärkt. Es wird gehemmt durch n-Acetylglutaminsäure und ihre Analoga (andere n-acetylierte Verbindungen).[4]
Das Gehirn enthält auch n-Acetylglutaminsäure in Spurenmengen, jedoch wird keine Expression von NAGS gefunden. Das deutet darauf hin n-Acetylglutaminsäure wird von einem anderen Enzym im Gehirn produziert, das noch bestimmt werden muss.[4]
Biologische Rollen[edit]
Wirbeltiere und Säugetiere[edit]
Bei Wirbeln und Säugetieren n-Acetylglutaminsäure ist das allosterische Aktivatormolekül der mitochondrialen Carbamylphosphat-Synthetase I (CPSI), dem ersten Enzym im Harnstoffzyklus.[6] Es löst die Produktion des ersten Zwischenprodukts des Harnstoffzyklus, Carbamylphosphat, aus. CPSI ist inaktiv, wenn n-Acetylglutaminsäure ist nicht vorhanden. In Leber und Dünndarm, n-Acetylglutaminsäure-abhängiges CPSI produziert Citrullin, das zweite Zwischenprodukt im Harnstoffzyklus. Leberzellverteilung von n-Acetylglutaminsäure ist mit 56% in den Mitochondrien am höchsten n– Verfügbarkeit von Acetylglutaminsäure, 24 % im Zellkern und die restlichen 20 % im Zytosol. Aminoacylase I in Leber- und Nierenzellen wird abgebaut n-Acetylglutaminsäure zu Glutamat und Acetat.[7] Im Gegensatz, n-Acetylglutaminsäure ist nicht der allosterische Cofaktor der Carbamylphosphat-Synthetase im Zytoplasma, der an der Pyrimidinsynthese beteiligt ist.[8]
n– Die Konzentrationen von Acetylglutaminsäure steigen, wenn der Proteinverbrauch aufgrund der Ansammlung von Ammoniak, das durch den Harnstoffzyklus ausgeschieden werden muss, ansteigt, was die Rolle von . unterstützt n-Acetylglutaminsäure als Cofaktor für CPSI. Außerdem, n-Acetylglutaminsäure kann in vielen häufig konsumierten Lebensmitteln wie Soja, Mais und Kaffee gefunden werden, wobei Kakaopulver eine bemerkenswert hohe Konzentration enthält.[9]
Mangel an n-Acetylglutaminsäure beim Menschen ist eine autosomal-rezessiv vererbte Erkrankung, die zu einer Blockierung der Harnstoffproduktion führt, was letztendlich die Konzentration von Ammoniak im Blut erhöht (Hyperammonämie). Ein Mangel kann durch Defekte im NAGS-kodierenden Gen oder durch Mängel in den für die Synthese essentiellen Vorläufern verursacht werden.[4]
Bakterien[edit]
n-Acetylglutaminsäure ist das zweite Zwischenprodukt im Arginin-Produktionsweg in Escherichia coli und wird über NAGS produziert.[5] Auf diesem Weg, n-Acetylglutaminsäurekinase (NAGK) katalysiert die Phosphorylierung der (dritten) Gamma-Carboxylgruppe von n-Acetylglutaminsäure unter Verwendung des Phosphats, das durch Hydrolyse von Adenosintriphosphat (ATP) hergestellt wird.[10]
Wurzeln des Weißklee-Sämlings[edit]
Rhizobium kann eine Symbiose mit den Wurzeln von Weißkleesämlingen eingehen und Kolonien bilden. Das extrazelluläre n-Die von diesen Bakterien produzierte Acetylglutaminsäure hat drei morphologische Wirkungen auf die Wurzeln des Weißklee-Keimlings: Verzweigung der Wurzelhaare, Anschwellen der Wurzelspitzen und Erhöhung der Zahl der Zellteilungen in undifferenzierten Zellen, die sich auf der äußersten Zellschicht der Wurzel befinden . Das deutet darauf hin n-Acetylglutaminsäure ist an der Stimulation der Mitose beteiligt. Die gleichen Effekte wurden beim Erdbeerklee beobachtet, jedoch nicht bei Hülsenfrüchten. Die Effekte von n-Acetylglutaminsäure auf die Kleearten war stärker als die Wirkung von Glutamin, Glutamat, Arginin oder Ammoniak.[4]
Struktur[edit]

n-Acetylglutaminsäure besteht aus zwei Carbonsäuregruppen und einer Amidgruppe, die aus dem zweiten Kohlenstoff herausragt. Die Struktur von n-Acetylglutaminsäure bei physiologischem pH (7,4) hat alle Carboxylgruppen deprotoniert.
Protonen-NMR-Spektroskopie[edit]

Die molekulare Struktur von n-Acetylglutaminsäure wurde mittels Protonen-NMR-Spektroskopie bestimmt.[3] Protonen-NMR zeigt das Vorhandensein und die Position der funktionellen Gruppen von Protonen basierend auf den im Spektrum aufgezeichneten chemischen Verschiebungen.[11]
13C-NMR-Spektroskopie[edit]
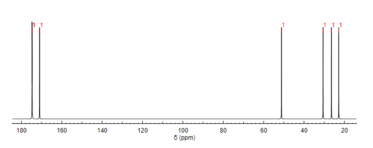
Wie Protonen-NMR, Kohlenstoff-13 (13C) Die NMR-Spektroskopie ist eine Methode zur Bestimmung der Molekülstruktur. 13C-NMR zeigt die in einem Molekül vorhandenen Kohlenstoffarten basierend auf chemischen Verschiebungen, die bestimmten funktionellen Gruppen entsprechen. n-Acetylglutaminsäure weist aufgrund der drei carbonylhaltigen Substituenten am deutlichsten Carbonylkohlenstoffe auf.[12]
Siehe auch[edit]
Verweise[edit]
- ^ “n-Acetyl-DL-Glutaminsäure – Zusammenfassung der Verbindungen”. PubChem-Verbindung. USA: Nationales Zentrum für Biotechnologie-Informationen. 25. März 2005. Identifizierung. Abgerufen 25. Juni 2012.
- ^ Pubchem. “n-Acetyl L-Glutaminsäure”. pubchem.ncbi.nlm.nih.gov. Abgerufen 2018-06-03.
- ^ ein B Philip-Hollingsworth S, Hollingsworth RI, Dazzo FB (September 1991). “n-Acetylglutaminsäure: ein extrazelluläres Nicksignal von Rhizobium trifolii ANU843, das Wurzelhaarverzweigungen und knötchenartige Primordien in Weißkleewurzeln induziert”. Die Zeitschrift für biologische Chemie. 266 (25): 16854–8. mach:10.1016/S0021-9258(18)55380-1. PMID 1885611.
- ^ ein B C D e F Caldovic L, Tuchman M (Juni 2003). “n-Acetylglutamat und seine sich verändernde Rolle durch die Evolution”. Das biochemische Journal. 372 (Teil 2): 279–90. mach:10.1042/BJ20030002. PMC 1223426. PMID 12633501.
- ^ ein B Caldara M, Dupont G, Leroy F, Goldbeter A, De Vuyst L, Cunin R (März 2008). “Arginin-Biosynthese in Escherichia coli: experimentelle Störung und mathematische Modellierung”. Die Zeitschrift für biologische Chemie. 283 (10): 6347–58. mach:10.1074/jbc.M705884200. PMID 18165237.
- ^ Auditore, Joseph V.; Wade, Littleton; Olson, Erik J. (November 1966). “Das Auftreten von n-Acetyl-L-Glutaminsäure im menschlichen Gehirn”. Zeitschrift für Neurochemie. 13 (11): 1149–1155. mach:10.1111/j.1471-4159.1966.tb04272.x. ISSN 0022-3042. PMID 5924663. S2CID 43263361.
- ^ Harper MS, Amanda Shen Z, Barnett JF, Krsmanovic L, Myhre A, Delaney B (November 2009). “n-Acetyl-Glutaminsäure: Bewertung der akuten und 28-tägigen oralen Toxizität und Genotoxizität bei wiederholter Gabe. Lebensmittel- und chemische Toxikologie. 47 (11): 2723–9. mach:10.1016/j.fct.2009.07.036. PMID 19654033.
- ^ Pelley JW (2007). „Kapitel 14: Purin, Pyrimidin und Single-Carbon-Metabolismus“. Integrierte Biochemie von Elsevier. Sonst. S. 117–122. mach:10.1016/b978-0-323-03410-4.50020-1. ISBN 978-0-323-03410-4.
- ^ Hession AO, Esrey EG, Croes RA, Maxwell CA (Oktober 2008). “n-Acetylglutamat und n-Acetylaspartat in Sojabohnen (Glycin max L.), Mais (Zea mays L.), [corrected] und andere Lebensmittel”. Zeitschrift für Agrar- und Lebensmittelchemie. 56 (19): 9121–6. mach:10.1021/jf801523c. PMID 18781757.
- ^ Gil Ortiz F, Ramón Maiques S, Fita I, Rubio V (August 2003). “Der Verlauf von Phosphor bei der Reaktion von n-Acetyl-L-Glutamatkinase, bestimmt aus den Strukturen kristalliner Komplexe, einschließlich eines Komplexes mit an AlF−
4 Übergangszustandsnachahmung”. Zeitschrift für Molekularbiologie. 331 (1): 231–44. mach:10.1016/S0022-2836(03)00716-2. PMID 12875848. - ^ “Vorhersagen 1H-Proton-NMR-Spektren”. www.nmrdb.org. Abgerufen 2018-06-03.
- ^ “Vorhersagen 13C-Kohlenstoff-NMR-Spektren”. www.nmrdb.org. Abgerufen 2018-06-03.
Recent Comments