セリアック病 – ウィキペディア、無料百科事典
| Coeliakia、内臓の病気 | |
 セリアック病を示す小腸生検 – 絨毛萎縮、地下症の過形成、クリプト中のリンパ球の浸潤 |
|
| ICD-10 |
K90.0 |
|---|---|
セリアシア 、 内臓 、グルテンへの過敏症からの過敏症からの腸症 – グルテンと関連するプロラミンによって引き起こされる体の免疫応答によって条件付けられた、遺伝的に素因となる人々に発生する体の免疫応答によって条件付けられた腸症。グルテンに依存する臨床症状の存在、内臓疾患、HLA-DQ2および/またはDQ8に特異的な血清抗体の存在によって特徴付けられます。 [初め] 。
誤った免疫反応は、プロラミンと呼ばれる穀物タンパク質のグループに対する免疫系の過度の反応、そしてより正確にはそれらに由来する分数で構成されています:グリャジン(小麦)、セカリン(力)、ホルデノ(大麦) [2] 。食事からのオート麦(アベニナ)の除外に関する矛盾したデータがあります [3] 多くの研究がその安全性を示しているからです [4] [5] 。オート麦は、他の禁止された穀物の混合物に汚染されていない場合、内臓疾患の患者の95%にとって安全です [6] 。グルテンはこの病気を引き起こすことはできませんが、その存在のみを明らかにするだけであることに注意する必要があります。
コーン病は、子供と大人の両方で発生します [2] 。その発生の頻度は同様のレベルですが、国によってわずかに異なります。セリアック病はヨーロッパで最も一般的な胃腸疾患の1つです [2] 。内臓病は1:80から1:300に発生すると推定されています [6] [7] [8] [9] [十] [11] 。
セリアック病の国家登録簿はポーランドに保管されていないため、疫学データのみが推定されるのはそのためです [11] [12番目] 。セリアック病のほとんどは認識されていません [12番目] 。人口の約1%がセリアック病に苦しんでいると推定されています。つまり、ポーランドでは約40万人です [13] 。
セカック州の親ship 1:39の場合、最初の度の相対的なセリアック病に苦しむ患者を発症するリスク(同じ研究では、人口リスクは1:133と推定されました) [8] 。同一の双子では、双子の1人が病気になっている場合、もう1人を開発するリスクは75%です。 [2] [14] 。コーン病は女性で2倍頻繁に発生します [6] 。
疾患の古典的な形態は患者の30〜40%でのみ発生すると考えられており、より頻繁に隠されていない形があります [2] 。
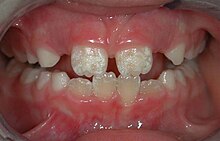
臨床像は、患者の年齢と病気の臨床形態に依存します。セリアック病には4つの形態があります。古典的で、静かで、潜在的で潜在的な姿です。
- 公共 (その他の名前:クラシック、フルブラッシュ、アクティブ) – 症例の約30%で発生します – 腹痛、慢性下痢、豊富な悪臭を放つ脂肪便、鼓腸、腹周囲の拡大、体重減少 [15] 、グルテンの導入後の体重増加と長さの阻害、子供の成長と成熟の阻害、貧血 [15] 、骨粗鬆症 [16] 。
- キャラクターはそうではありません (Underest -Handed) – 悪い吸収症候群の古典的な症状の欠如にもかかわらず、腸の粘膜の典型的な変化と血清中の典型的な抗体の存在が認識されています。臨床的には、貧血、乳糖不耐症 [17] 、スクロース不耐性、早期骨粗鬆症を伴う低カルシウム血症 [16] 、成長と体重の欠乏。この疾患の形態は、セリアック病患者の第一級患者、糖尿病およびその他の自己免疫疾患の人でよりよく観察されます。
- 潜在 [17] (ラテンナ、後期) – 過去に腸絨毛とセリアック病の臨床症状と診断されたが、グルテンのない食事を使用した後に道を譲った年長の子供や成人で発生します。不利な要因の影響下(ストレス、手術、妊娠、慢性胃腸管 [17] )症状の再発があるかもしれません。
- 潜在的な数字 [17] – この形では、臨床症状は見つかりませんでした。または腸絨毛は萎縮ですが、HLLA DQ2および/またはDQ8ハプロタイプと内臓に特異的な抗体の存在が診断されます。
| 内臓病の分類 | 臨床症状 | 十二指腸生検(マーシャ分類) | EMA、TTG、DPG抗体 | DQ2 I / The Cross DQ8を超えるハプロタイプ |
|---|---|---|---|---|
| 明示的な内臓病 | 腸症の典型的な症状 | 3 a、b、c | + | + |
| 内臓病はありません | 非定型 | 2、3 | + | + |
| 潜在的な内臓病 | 症状はありません | 0、1 | +/ – | + |
| 潜在的な内臓疾患 | 症状はありません | 0 | + | + |
親の症状 [ 編集 | コードを編集します ]
| システム/オルガン | 症状 |
|---|---|
| 洞窟口頭 | 再発性アフタ [11] 、エナメル質低下 [15] 、 虫歯 [2] 。 |
| 肌 | デュンギャ病 |
| 内分泌系 | タイプI糖尿病 [15] 、橋本甲状腺炎 [15] 、甲状腺機能低下症 [2] 、アディソン病 [2] , choroba Gravesa-Basedowa [2] 、性腺機能低下症 [2] 。 |
| 血液障害 | lax [2] 、貧血 [2] 、自己免疫性溶血性貧血 [2] 。 |
| 循環系 | レイノー病 [2] 。 |
| 骨関節系 | 筋力の衰弱 [15] 、関節炎。 |
| 代謝変化 | 脂肪溶性ビタミンの欠乏 [16] (A、D、E、K)、コレステロールの上昇 [18] 、テトリウス(低球性血症) [15] 。 |
| 目の症状 | 虹彩炎症 [2] 、毛様体 [2] 。 |
| 神経系 | アテカー [15] [19] 、てんかん [15] 、片頭痛 [15] 、進行性小脳症候群 [2] 、コア変性 [2] 、発作による脳の石灰化 [11] 、ミオパシー [20] および末梢神経障害(ビタミンB欠乏症 12番目 I b 初め )。 |
| 精神障害 | 統合失調症 [21] [22] [23] 、自閉症 [21] 、 認知症 [24] 、 うつ [21] [2] 。 |
| 生殖システム | 月経の期間はありません [15] 、月経遅延 [15] 、不規則な月経 [2] 、不妊 [15] [25] 、習慣的な流産 [15] [25] 、子宮内低栄養 [25] 、低出生体重 [25] 。 |
結腸直腸癌のリスクがわずかに増加する報告があります [26] 。
内臓疾患の病因は多因子です。あなた自身の抗原に対する抗体があるため、visocular疾患は自己免疫疾患として治療することができます。それは、遺伝的に素因となる人々ではるかに頻繁に発生します。他の疾患との違いは、疾患の症状、腸の変化、およびグルテンを除去した後の抗体の消失に変わることです。これは原因因子です。
目に見える病気は、ポーランドの人気の穀物の成分、小麦、ライ麦、大麦によって引き起こされます。 グルテン 小麦に含まれています、 セカリーナ (ライ麦成分)i ホルデイナ (大麦成分)は、素因のある人々の誤った免疫応答の原因です。その結果、消化プロセスの産物である低分子化合物を吸収することが生理学的役割の生理学的役割の損傷または完全な消失さえあります。 DisacharyDaseの活動も減少しているため、乳糖不耐症を発症するリスクが高まっています。また、腸ホルモンを生成する細胞の数は減少します [27] 、運動障害、膵臓の障害、消化器および吸収障害の重症度につながります。これらのプロセスの結果、栄養素の吸収、慢性下痢の発生、欠乏症、および体の破壊が損なわれます。食事治療の導入前は、内臓疾患は12%の死亡率と関連していた [7] (1939年からの遡及的検査)。
ロラ・プロラミン [ 編集 | コードを編集します ]
プロラミンは、穀物を含む草の種子に存在する予備タンパク質であり、グルタミンやプロリンが豊富です [28] 。これらのタンパク質はプロテアに耐性があります。グルテン、セカリン、ホルダインもプロラミンに含まれています。グルテインの元素の1つ(水とアルコール可溶性のグルテン画分)は腸細胞に影響を及ぼし、緊密な細胞間接続の緊密さを減らし、腸内障壁の透過性を増加させます [29] 。これにより、グルテンを含むマクロペプチド循環への移行が可能になり、そこで免疫系が利用できるようになり、thutsからの反応が生じます [29] [30] 。
組織トランスグルタミナーゼと自己抗体の役割 [ 編集 | コードを編集します ]

組織トランスグルタミナーゼ(TTG)は、多くの生化学プロセスに関与する酵素です。 Glyadineはその基質の1つです。ペプチドは、2つの反応でTTGによって修飾されます [最初に30] :脱アミド化(残りのグルタミンからのAMID基の除去)またはトランスアミド化(3倍の頻繁な反応は、グリャジナからリジンまでの残りのグルタミンのネットワーキングにあります)。このプロセスから生じるタンパク質は、より免疫原性になります [32] 。アミド化は酵素の活性中心の外でも発生する可能性があります。同時に、GladynaとTTGの永続的な結合が作成されます [33] 。これにより、TTGに対する抗体の形成とともに免疫応答を引き起こす新しいエピトープが作成されます [34] 。
患者の血清では、組織トランスグルタミナーゼに対する抗体に加えて、検出されます。 TTG )、antandomisal抗体( 母親 )、抗毒素( 私たちは買う )、anti -gaps( しかし )グリャジンの排水ペプチドに対する抗体( DGP )) [17] 。アンタンドミス抗体は、細胞の表面にある組織トランスグルタミナーゼに対する一種の抗体と見なされています [2] 。抗体は、疾患の診断、IGAクラスアンタンドミス抗体(EMA)、組織トランスグルタミナーゼ(TTG)に対する、およびグリジンの排水ペプチド(DGP)に対する抗体で使用されます。 [17] 。
ロタウイルス下痢をした小児の組織トランスグルタミナーゼに対する抗体を検出する検査のセロコンバージョンについて説明します [35] 。
遺伝学 [ 編集 | コードを編集します ]
セリアック病患者の大多数は、HLA-DQ2またはDQ8の2種類のHLA-DQのいずれかを持っています [17] [36] 。この遺伝子は、抗原を提示するMHCクラスII受容体システムの一部であり、免疫系が独自の細胞と見知らぬ人を区別できるようにします。この遺伝子は6番目の染色体の短い肩にあり、セリアック病との関係により、遺伝子座はセリアックと呼ばれます1 [37] 。
7種類のHLA DQ(DQ2およびDQ4 -DQ9)が授与されました。 DQ2またはDQ8アイソフォームは、セリアック病患者の99%以上を持っています [11] [17] 。
負に帯電したアミノ酸残基を結合する能力が大きいため、これらの遺伝子の産物である受容体は、この受容体の他の形態よりも硬いグリジンのペプチドを結合します [38] 。次に、MHCクラスII粒子に関連する抗原がCD4リンパ球を提示します + そしてそれらをアクティブにします [38] [39] 。
セリアック病のほとんどの患者は、DQ2.5ハプロタイプと呼ばれるTwogen HLA-DQ2ハプロタイプを着用しています。このハプロタイプは、2つのサブユニット、DQα5とDQβ2をコードする2つの隣接する遺伝子対立遺伝子、DQA1*0501およびDQB1*0201で構成されています。ほとんどの場合、DQ2.5アイソフォームは、両親から遺伝する2つの染色体6のいずれかによってコード化されています。ほとんどのセリアック病は、DQ2.5ハプロタイプの1つのコピーを継承しますが、両親の両方から継承する人もいれば、深刻な合併症にさらされています。一部の人々は、親の1人からDQ2.5を継承し、他の親からハプロタイプの一部(DQB1*02またはDQA1*05)を継承し、リスクを増加させます [40] 。
内臓疾患の人の約1%のみがHLA DQ2および/またはDQ8を持っていません [17] [41] [42] 。
免疫因子 [ 編集 | コードを編集します ]
T CD4リンパ球による異常な調節は、異常な免疫応答の開始に重要な役割を果たします + TCRαβ。 HLA-DQ2およびHLA-DQ8分子は、負電荷のアミノ酸が豊富なポリペプチドとの接続を好むことを示しています [2] 。組織トランスグルタミナーゼによるグルテンの軽amiは、グルテン、プロリン、グルタミンが豊富なグルテンに親近感をさらに増加させます。グルテンの格差は、TCR受容体に対するその親和性を50〜100倍増加させます [2] 。グルテンは食作用を受け、次にAPC細胞による提示を受けます。抗原は、IFN-α、TNF-α、IL-2、IL-6を含む炎症誘発性サイトカインの特定のTCR受容体によって診断されます。効果的な応答段階が開発されています。この段階でCD8リンパ球が最も重要な役割を果たします + – 腸細胞の破壊につながる細胞毒性Tリンパ球 [2] 。その結果、消化器酵素の産生と消化管で産生される組織ホルモンの障害を減らすため、小腸粘膜の腸絨毛の損傷。これらの損傷の結果、腸の運動性障害、食物に含まれる物質の異常な消化と吸収、および関連する欠陥の形成 [27] 。
| テスト | 感度 | 特異性 |
|---|---|---|
| 組織トランスグルタミナーゼに対する抗体 | 91% | 99% |
| 子宮内膜に対する抗体 | 81% | 99% |
診断では、最も重要なのは、特徴的な抗体の決定、十二指腸粘膜バイオプテートの変化の組織病理学的検査、およびHLA DQ2および/またはDQ8ハプロタイプの声明です。
血清学的テスト [ 編集 | コードを編集します ]

内臓疾患の診断では、組織トランスグルタミナーゼ(TTG)に対する抗内科抗体(EMA)およびグリジンの阻害ペプチド(DGP)に対する抗体が決定されます [17] IGAクラスでは、IGA欠乏を事前に除外した後、総IgAレベルを評価する必要があります [11] 。 IgAレベルが0.2 g/L未満の場合、抗体はIgGクラスでマークされています [初め] 。抗GAP抗体(AGA)は非特異的と見なされています [2] 。
レベルの結果の解釈では、血清の総IgAレベル、消費されるグルテン、グルテン消費、患者の年齢、免疫抑制薬の総レベル [初め] 。グルテンが長期間(数週間から1年)食事から撤回された場合、または展示会が短かった場合、否定的な結果は信頼できません [初め] 。
TTGAの指定は、非常に高い感度(90%以上)と特異性(ほぼ100%)を持っているため、推奨されるスクリーニングテストです。血清学的検査はスクリーニングに価値がありますが、肯定的な結果に基づいて診断を下すことはできませんが、否定的な結果の場合、セリアック病は除外される可能性があります [17] [a] 。
セリアック病の血清学的マーカーは、世界で初めて世界で初めて記述されました。 [43] [44] 。
遺伝子検査 [ 編集 | コードを編集します ]
内臓疾患の診断では、HLA-DQ2および/またはDQ8対立遺伝子を決定することをお勧めします [17] 。セリアック病の患者では、HLA-DQ2の発生率は90-95%、HLA-DQ8は5-10%で、一般集団DQ2で25-30%、HLA-DQ8は5〜15%と推定されます。 [11] [17] 。内臓疾患の人の約1%のみがHLA DQ2および/またはDQ8を持っていません [17] [41] [42] 。 HLA-DQ2またはHLA-DQ8抗原がないことは、実際にこの病気を除外しています [初め] [30] [38] [45] [46] 。
組織病理学 [ 編集 | コードを編集します ]

小腸粘膜の組織病理学的検査は、セリアック病の診断において重要であり、小腸生検を行わずに認識できません。内視鏡検査中に導入されたクロスビーカプセルを使用して、ダニまたは吸引生検を使用して、内視鏡下十二十葉検査(胃鏡検査)の間にクックが採取されます [45] [47] 。カプセルも飲み込むことができますが、これはカプセルの位置の放射線的制御の必要性に関連しています。十二指腸パッド(> 1場所)および十二指腸のさらなる部分(> 4場所)から挿し木をダウンロードする必要があります [初め] 。粘膜はヴァテラのいぼの下に服用する必要があります。サンプルは、Marsha分類に従って評価されます。推奨事項は、湿地によると、内臓病の特徴として湿地によると、タイプ2と3の変化を想定しています [17] 。
内視鏡検査 [ 編集 | コードを編集します ]

十二指腸内視鏡検査では、十二指腸foldの数、平坦化、または萎縮が減少し、縁が溝を掘り、粘膜表面のモザイク構造、粘膜血管の半透明を示しています。 [45] 。テスト中、組織病理学的検査のためにサンプルが採取されます。
臨床検査 [45] [ 編集 | コードを編集します ]
セリアック病の診断に関する以前の基準は、1997年にESPGHANによって確立されました( 欧州小児胃腸科、肝臓学、栄養学 )。
病気を認識するには、見つける必要がありました [17] [45] :
- 内臓疾患に特徴的な3つの抗体のうち少なくとも2つ(EMA、TTG、DPG);
- 小腸粘膜の特徴的な形態学的変化;
- 食事後の抗体の抗体が導入されます。
2012年の現在のESPGHANガイドライン。 [初め] 彼らは、セリアック病または遺伝的負荷を示す症状の発生に応じて、小児および青年にいくつかの診断経路を提供します。
スクリーニングテストの適応 [ 編集 | コードを編集します ]
多くの場合、しばしば非特徴的な症状があるため、選択された患者グループでスクリーニングを行うことをお勧めします。 1997年のEspghanの勧告によると [初め] 2つの患者グループには診断検査をお勧めします。セリアック病の疑いを喚起する臨床症状のある患者や、内臓疾患を発症するリスクの増加グループで。
グループ1-原因不明の主観的および被験者の症状のある患者 [ 編集 | コードを編集します ]
- 慢性または再発性下痢、
- 慢性腹痛、
- 慢性便秘、
- 鼓腸、
- 吐き気、嘔吐、
- 減量、
- 成長阻害、
- 開発遅延、
- 政治の遅れ、
- 月経の期間はありません、
- 鉄欠乏性貧血、
- 慢性疲労、
- 再発性アフティック経口炎症、
- デュビリンガ病、
- 骨折、骨減少症、骨粗鬆症、骨折
- 肝機能の生化学試験の誤った結果。
グループ2-セリアック病のリスクを高める状態の症状のない患者 [ 編集 | コードを編集します ]
治療の唯一の方法はグルテンを含まない食事です [3] 、小麦、ライ麦、大麦の食べ物からの完全かつ中断のない除去で構成されています。グルテンを含まない食事は、小腸の変化を伴う内臓疾患の症候性型の各患者と、小腸の変化を伴う無症候性患者に推奨されるべきです [17] 。医師は、抗体が存在する患者の治療と正しい十二指腸生検を考慮する必要があります [17] 。通常、毎日のグルテン摂取量> 100 mg/日は症状の発生につながります [48] 。食事中のグルテンの安全な含有量は35 mg/日未満ですが、一部の患者は10 mg/日の消費量に耐えていません [11] [49] 。米とトウモロコシは許可されています [6] 。オート麦は内臓病の患者の95%にとって安全です [6] 、他の、禁止された穀物の混合物で汚染されていない場合。治療の初めに、低脂肪とウグラクトースの食事が使用されます [48] [50] 。グルテン – フリーダイエットには、繊維が少なすぎます [3] 、便秘のリスクの増加に関連している可能性があります。患者は、全粒穀物、トウモロコシ、ジャガイモ、果物で食事を補充する必要があります。グルテンフリーの食事にビタミンB、ビタミンD、カルシウム、鉄、亜鉛、マグネシウムも補充する必要があります [3] 。栄養不足、マイクロエレメント、電解質、ビタミンDおよびKを観察し、早期に検出する必要があります [51] 、鉄とそれらが見つかった場合 – 欠陥のアライメント。また、早期骨粗鬆症の観点から骨格系を観察する必要があります [3] 。別の問題は、グルテンを使用した食事を使用した結果としての肥満の頻度の増加です [3] 。グルテン毒性を低下させる試みが掲載されている研究も掲載されています。それらの1つによると、細菌酵素の経口消費であるプロリレンドペプチダーゼは、その毒性を低下させます [52] 、将来の治療で使用される可能性があります。
| グルテンを含むいくつかの製品、内臓疾患では許可されていません |
|---|
|
| コーンで許可されているいくつかの食品 |
|---|
|
また、缶詰、アロマなど、グルテンの非常に隠された隠された供給源である製品についても覚えておく必要があります。小麦が使用されるビール、患者は消費すべきではありませんが、蒸留物が高い穀物で作られた強力なアルコールは病気によって十分に許容されます [53] 。また、ソーセージ、ソーセージ、ソーセージ、クリーム、その他の食品にはグルテンが含まれています。
2012年1月1日から、欧州連合で有効な規定に従って、グルテン含有量が最終消費者に20 mg/kg(20 ppm)を超えない食品の20 mg/kg(20 ppm)を超えない場合、100 mg/kg以下の食品のコンテンツを備えた製品を備えた製品を販売する製品では、Glutenを販売する場合は非常に低い製品に言及している場合は、口頭で「グルテンを含まない製品」で使用できます。 [54] [55] 。
疾患のモニタリングには、症状の定期的な制御、発達の評価、および特定の抗体の定期的な検査が含まれます。実装されたダイエットの導入から6か月後、症状の存在を評価し、TTGマークを評価する必要があります [17] 。 6か月後に抗体がまだ存在している場合は、食事の順守を評価する必要があります [17] 。
2012年には、グルテン消費によって引き起こされる疾患の命名法を組織しようとしました(英語 グルテン関連障害 )。提案 グルテン関連障害の分割 [56] :
- セリアシア、
- デュビリンガ病、
- グルテン関連の運動失調(英語 グルテン運動失調 )、、
- グルテンに対する非セミレアカル過敏症 [57] 。
用語:グルテンに対する過敏症は推奨されません [56] 、グルテン不耐性 [56] 。
グルテンに対する非セミュリアル過敏症は、TTGとEMAおよび腸の炎症の間、グルテンによって引き起こされる症状がある状態として定義されます [19] [56] 。ハプロタイプHLA DQ2またはDQ8は存在する必要はありません [56] 。胃腸症状は似ているかもしれません [56] 。グルテンとセリアック病に対する非標準過敏症の基本的な違いは TTGおよびEMA抗体の欠如 、 十二指腸の切り抜きの組織病理学的絵を正しくします その他の自己免疫疾患 [56] [19] 。
グルテンに対する非ali類の過敏症の診断は、除外の診断です [19] 、セリアック病と穀物アレルギーの分化に基づいています。セリアック病は、TTG、EMA抗体の欠如、および腸生検の負の結果を決定することによって除外されます(また、セリアック病の潜在的な形態は抗体の欠如を決定することによって除外されます。追加の確認は、典型的なハプロタイプの欠如です) [19] 。グルテンに対する非セミレアカル過敏症は、グルテンを食事に再誘導することによって確認されます(そのため、グルテン誘発された挑発 [58] 、。 グルテンチャレンジ )および症状の再発。グルテンのない食事も治療に使用されます [19] 。
1人の患者がグルテンとセリアック病に対する食物アレルギーの両方を持っていることがあります。アレルギーは一時的なものになる可能性があるため、その消失後、グルテン食が回復しますが、セリアック病の人々に害を及ぼします。したがって、専門家によると、グルテンアレルギーの診断 [58] 。
以下も提案されています 病気の形の分割 [56] :
- クラシック – これは、吸収障害の症状のある病気の形です。診断には、下痢、脂肪便、減量、または成長の阻害が必要です。
- 非古典的 – これは、吸収障害の症状のない病気の形です。
- 典型的 – 歴史的に、この病気の典型的な形態には、吸収症候群の不良症状に関連する症状が含まれていました。現在、「典型的な」セリアック病の画像が変化しているため、この用語を使用することはお勧めしません。
- 非定型 – 「典型的な」セリアック病の歴史的用語に関連する概念は、このアプローチでは、典型的な吸収症候群を含まないセリアック病の症状のセットです。
- 静かな – これは、無症候性のセリアック病と同等の概念です、 コンセプトを使用しないでください 。
- 公共 – これは、典型的な胃腸症状または非経口症状のある病気の形です。 締め切りは使用しないでください 、症候性セリアック病をお勧めします。
- 無症状 – それはセリアック病の形態として定義されます。セリアック病は、症状のない臨床検出閾値を下回っており、実際にはセリアック病に対する診断を開始します。
- 潜在的 – これは、正常な腸粘膜の疾患の形であり、セリアック病の血清学的検査の陽性の結果が、病気のリスクが増加するグループで発生します。
- 無症候性 – これは、グルテンの撤退後に道を譲る臨床症状の発生のない病気の形です。診断は通常、スクリーニングの結果として置かれます。
- オポルナ (RCD) – 腸絨毛の進行中の萎縮で12か月間グルテンを除外した後、悪い吸収症候群の持続的または再発性症状として定義されます。ほとんどの患者はEMAまたはTTG抗体を検出しませんが、その存在は診断を除外しません。再発性セリアック病は2つのグループに分けられます。 I型は、栄養素内リンパ球の数が増加することを特徴としています(IIEL)。タイプIIは、異常なIELのクローン増殖によって特徴付けられます。リンパ球は、内皮内発現CD3(CD3ε)を含む表面CD3、CD4、およびCD8の損失によって特徴付けられます。内皮リンパ球の50%を超える免疫組織化学、または流量細胞測定で評価された20%以上で評価されました。 T(γまたはΔ)リンパ球受容体鎖を参照するクローンは、ポリメラーゼの連鎖反応でも検出されます [59] [60] [六十一] 。
耐性セリアック病(RCD)とセリアック病は症候性です(非応答) [ 編集 | コードを編集します ]
グルテンを含まない食事に反応しないように見える患者のグループがいます。これらの患者では、「耐性セリアック病」の診断を考慮する必要があります。耐性セリアック病は、腸絨毛の進行中の萎縮で12か月間グルテンを除外した後、悪い吸収症候群の持続的な症状として定義できます。 [b] [62] 。このような診断は12か月後にのみ行うことができます。これは、グルテンを含まない食事による1年の治療後の40%でまだヴィリがあるためです。 [62] 。しかし、治療をサポートしないほとんどのセリアック病はセリアック病に耐性がありません。実際、それらは症状のあるセリアック病であり、耐性セリアック病の組織学的定義には対応していません [62] 。
これは、次の状況による可能性があります。
- 食事からのグルテンの不完全な除外 – グルテンは多くの食品に存在しますが、多くの場合、やる気や訓練を受けた患者でさえ、グルテンの完全な撤退に困難があります [62] 。
- グルテンに対する異なる感受性 – ほとんどの患者は微量のグルテン(10-20 mg/kg)に耐えることができますが、症状の一部は安全と見なされる閾値を下回っています [62] 。
- セリアック病に関連していない症状 – 提示された症状の範囲は非常に広く、症状は他の病気の状態と一致する可能性があります [62] 。
- 症状の二次原因 – セリアック病は二次乳糖不耐症にも関連しており、腸絨毛の更新にもかかわらず症状が持続する可能性があります。セリアック病に起因する他の障害には、リンパ球大腸内炎および膵臓floco贅低下障害が含まれます。これらの状態は、グルテンの離脱にゆっくりと不十分に反応する可能性があります [62] 。
- セリアック病に関連するセリアック病 – セリアック病には、グルテンの離脱に反応しない自己免疫疾患が伴う場合があります [62] 。
- 間違った診断 [62] 。
耐性セリアック病の診断は困難で議論の余地があります。ほとんどの場合、グルテン消費があるか、グルテンの感受性が非常に高いため、その除去は困難または不可能であると考えられています [63] 。耐性セリアック病の患者の十二指腸粘膜におけるリンパ球の分析の結果、異常なリンパ球が発見され、その存在はRCDの定義を促進します [六十四] [65] 。非定型リンパ球は、腸症性T細胞リンパ腫に見られる細胞との類似性を示しています(EATL、英語 腸症に関連するT細胞リンパ腫 )。それらは、表面CD3およびCD8抗原の発現の欠如によって特徴付けられますが、細胞内CD3を維持している間、T細胞受容体(TCR)のクローン再配置の存在も示しています。 [66] [六十七] [68] 。したがって、耐性セリアック病は、腸絨毛の進行中の萎縮で12か月間グルテンを除外した後、悪い吸収症候群の持続的または再発性症状として定義されます。ほとんどの患者はEMAまたはTTG抗体を検出しませんが、その存在は診断を除外しません。再発性セリアック病は2つのグループに分けられます。不規則性のない、むずむずしたリンパ球(IIEL)の数を使用して、増加した(100腸細胞あたり20匹のリンパ球)を特徴とするI型。タイプIIは、異常なIELのクローン増殖によって特徴付けられます。リンパ球は、表面内発現CD3(CD3ε)を伴う表面CD3、CD4、およびCD8の損失によって特徴付けられます。
タイプIとタイプIIの両方は、セリアック病の治療結果の悪化に関連しています。タイプのEATLリンパ腫の進行と非常にまれです [c] 。タイプIIでは、EATLの進行が32〜67%に発生する可能性があります [60] [六十一] 。
耐性セリアック病の合併症は潰瘍性腸の炎症である可能性があります(英語 潰瘍性発電器炎 )。炎症は非定型のiielリンパ球によっても引き起こされますが、潰瘍はEATLリンパ腫の存在なしに現れます。潰瘍性腸の炎症は、II RCDタイプではるかに一般的です [60] [62] [63] [六十四] [69] 。
耐性セリアック病の治療は、特殊なセンターで実施する必要があります。医療監督の増加、食事の厳密な順守、グルテン除外の再評価が必要です。 現在、特定の治療を推奨するのに十分な証拠はありません [62] 。
コルチコステロイドの使用は議論の余地があります [62] 。プレドニゾロンを用いたいくつかの研究で [60] [70] 組織学的反応が得られました(30〜40%)が、治療は重大な副作用をもたらしました [62] 。他の研究では、このタイプの治療に対する反応は得られませんでした [62] 。有害性の低いブデソニドでは、治療の試みが記述されました [71] [72] 主観的な改善をもたらすことでした。しかし、組織学的改善は記載されておらず、6人の患者のうち5人で骨粗鬆症が発生しました [72] 。追加の問題は、多くの患者がグルテンを含まない食事にゆっくりと反応しており、使用されている薬理学的治療ではないという事実です。 [62] 。
アザチオプリンは耐性セリアック病の治療にも使用されていましたが、副作用のために治療を中断する必要があることがよくありました [69] [七十三] [74] 。同時に、10人の患者のうち8人で組織学的改善が実証されました。クラドリビンも研究されました [75] [76] 、よりよく許容され、臨床的および組織学的な答えを引き起こす可能性があります。
他の薬物は、小患者のグループでも検査されました。アレムツズマブの使用が評価されました [77] [60] 、インスピレーション [78] [79] [80] [81] [60] Methotreksatu [60] 、組換えIL-10 [82] 。組織病理学的イメージを改善することなく、臨床的改善が示されました [62] 。
新しい治療法に関する多方向研究にもかかわらず [83] 。新しい治療法の望ましい効果は、少量のグルテンを消費することを可能にすることです。 [83] 。
- Prolylyendopeptydaza – それは微生物と植物の酵素です。酵素はグルテン – リッチグルテンを小さなペプチドに分割し、腸の酵素で消化できます。この薬の使用の結果としての吸収症候群の重症度の減少が見つかりました [84] [85] 。しかし、酵素は、食物酵素の3時間の必要なインキュベーションにより、限られた臨床的適合性を示しています [八十六] 。
- ALV003 – グルテンを広げることができる2つのグルタミン、酵素の混合物です [八十七] 。無作為化研究では、ALV003は症状を緩和しませんが、プラセボと比較して腸粘膜損傷の減少につながる可能性があります。 [八十七] 。
- lactobacillus – 発酵の結果としての細菌は、グルテン溶解につながり、その免疫原性を低下させる可能性があります [88] [89] 。
- VSL – それは細菌を含むプロバイオティクスです ビフィドバクテリア 、 lactobacillus と Streptococcus salivarius 。食品産業の小麦粉の事前処理に使用して、グルテン製品を入手することができます [90] 。
- ララゾチド – 毒素からの合成ヘキサペプチドです Vibrio cholerae 。それは、病理学的プロセスで上皮の細胞間の厳密なつながりを閉じるために使用され、したがってグリャジンの吸収を阻害する [91] 。この治療戦略は他の薬と組み合わせる必要があります [85] 。プラセボと比較して有意な違いはありませんでした [92] 。
- 合成HEMA-CO-SSポリマー – グリアジンと複合体を形成し、腸上皮への影響を減らします。グリジンに対する消化酵素の有効性の劣化により、より免疫原性ペプチドの形成を減少させる [93] [九十四] 。臨床試験を実施する前に、さらなる研究が必要です [62] 。
- 経口抗クラール – それは受動的免疫療法の一形態であり、消化管におけるグリャジンの中和とその吸収を防ぐための代替手段となる可能性があります。キャスト卵黄抗体が使用されます。これは、卵黄から比較的簡単かつ経済的に入手できます。抗体を与えられたマウスは、グルテンの吸収を最小限に抑えました [95] 。
- 組織トランスグルタミナーゼの選択的ブロッキング – グルテン摂取によって引き起こされる炎症プロセスを阻害する有望な潜在的な方法です [85] 。
- 免疫療法 – セリアック病の病因では、グルテンに対する誤った免疫応答が重要な役割を果たします。これは、グルテンに対する免疫耐性を引き起こすことを目的とした免疫療法を作成するための理論的基礎です。 [85] 。
- 免疫応答の修正 – 抗原提示(HLAブローカー)をブロックし、インターロイキン(IL-10、IL-15)をブロックし、NKG2D受容体のブロックをブロックすることにより、回答を修正する存在 [85] 。
内臓病の予防 [ 編集 | コードを編集します ]
多くの研究の結果は、母乳育児中にグルテンを徐々に導入すると、内臓疾患を発症するリスクが低下することが証明されています。 [96] [97] [98] [99] 。生後3か月間に食事にグルテンを導入すると、4〜6か月の年齢での導入と比較して、セリアック病を発症するリスクが5回増加します。 [99] 。グルテンも生後7ヶ月後に避けるべきです [96] 。 New Baby Nutrition Schemesによると [13] [100] [101] 。曝露用量は、100 mlの食事あたり2〜3グラム(セモリナなど)でなければならず、今後2か月で4〜6グラムに増加します。
セリアック病は、他のグルテン障害と同様に、カトリック教会の教義によれば、小麦でなければならないコミュニケーターなどのいくつかの宗教的慣行の成就を妨げる可能性があります。セリアック病の忠実な患者の場合、特別な低ガールフレンドのホストが提供されます(ワインの形でのみ聖体拝領を受けることも許可されています) [102] 。

セリアック病が発見され、1950年にウィルヘルム・カレル・ディックによって最初に記述されました。このオランダの小児科医は、一部の子供がパンを与えられた後に特異な症状がないことに気づきました。 [103] 。それは、1945年2月にスウェーデンの赤十字がオランダの空腹の空腹の冬のために編成されたパンに小麦粉の供給に関連していました [104] 。 1952年に症状の原因はグルテンであることが示されました [7] [105] 。内臓病における腸絨毛の萎縮は、1954年にイギリスの医師ジョン・W・ポールリーによって記述されました [7] 。病気の遺伝性は1965年に証明されました [7] 。 1966年、ヘルペス皮膚炎はグルテンに対する過敏症と組み合わされました [7] [106] 。 1983年、ポーランドの学者Tadeusz Chorzelskiが病気の免疫マーカーを最初に説明し、セリアック病の自己免疫塩基を証明しました [43] 。
セリアック病が発見される前、1950年には、この病気の症状と同様の病気の症状の言及がありました。西暦第1世紀と2世紀の変わり目ギリシャのドクターカッパドキアのドクター「キリアコス」という名前の下で(ギリシャ語から コイリア – 腹部)慢性下痢を伴う栄養失調の症候群を説明しましたが、症状は内臓疾患と一致しますが、それらの発生は一般的に飢えを伴いました [107] [108] 。 1888年、英国の小児科医であるサミュエル・ジーは、「セリアックの愛情」の研究で、症状が脂肪下痢、腹水、水様、破壊、成長の阻害である疾患症候群の症例を説明しました。 [103] 。ジーは彼の患者を食事で治療し、そこから多くの製品を排除し、パンの消費を制限しました。一部の患者では、記述された症状の原因が異なる可能性があるため、一部の患者でのみ改善されました(セリアック病、膵臓癌、嚢胞性線維症を含む)。 1920年代には、SO -Calledバナナダイエット。 1924年、シドニー・ハースは、バナナベースの食事を使用して、当時知られていない消化器系を持つ8人の子供の効果的な治療について説明しました [107] [108] 。
- ↑ 診断基準を参照してください。抗体の存在は診断に必要です。
- ↑ この場合、セリアック病の診断の場合のように、抗体の存在は認識するために必要ではないことに注意してください。
- ↑ いくつかのタイプの情報源によると、Eatlリンパ腫の進行はありません。
- ↑ a b c d そうです f g h Jusby S.、Coletzko S.、Corpony-SzabóI.R.、Mearin M.L.、Phillips A.、Shamir R.、Troncone R.、Gierseen K.、Branski D.、Catassi C.、Lelelgeman M.、MäkiM。 欧州小児胃腸科、肝臓病学、セリアック病の診断のための栄養ガイドライン 。 „ J Pediatr Gastroenterol Nutr。」、2012-04。 doi: 10.1097/mpg.0b013e31821a23d0 。 PMID: 2197856 。 [アクセス2014-03-27]。 [アーカイブ 住所 2014-10-31]。
- ↑ a b c d そうです f g h 私 j k l m n o p Q r s t の の の バツ と FranciszekIwańczak(編): 子供の消化器科。選択された問題 。ワルシャワ:ボルギス、2003年、pp。142–157。 ISBN 83-85284-40-0-0 。
- ↑ a b c d そうです f 牛C. セリアック病の食事ガイドラインと実装 。 「胃腸科」、2005-04。 PMID: 15825119 。
- ↑ あなたに地震があります。You.ll。 成人セリアック病におけるオート麦の毒性の欠如 。 „ BMJ(Clinical Research ed。)」。 7068(313)、s。 1300–1301、Listopad1996。PMID: 8942690 。
- ↑ Holm K.、MäkiM.、Vuolteenaho N.、Mustalahti K.、Ashorn M.、Ruuska T.、Kaukinen K. 小児期のセリアック病の治療におけるオート麦:2年間の対照試験と長期臨床フォローアップ研究 。 「高化薬理学と治療法」。 10(23)、s。 1463–1472、Maj2006。Doi: 10.1111/j.1365-2036.2006.02908.x 。 PMID: 16669961 。
- ↑ a b c d そうです f g h 私 j k J. はい 私はイニ 、 セリアック病 [アクセス2014-03-25] [アーカイブ 住所 2009-01-23] 。
- ↑ a b c d そうです f Detlef Schuppan、Melinda D. Dennis、Ciaran P. Kelly。 セリアック病:疫学、病因、診断、栄養管理 。 „ Nutr Clin Care。」、2005-04。 PMID: 16013224 。
- ↑ a b Alessio Fasano、Irene Berti、Tania gerarduzzi、Tarcisio not I Inni。 米国のリスクのあるリスクのないリスクのないグループにおけるセリアック病の有病率 。 「内科のアーカイブ」。 163(3)、s。 286、2003-02-10。アメリカ医師会(AMA)。 doi: 10.1001/archinte.163.3.286 。 ISSN 0003-9926 。 ( 。 )) 。
- ↑ Tではない、K Horvath、Id Hill、J Partanen I Inni。 米国のセリアック病のリスク:健康な献血者における抗エンドミシウム抗体の高い有病率。 。 「スカンジナビア胃腸科学ジャーナル」。 33(5)、s。 494–8、1998。 ISSN 0036-5521 。 PMID: 9648988 。 ( 。 )) 。
- ↑ S. Lohi、K。Mustalahti、K。Kaukinen、K。Laurila、P。Collin、H。Rissanen、O。Lohi、E。Bravi、M。Gasparin、A。Reunanen、M。Mäki。 時間の経過とともにセリアック病の有病率の増加 。 「Alimentary Pharmacology&Therapeutics」、2007-10。 doi: 0.1111/j.1365-2036.2007.03502.x 。
- ↑ a b c d そうです f g h 私 j Hanna Szajewska、Piotr Dziechciarz、Anna Chmielewska: 専門家に尋ねてください。セリアック病 。 [アクセス2014-03-24]。
- ↑ a b Anna Szaflarska-Popławska、Krystyna Karczewska、Alicja abka、ewa„ rycharska、MieczysławCzerwionka-Szaflarska、Piotor Albrecht、Jacek Brengda Ja-Bulsa、Adam Daukszewicz、AgnieszkaGawrońska、Ewa Hapyn、BarbaraIwańczak、Franciszek、Mon ka Jakubik、Eljbieta Jarocka-Cyrta、Janjózefczuk、bojenakzak、ewa kochaszzak、ewa kochaszzak、 Ki、MałgorzataMokrzycka、Agnieszka Mroczkowska-Juchkiewicz、Beata olelewska、Andrzej Radzikowski、Wanda Reyman、Edyta Sienkiewicz、KamilaSkóra、Jadwiga Szymanowiga symanowiga symawiga asymawigz、agamawigaアンドラ・ザレフスカ、ジャドウィガ・ザウスカ。 ポーランドのセリアック病 – マルチサイズの研究 。 「小児科の現代の胃腸科、肝臓学、子供の栄養。」 11、2009。[アクセス2014-03-24]。
- ↑ a b c d そうです f g h Edyta Santorek-Struumiło: セリアシア 。 [アクセス2014-03-23]。
- ↑ Troncone R.、Greco L.、Mayer M.、Mazzarella G.、Maiuri L.、Coenis M.、Frau F.、Virgiliis S.、Auricchio S. セリアック語の子供の兄弟では、直腸グルテンチャレンジは、セリアックHLAに限定されていないグルテン感作を明らかにしています 。 「消化器科」、1996-08。 PMID: 8690196 。
- ↑ a b c d そうです f g h 私 j k l m n Aleksandra Bartosik。 セリアック病 – 地面、症状、診断、治療 。 「Nutrilifeのジャーナル」。 10、2013-10-14。 ISSN 2300-8938 。 ( pol。 )) 。
- ↑ a b c Mager D.R.、Qiao J.、Turner J. ビタミンDおよびKの状態は、セリアック病の小児および青年の骨ミネラル密度と骨の発生に影響を与えます 。 「Eur J Clin Nutr。」、2012年4月。PMID: 21970944 。
- ↑ a b c d そうです f g h 私 j k l m n o p Q r s t BarbaraIwańczak、Franciszek Iwanczak。 小児および青年の内臓疾患の診断と治療のための新しいガイドライン 。 「przegląd胃腸科」、pp。185–191、2012。 10.5114/pg.2012.30500 。 [アクセス2014-03-23]。
- ↑ Van Heel D.A.、West J. セリアック病の最近の進歩 。 “腸”。 7(55)、pp。1037–1046、2006年7月。Doi: 10.1136/gut.2005.075119 。 PMID: 16766754 。
- ↑ Selva-O’Callaghan A.、Casellas F.、De Torres I.、Palou E.、Grau-Junyent J.M.、Vilardell-TarrésM。 炎症性ミオパシー患者のセリアック病およびセリアック病に関連する抗体 。 「筋肉神経。」、2007-01。 PMID: 16967485 。
- ↑ a b c ジェシカ・R・ジャクソン、ウィリアム・W・イートン、ニコラ・G・カスケラ、アレッシオ・ファサノ、ディアナ・L・ケリー。 セリアック病およびグルテン感受性の神経学的および精神医学的症状 。 「精神科医Q.」、2012-03。 doi: 10.1007/s11126-011-9186-y 。 PMID: 21877216 。 PMCID: PMC3641836 。
- ↑ Lachance L.R.、McKenzie K. 非感情精神病患者のグルテン感受性のバイオマーカー:メタ分析。 。 „ Schizophr res。」、2014-01。 PMID: 24368154 。
- ↑ 神経精神障害として存在するグルテン感受性 。 „ Gastroenterol Res Pract。」、2014年。PMID: 24693281 。
- ↑ Czerwionka-Szaflarska M. ポーランドの内臓病の変化するイメージ 科学24.com 。
- ↑ a b c d Tersigni C.、Castellani R.、De Waure C.、Fattorossi A.、De Spirito M.、Gasbarrini A.、Exchanges G.、Simone N. セリアック病および生殖障害:疫学的関連と潜在的な病原性メカニズムのメタ分析 。 „ Hum Reprod Update。」、2014-03-11。 PMID: 24619876 。
- ↑ ターンu。、vincatio。SelliC.、Felli C.、Silano M. セリアック病患者の結腸癌のリスクが低い 。 „ Scand J Gastroenterol。」、2014-03-13。 PMID: 24621303 。
- ↑ a b Krystyna Kubicka、Wanda Kawalec: 小児科 。ワルシャワ:PZWL Medical Publishing House、2008。ISBN 978-83-200-3786-9 。
- ↑ プロラミニー 、 [の:] PWN百科事典 [オンライン] [アクセス2014-03-23] 。
- ↑ a b Lammers Km。、LuR。、Brownley J.、Lu B.、Gerard C.、Thomas K.、Rallabhandi P.、Shea-Donohue T.、Tamiz A.、Alkan S.、Netzel-Arnett S.、Antalis T.、Vocel S.N.、Fasano A. グリアジンは、ケモカイン受容体CXCR3に結合することにより、腸の透過性とゾンリン放出の増加を誘発します。 。 「消化器科」、2008-07。 doi: 10.1053/j.gastro.2008.03.023 。 PMID: 18485912 。
- ↑ a b ナイヤナ・グジャル、ヒュー・J・フリーマン、アランB.R.トムソン。 セリアック病:有病率、診断、病因、治療 。 「ワールドJガストロエントロール」。 doi: 10.3748/wjg.v18.i42.6036 。 PMID: 23155333 。 PMCID: PMC3496881 。
- ↑ Skovbjerg H.、NorénO.、Anthonsen D.、Moller J.、SjöströmH。 グリアジンはいくつかのトランスグルタミナーゼの良好な基質です。セリアック病の病因における影響の可能性 。 „ Scand J Gastroenterol。」、2002。PMID: 12190095 。
- ↑ Van Heel D.A.、West J. セリアック病の最近の進歩 。 「いいね。」、2006-07。 PMID: 16766754 。
- ↑ Fleckenstein B.、MolbergØ。、Qiao S.W.、Schmid D.G.、Von DerMülbeF.、ElgstøenK.、Jung G.、Sollid L.M. セリアック病における組織トランスグルタミナーゼによるグリアジンT細胞エピトープ選択。酵素特異性の役割と、皮膚形成と分離プロセスに対するpHの影響 。 „ J Biol Chem。」、2002-11。 doi: 10.1074/jbc.m204521200 。 PMID: 12093810 。
- ↑ Mowat A.M. セリアック病 – 遺伝学、免疫学、タンパク質化学のための出会い 。 「ランセット」、2003-04。 PMID: 12699968 。
- ↑ ロタウイルス感染頻度と幼児期のセリアック病の自己免疫のリスク:縦断的研究。 Am J Gastroenterol。 2006年10月; 101(10):2333-40 。 lib.bioinfo.pl。 [アーカイブ このアドレス (2007-11-17)]。 。
- ↑ a b Hadithi M.、Von Blomberg B.M.、Crusius J.B.、Bloemena E.、Kostense P.J.、Meijer J.W.、Mulder C.J.、Stehouwer C.D.、PeñaA.S。 セリアック病の診断のための血清学的検査とHLA-DQタイピングの精度 。 「内部的にアン」。 9月4日; 147。 5、pp。294–302、2007。PMMO: 17785484 。
- ↑ Koskinen L.L.、Einarsdottir E.、Korponay-Szabo I.R.、Kurppa K.、Kaukinen K.、Sistonen P.、Pocsai Z.、SzélesG.、AdányR.、MäkiM。、Kere J.、Painlainen P. フィンランドとハンガリーの人々における染色体5Q31-Q33上のセリアック2遺伝子座の細かいマッピング 。 「組織抗原」、2009-11。 PMID: 19845895 。
- ↑ a b c ソニア・S・クッパー、バナ・ジャブリ。 セリアック病の病態生理学 。 „胃腸内索Clin n Am。」、2012-10。 doi: 10.1016/j.giec.2012.07.003 。 PMID: 23083984 。 PMCID: PMC3872820 。
- ↑ チュ・ヨン・キム、ハンドル・クォート、エリン・ブレスゲンズ、チャイタン・コスラ、ルーディグ・M・シャリス。 セリアック病におけるグルテンエピトープのHLA-DQ2を介した症状の構造的基礎 。 „ Proc Natl Acad Sci U S A”、2004-03-24。 doi: 10.1073/pnas.0306885101 。 PMID: 15020763 。 PMCID: PMC384714 。
- ↑ Jores R.D.、Frau F.、Cucca F.、Grazia Clemente M.、OrrùS。、Rais M.、Virgiliis S.、Coencia M. HLA-DQB1*0201ホモ接合体は、セリアック病の重度の腸損傷の素因となります 。 「ランセット」、2003-04。 PMID: 12699968 。
- ↑ a b Anderson R.P.、Henry M.J.、Taylor R.、Duncan E.L.、Danoy P.、Costa M.J.、Addison K.、Tye-Din J.A.、Kotowicz M.A.、Knight R.E.、Pollock W.、Nicholson G.C.、Toh B.H.、Brown M.A.、Pasco J.A. 新しい血清遺伝学的アプローチは、セリアック病のコミュニティの有病率を決定し、診断経路の改善を通知します 。 „ BMC Med。」、2013-08。 PMID: 23981538 。 PMCID: PMC3765645 。
- ↑ a b Povi a。、Araranz e。、Fernandez-Arquero M.、Collin P.、MäkiM.、Sanz A.、Calvo c。、Thunders c。、Westman P.、Concha E.G.、Partanen J。 フィンランドとスペインのHLA-DQ2陰性セリアック病 。 „ Hum Immunol。」、1998-03。 PMID: 9548076 。
- ↑ a b Chorzelski T.P.、Suul J.、Tchorzewska H.、Jablonska S.、Beutner E.H.、Kumar V. Herpetiformis皮膚炎およびセリアック病におけるIGAクラスの子宮内膜抗体。 。 „ Ann n y Acad Sci。」、1983年。PMID: 6586098 。
- ↑ Walewski P. 耳なしで噛む 、「Polityka」No。34(2618)の2007年8月25日、pp。76–77。
- ↑ a b c d そうです Andrzej Szczeklik(編): 内疾患 。 Krakow:Medycyna Practical Publishing House、2010。ISBN 978-83-7430-216-6 。
- ↑ として。 Abdulkarim、J.A。マレー。 レビュー記事:セリアック病の診断 。 „ Alient Pharmacol Ther。」、2003-04。 doi: 10.1046/j.1365-2036.2003.01442.x 。 PMID: 12694080 。
- ↑ カミルがもたらす。 セリアック病 – 第3ミレニアムの挑戦 。 “常備薬”。
- ↑ a b StröhleA。、Wolters M.、Hahn A. セリアック病 – 食物不耐性の中でカメレオン 。 「Med Monthly Pharm。」、2013-10。 PMID: 24266248 。
- ↑ 彼はA.K.、Thomas A.G.に電話します。 系統的レビュー:セリアック病の人のためのグルテンの許容量の量 。 „ Alient Pharmacol Ther。」、2008年。Doi: 10.1111/j.1365-2036.2008.03669.x。 。 PMID: 18315587 。
- ↑ Jerzy Kruszewski。 セリアック病。病因から治療まで 。 “アレルギー”。 1/8、2001。調和学的出版社「健康」。 urszulasamolińska-zawisza。 ISSN 1641-5728 。 [アーカイブ 住所 ]。
- ↑ Janeczko C.E.、Sweeney K.、Connaghan G. 補足的なビタミンKは、セリアック病に続発するビタミンKの低組織貯蔵の低い患者の抗凝固の安定性を改善する 。 「BMJケース担当者」。 PMID: 21686472 。
- ↑ Szajewska H。; 2005年の胃腸科と子供の栄養学の進歩 。実用的な薬 。
- ↑ Tadataka Yamada: 消化器科ハンドブック 。 Lublin:Czelej Publishing House、2006、p。378。ISBN 978-83-89309-92-1 。
- ↑ 委員会規制(EC)2009年1月20日の41/2009の人々は、グルテン耐性の人々に適した食品の組成とラベル付けに関して 。欧州連合の公式ジャーナル、2009-01-20。 [アクセス2012-11-27]。 ( pol。 )) 。
- ↑ グルテンフリーとは何ですか? FDAには答えがあります 、 食品医薬品局 [アクセス2014-04-03] 。
- ↑ a b c d そうです f g h Ludvigsson J.F.、Leffler D.A.、Bai J.C.、Life f。、Fasano a。、Green P.H.、Hadjivassiliou m。、馴染みのあるK.P.、Keukenen C.P.、Leonard J.N.、Lundin K.E. セリアック病および関連用語のオスロ定義 。 「グッド」、2013-01。 doi: 0.1136/gutjnl-2011-301346。 。 PMID: 22345659 。 PMCID: PMC3440559 。
- ↑ アンナ・シュミエルウェスカ、ピオトル・ディエチェチアルツ、ドロタ・ギエルス・ビアウク、アンドレア・ホルヴァス、ゾフィア・コナルスカ、ベルナデタ・パトロ、マウゴルザタ・ピエシック・レック、マレク・ラシュチェスキ、そしてハンナ・スジエフスカ。 2012年の子供の栄養と選択された胃腸疾患の進歩 。 「実用的な薬。小児科」、2013-03。実用的な薬。 [アクセス2014-04-05]。
- ↑ a b Grajyna Rowicka。 セリアック病の非定型形態 – 診断の難しさ 。 「発達期間医学(発達時代の医学)」。 2、pp。124-127、2012。母と子の研究所。 Aluna Publishing House。 ( pol。 )) 。
- ↑ A.ルビオタピア、J.A。マレー。 難治性セリアック病の分類と管理。 。 “良い”。 59(4)、p。547–557、2010年4月。Doi: 10.1136/gut.2009.195131 。 PMID: 20332526 。
- ↑ a b c d そうです f g Malamut G、Afchain P.、Verkarre V.、Lecomte T.、Amiot A.、Damotte D.、Bouhnik Y.、Colombel J.F.、Delchier J.C.、Come On M.、Cosnes J.、Lavergne B.、Meresse B.、Trinquart L.、Macintyre E. 難治性セリアック病のプレゼンテーションと長期フォローアップ:I型とタイプIIの比較。 。 「消化器科」、2009-01。 PMID: 19014942 。
- ↑ a b W.H. Verbeek、M.S。ゴレス、B.M。 Von Blomberg、J.J。 Oudejans I Inni。 異常な上皮内リンパ球のフローサイトメトリー測定は、難治性セリアック病におけるT細胞クローン性分析よりもT細胞リンパ腫の発達をより正確に予測します。 。 「クリンイムノール」。 126(1)、s。 48–56、2008年1月。doi: 10.1016/j.clim。2007.09.002 。 PMID: 18024205 。
- ↑ a b c d そうです f g h 私 j k l m n o p Q ウッドワードJ. 難治性セリアック病の管理 。 „ Ther Adv Chronic Dis。」、2013-03。 PMID: 23556127 。 PMCID: PMC3610261 。
- ↑ a b デビッド・H・デワール、スザンヌ・C・ドネリー、サイモン・D・マクラフリン、マシュー・W・ジョンソン、H。ジュリア・エリス、ポール・J・シクリティラ。 セリアック病:グルテンを含まない食事をしている患者の持続的な症状の管理 。 „ World J Gastroenterol。」、2012-03。 doi: 10.3748/wjg.v18.i12.1348 。 PMCID: PM33319961 。
- ↑ a b E. Bagdi、T.C。 Diss、P。Munson、P.G。アイザクソン。 腸症に関連したT細胞リンパ腫、潰瘍性セイジュン炎、および難治性セリアック病における粘膜内上皮リンパ球球球は、新生物集団を構成します。 。 “血”。 94(1)、s。 260–264、1999年7月。PMID: 10381521 。
- ↑ C.パティ、nl。マウビブ人はあなたの中にいます。 難治性スプルーの異常な腸上皮内リンパ球。 。 「消化器科」。 114(3)、s。 471–481、1998年3月。PMID: 9496937 。
- ↑ G.C. Alfsen、K。Beiske、H。Bell、P.F。マートン。 併用性腸症腸症に関連するT細胞リンパ腫を伴う上皮内Tリンパ球の低グレード腸リンパ腫:組織遺伝学的関係の可能性を示唆する症例報告。 。 「ハムパトル」。 20(9)、s。 909–913、1989年9月。PMID: 2789173 。
- ↑ C. Cellier、E。Delabesse、C。Helmer、N。Pocy1 Inni。 難治性スプルー、セリアック病、腸症に関連するT細胞リンパ腫。フランスのセリアック病研究グループ。 。 「ランセット」。 356(9225)、s。 203–208、2000年7月。PMID: 10963198 。
- ↑ N. Patey-Mariaud de Serre、C。Cellier、B。Jabri、E。DelabesseIInni。 セリアック病と難治性のスプルーの区別:単純な免疫組織化学的方法。 。 「組織病理学」。 37(1)、s。 70–77、2000年7月。PMID: 10931221 。
- ↑ a b Enns R.、Lay T.、Bridges R. 非末頭腫瘍性潰瘍性セジュノイル炎のためのアザチオプリンの使用 。 „ Can J Gastroenterol。」、2009-09。 PMID: 9347165 。
- ↑ A.アルトマ、W.H.M。 Verbeek、M。Hadithi、B.M.E。 Von Blomberg、C.J.J。モルダー。 難治性セリアック病および腸症に関連するT細胞リンパ腫における生存:単一中心の経験の遡及的評価 。 「いいね。」、2007-10。 doi: 10.1136/gut.2006.114512 。 PMID: 17470479 。 PMCID: PMC2000250 。
- ↑ Brar P.、Lee S.、Lewis S.、Egbuna I.、Bhagat G.、Green P.H. 耐火性セリアック病の治療におけるブデソニド 。 „ Am J Gastroenterol。」、2007-10。 PMID: 17581265 。
- ↑ a b Daum S.、Ipczynski R.、Heine B.、Schulzke J.D.、Zeitz M.、Ullrich R. 難治性スプルー患者のブデソニドによる治療 。 「消化。」、2006年。PMID: 16612091 。
- ↑ Vaida A.、Bolanos J.、Berkemmer C. 難治性スプルー中のアザチオプリン。 。 „ Am J Gastroenterol。」、1999-06。 PMID: 10406270 。
- ↑ Wahab P.J.、Crusius J.B.、Meijer J.W.、Uil J.J.、Mulder C.J. 難治性セリアック病の成人の治療におけるシクロスポリン – オープンパイロット研究 。 „ Alient Pharmacol Ther。」、2000-01。 PMID: 10848661 。
- ↑ Tack G.J.、Verbeek W.H.、Al-Toma A.、Kuik D.J.、Schreurs M.W.、Visser O.、Mulder C.J. 難治性セリアック病タイプIIにおけるクラドリビン治療の評価 。 „ World J Gastroenterol。」、2011 = 01。 PMID: 21274381 。
- ↑ Al-Toma A.、Goerres M.S.、Meijer J.W.、Von Blomberg B.M.、Wahab P.J.、Kerckhaert J.A.、Mulder C.J. 異常なT細胞を伴う難治性セリアック病におけるクラドリビン療法 。 „ Clin Gastroenterol Hepatol。」、2006-11。 PMID: 16979946 。
- ↑ Vivas S.、Ruiz de Morales J.M.、Ramos F.、Suárez-Vilela D. 腸症に関連するT細胞リンパ腫のリスクがある患者における難治性セリアック病のためのアレムツズマブ 。 「N Engl J Med。」、2006-06。 PMID: 16760460 。
- ↑ Turner S.M.、Moorghen M、Probert C、s。 難治性セリアック病:インフリキシマブおよび免疫調節剤による寛解 。 „ Eur J Gastroenterol Hepatol。」、2005-06。 PMID: 15879730 。
- ↑ Chaudhary R.、Ghosh S. 難治性セリアック病のインフリキシマブ 。 „ Eur J Gastroenterol Hepatol。」、2005-06。 PMID: 15879720 。
- ↑ Schmidt C.、Kasim E.、Sights W.、Rads G.、Gipes T.、Stallmach A. 難治性コラゲンスプルーにおけるTNF-alpha抗体治療:症例の報告と文献のレビュー 。 „ Zガストロエントロール。 2009-01”、2009年。PMID: 19533547 。
- ↑ Costantino G.、Torre A.、Lo Presti M.A.、Caruso R.、Mazzon E.、Fries W. 長期インフリキシマブによる生命を脅かすタイプI耐衝撃性セリアック病の治療 。 「Liver Dis。」、2008-01。 PMID: 17382609 。
- ↑ Mulder C.J.、Wahab P.J.、Meijer J.W.、Bricklayer E. 難治性セリアック病の成人における組換えヒトインターロイキン-10のパイロット研究 。 „ Eur J Gastroenterol Hepatol。」、2001-10。 PMID: 11711774 。
- ↑ a b Pinier M.、Fuhrmann G.、Verdu E.F.、Leroux J.C. セリアック病の予防措置と探索的薬理学的治療 。 „ Am J Gastroenterol。」、2010-12。 PMID: 20877349 。
- ↑ G.G.パイル、B。パソ、B.E。アンダーソン、D.D。アレン私はイニ。 セリアックスプルーのグルテン誘発性吸収不良に対するプロリルエンドペプチダーゼによる食物グルテンの前処理の効果。 。 「Clin Gastroenterol Hepatol」。 3(7)、s。 687–694、2005年7月。PMID: 16206502 。
- ↑ a b c d そうです S.A.スキャンロン、J.A。マレー。 セリアック病に関する最新情報 – 病因、鑑別診断、薬物標的、および管理の進歩。 。 「Clin Exp Gastroenterol」。 4、s。 297–311、2011。doi: 10.2147 / legs.s8315 。 PMID: 22235174 。 PMCID: PMC3254208 。
- ↑ Matysiak-Budnik T.、Candalh C.、Cellerirer C.、Dagave C.、Namane A.、Vidal-Martinz T.、Cerf-Bensansan n。、Heyman M。 セリアック病におけるグリアジンペプチドの解毒におけるプロリルエンドペプチダーゼの効率が限られています 。 「消化器科。」、2009-09。 PMID: 16143118 。
- ↑ a b Tye-Din J.A.、Anderson R.P.、Ffrench R.A.、Brown G.J.、Hodsman P.、Siegel M.、Botwick W.、Shreeniwas R. in vivoでのセリアック病における免疫応答と症状に対するグルテンの事前消化のALV003の影響 。 「Clin Immunol。」、2010-03。 PMID: 19942485 。
- ↑ Greco L.、Gobbetti M.、Auricchio R.、Mase R.、Mase R.、Landolfo F.、Paparo F.、Paparo F.、Cagno R.、De Angelis M.、Rizzello C.G.、Cassone A.、Terrone G.、Timpone L.、D’Aniello M.、Maglio M.、Troncone R.、Auricchio S. 食品加工中に加水分解された小麦粉で作られた焼き菓子のセリアック病患者の安全 。 „ Clin Gastroenterol Hepatol。」、2011-01。 PMID: 20951830 。
- ↑ Cagno R.、De Angelis M.、Auricchio S.、Greco L.、Clarke C.、De Vincenzi M.、Giovannini C.、Archival M.、Landolfo F.、Parrilli G.、Minervini F.、Arendt E.、Gobbetti M. 小麦と非毒性の小麦粉から作られたサワードウのパンは、選択された乳酸菌で始まってセリアックスプルー患者で許容されます 。 „ Appl Environ Microbiol。」、2014-02。 PMID: 14766592 。
- ↑ De Angelis M.、Rizzello C.G.、Fasano A.、Clemente M.G.、De Simone C.、Silano M.、De Vincenzi M.、Losito I.、Gobbetti M. VSL#3プロバイオティクスの準備には、セリアックスプルーの原因となるグリアジンポリペプチドを加水分解する能力があります 。 „ Biochim Biophys Acta。」、2006-01。 PMID: 16311022 。
- ↑ Paterson B.M.、Lammers K.M.、Arrieta M.C.、Fasano A.、Meddings J.B. セリアック病の被験者におけるAT-1001の単一用量の安全性、耐性、薬物動態および薬力学的効果:概念実証研究 。 „ Alient Pharmacol Ther。」、2007-09。 PMID: 17697209 。
- ↑ C.P.ケリー、P.H.R。グリーン、J.A。マレー、A。ディマリーノ、A。コラトレラ、D.A。 Leffler、T。Alexander、R。Arensecu、F。Leon、J.G。江、L.A。 Arterburner、B.M。パターソン、R.N。フェドラック。 グルテンチャレンジを受けているセリアック病患者のアセテートララゾチド 。 「Pharmacol Ther。」、2013年。[アクセス2014-04-14]。
- ↑ Liang L.、Pinier M.、Leroux J.C.、M.に苦しんだ アルファ – グリアジンとポリ(HEMA-CO-SS)との相互作用:構造的特性と生物学的意味 。 「バイオポリマー。」、2009-02。 PMID: 18975377 。
- ↑ Liang L.、Pinier M.、Leroux J.C.、M.に苦しんだ アルファ – グリアジンとポリアニオンとの相互作用:セリアック病の支持治療に使用される隔離剤の設計上の考慮事項 。 「バイオポリマー。」、2010-05。 PMID: 19921745 。
- ↑ Gujral N.、LöbenbergR。、Suresh M.、Sunwoo H. 食物マトリックス中のグリアジンに対する鶏肉卵黄卵黄Y(IGY)のビトロおよび生体内結合活性 。 „ J Agric Food Chem。」、2012-03。 PMID: 22400905 。
- ↑ a b Agostoni C.、Decsi T.、Femontrell M.、Gouletk O.、Kolacek S.、Koetzko B.、Michaelsen K.F.、Moreno L.、Puntis J.、Rigo J.、Shamir R.、Szajewska H.、Turck D.、Van Goudoever J. 補完的な給餌:栄養に関するエスパガン委員会による解説 。 „ J Pediatr Gastroenterol Nutr。」、2008-01。 PMID: 18162844 。 [アクセス2014-04-04]。 [アーカイブ 住所 2015-04-17]。
- ↑ Ivarsson A.、Hernell O.、Stenlund H.、Persson L.A. 母乳育児はセリアック病から保護します 。 「Am J Clin Nutr。」、2002-05。 PMID: 11976167 。
- ↑ Annelie Carlsson1、Daniel Agardh、Stefan Borulf、Ewa Grodzinsky、Irene Axelsson、Sten-A。アイバーソン。 セリアック病の有病率:摂食勧告の全国的な変化の前後 。 「Scandinavian Journal of Gastroenterology」、2006年。PMID: 16638697 。
- ↑ a b Norris J.M.、Barriga k。、Hoffenberg E.J.、Taki i。、Miao D.、Haas J.E.、Emery L.M.、Soleg R.J.、Erlich H.A. セリアック病のリスク自己免疫とグルテンのタイミング疾患のリスクが高い乳児の食事における導入 。 「ジャマ」、2005-05。 PMID: 15900004 。
- ↑ 赤ちゃん栄養のための新しいガイドライン(2007):食事へのグルテンの以前の紹介 。 pulsmedycyny.com.pl、2007-06-04。 [アクセス2010-09-14]。 [アーカイブ このアドレス (2007-10-06)]。
- ↑ Szajewska H。: 2005年の胃腸科と子供の栄養学の進歩 。実用的な薬 。
- ↑ 神の崇拝と秘跡の規律の委員会kep: 聖体拝領の提供に関する新しいメモセリアック病患者 。 [の:] 典礼文書 [オンライン]。プウォックの教区。 [アクセス2014-04-25]。 [アーカイブ このアドレス (2014-04-27)]。 ( pol。 )) 。
- ↑ a b LosowskyMS。 セリアック病の歴史 。 「You Dis。」、2008年。PMID: 18431060 。
- ↑ G.P.もつ Berge-Henegouwen 、 C.J. モルダー 、 グルテンフリーダイエットのパイオニア:ウィレムカレルディック1905-1962、50年以上のグルテンフリーダイエット 、「腸」、34(11)、 1993年 、s。 1473–1475 、ISSN 0017-5749 、PMID: 8244125 、PMCID: PMC1374403 [アクセス2018-11-10] 。
- ↑ Anderson CM、French JM、Sammons HG、Frazer AC、Gerrard JW、Smelie JM。 セリアック病;胃腸の研究と食事小麦粉の効果 。 「ランセット」、1952-04-26。 PMID: 14918439 。
- ↑ Marks J.、Shuster S.、Watson A.J. 皮膚炎の小葉の変化 。 「ランセット」、1966-12。 PMID: 4163419 。
- ↑ a b セリアック病の歴史 。 [アクセス2014-03-23]。 [アーカイブ このアドレス (2014-01-25)]。
- ↑ a b ステファノ・グアンダリーニ。 セリアック病の短い歴史 。 「インパクト」、2007年。シカゴ大学セリアック病センター。
Recent Comments