代謝 – ウィキペディア、無料百科事典
代謝 (grから。 変化 ‘から変更する 後 「オーバー」、そして 沼地 「スロー」) – すべての生物学的現象の基礎である生細胞で発生する化学反応と関連するエネルギーの変化全体。これらのプロセスにより、セルは成長と再現、内部構造の管理、外部刺激に応答することができます。
代謝を構成する化学反応は、代謝ルートで組織されています。これらは、1つの反応(ここでは代謝物と呼ばれる)の産物が別の反応の基質として使用される反応のランクであり、酵素は通常これらの変換に関与します。酵素は、熱力学的に不利であるため、実際には参加せずに起こらなかった反応を実行することができます。彼らの作用は、活性化のエネルギーを低下させ、反応速度を増加させ、エネルギーを引き起こす自発的な反応と結合することです(熱力学的に好ましい)。酵素を使用すると、細胞内の条件の変化または細胞外からの信号の変化に応じて代謝ルートを調整できます。
代謝ルートは、生物学的に有用な形でエネルギー生産を伴う化学物質を変換することと、エネルギー供給を必要とする2つの大きなクラスに分けることができます。 [初め] 。それらの最初のものは、有機化合物がエネルギーに変換されるエクソレジー反応であるため、異化反応またはより一般的に異化と呼ばれます。 2番目は、エンドエネルギー反応であり、つまり、グルコース、脂質、タンパク質の作成などのエネルギー供給を必要とするものですが、アナボリック反応または同化と呼ばれます。 [初め] [2] 。
特定の身体の遺伝的に条件付けられた代謝の可能性は、特定の物質を「有用」または「役に立たない」(または「有毒」)、その使用と処理として適格にすることを決定します。たとえば、いくつかの原核生物(例:属の細菌 Beggiato )硫化水素をエネルギー源として使用して、代謝ルートに含まれるが、動物の場合、このガスは有毒です [3] (h 2 Sはシトクロムオキシダーゼをブロックします [4] )。しかし、代謝のペースは、特定の身体の適切な機能に必要な食物の量に影響します。
代謝ルートは、非常に遠い親族を持つ種でさえ大きな類似性を示しています。たとえば、機能が同一であり、構造が非常に類似している酵素のセットは、クエン酸のサイクルに関与していることは、バクテリアに両方で見つけることができます。 大腸菌 多細胞生物と同様に [5] 。代謝軌跡のこの汎用性は、おそらくその高性能の結果であり、したがって、それらをサポートするための既存の肯定的な進化的圧力と、進化の生活史の初期の出現の結果である [6] [7] 。

動物、植物、その他の生物の体を形成するほとんどの構造は、アミノ酸、炭水化物、脂質の3つの基本的なタイプの化合物で作られています。塩基性化合物(たとえば、アミノ酸)を凝縮ポリマーに結合し、上記の組織化された分子(タンパク質など)を作成できます。凝縮ポリマーも核酸ですが、それらを構築する分子 – ヌクレオチドはいくつかのより単純な化合物で構成されています。上記のタイプの関係は、生命に必要であるため、同化プロセスでは、体はその細胞の構築中の合成に対処し、食物の場合は、より複雑な分解の分布によって異化したエネルギーの分布と使用、またはより単純な化合物を獲得します。これらの高分子は、あらゆる生物の成分です。それらのいくつかは、下の表に示されています。
アミノ酸とタンパク質 [ 編集 | コードを編集します ]
タンパク質はアミノ酸で作られており、ペプチド結合によって直線的に接続されています。多くのタンパク質は、代謝の化学反応を触媒する酵素です。他のものは構造的および機械的機能を持っています。たとえば、細胞の形状を調整する細胞骨格を構築します。 [8] 。また、モバイルシグナル伝達、免疫応答、細胞接着、膜による積極的な輸送、細胞周期などのプロセスの重要な要素でもあります。 [9] 。ほとんどの細胞プロセスのコースは、タンパク質によって規制されています。
脂質 [ 編集 | コードを編集します ]
脂質は、生化学物質の非常に多様なグループです。それらは、有機溶媒(たとえば、ベンゼンまたはクロロホルム)に可溶な生物学的重要性の疎水性または両性症状の分子として定義されています。 [十] 。脂質(主にリン脂質で)は生物膜を構築し、エネルギー貯蔵化合物の1つです [9] 。スペア化合物を構成する脂質のグループは、脂肪の名前によって慣習的に決定され、脂肪酸とグリセロールで作られています。グリセロール分子は、3つの脂肪酸分子と組み合わせることができます [11] 。実際には、たとえばリン脂質のリン酸塩などの追加の関数グループを含む、この基本構造にはいくつかのバージョンがあります。含まれる別のクラスの脂質コレステロールまたはエストロゲンはステロイドであり、これは細胞によって生成される別の大きな脂質のグループです [12番目] 。
炭水化物 [ 編集 | コードを編集します ]

炭水化物は、多くのヒドロキシル基に置き換えられ、線形または環の形で発生する不快なケトンまたはアルデヒドです。それらは最も広範囲にわたる有機物質に属し、生物の多くの機能を果たします。エネルギー貯蔵および輸送(澱粉とグリコーゲン)、細胞構造の構造(植物のセルロース、動物のキチン) [9] 。ガラクトース、フルクトース、最も人気のあるグルコースなどの塩基性炭水化物モノマーは、単糖と呼ばれます。彼らは非常に多くの方法で互いにつながり、多糖類を作成することができます [13] 。
ヌクレオチド [ 編集 | コードを編集します ]
DNAとRNAと呼ばれる凝縮ポリマーは、ヌクレオチドで作られた長い鎖です。これらの分子は、転写プロセスとタンパク質生合成のおかげで、遺伝情報の保存と使用に必要です [9] 。この情報は、DNA修復メカニズムによって保護され、複製プロセスで複製されます。ほとんどの生物の遺伝子はDNA分子の形で書かれていますが、レトロウイルスと呼ばれるいくつかのウイルスは、RNA糸に遺伝情報を保存します。レトロウイルスの例は、逆転写酵素酵素を使用してRNAゲノムからDNAのコピーを作成するHIVウイルスです。 [14] 。 RNAは、酵素と同様に、触媒特性を有する可能性があり、その後、スプライセソームまたはリボソームの一部であるRyboszeと呼ばれます。個々のヌクレオシドは、リボース糖を右の不循環原理に付着させるときに形成されます。これらのルールは、プリンとピリミンと呼ばれる化合物です。 RNAビルディングヌクレオチドには、アデニン(A)、ウラシル(U)、シトシン(C)、グアニン(G)が含まれます。 DNA分子では、ウラシルの代わりにチミンがあります-T。 [15] 。
コエンザイム [ 編集 | コードを編集します ]

代謝はさまざまなタイプの反応で構成されていますが、それらのほとんどは、伝染する機能グループのタイプのためにいくつかの基本グループに分類できます [16] 。これにより、細胞はこれらのグループをさまざまな化合物の間で移動させる原因となる代謝の適切な要素を発達させることができました [15] 。それらはコエンザイムと呼ばれます。各タイプの酵素反応はコエンザイムに割り当てられます。細胞はそれらを作成するプロセスを継続的に継続しているので、しばらくするとそれらは分解され、適切な酵素によって再利用されます [17] 。
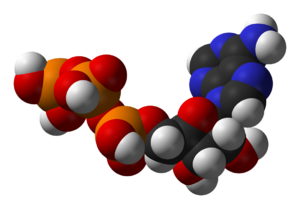
コエンザイムの例は、細胞内の主要な化学エネルギー担体であるアデノサ-5′-Trans(ATP)です(いくつかの反応に加えて、このタスクは類似のヌクレオチド:GTP、UTP、CTPで満たされています)。このヌクレオチドは、個々の反応間で化学エネルギーを伝達するために使用されます。細胞には比較的少量のATPが含まれていますが、この化合物の埋蔵量は絶えず更新されているため、人体は日中の体の重量に対応するATPの量を使用します。 [17] 。 ATPは、異化反応がその分子を生成するため、異化と同化のコネクタであり、同化反応はそれらをアデノシノジノジリン酸(ADP)に広げます。この化合物は、リン酸化反応におけるリン酸残基の媒体としても機能します。
ビタミンは、適切に機能するために体が必要とする有機化合物ですが、細胞で産生することは不可能です。ヒトでは、ほとんどのビタミンは修飾されたコエンザイムとして機能します。たとえば、すべての水溶性ビタミンは、エフロチル化またはヌクレオチドに接続されている形で細胞に発生します [18] 。ジヌクレオチドニコチナミドアデニン(NADH)、ビタミンBの誘導体 3 (ナイアシン)は、水素受容体として作用する重要なコエンザイムです。数百の異なるタイプの脱水素酵素が反応基質の電子を奪う(酸化して減少する + ナドへ。その後、この還元された形態のコエンザイムは、さまざまなレダクターゼを作成するときに基質になります。化合物の還元を扱う酵素は酵素になります。 [19] 。ニコティナミドアデニンニコチナミド – ジンクレオチドは、2つの関連する形式の細胞で発生します。NADHとNADPH。フォームオーバー + /nadhは異化反応でより頻繁に使用されますが、nadp + /NADPHは、同化反応の過程で非常に重要です。
無機化合物と補因子 [ 編集 | コードを編集します ]

平均哺乳類の質量の約99%は、炭素、水素、酸素、窒素、硫黄、カルシウム、塩素、ナトリウム、カリウムの9つの元素で構成されています。 [20] 。有機化合物(タンパク質、脂質、炭水化物)は炭素と窒素のほとんどを焦点を合わせますが、酸素と水素の最大部分は水に含まれています [20] 。カルシウム、塩素、ナトリウム、カリウム、ならびに生物に見られる他の元素は、無機化合物の主要な成分であり、その一部は大量にありますが、他のものは微量で必要です。
ほとんどの生物では、それらに含まれる無機化合物の主要な部分は、ナトリウム、カリウム、カルシウム、マグネシウムイオン、塩化物、リン酸塩、重炭酸塩などのイオン電解質です。個々のイオンの濃度の正確な値は、浸透圧とpHのメカニズムを調節します [21] 。無機化合物は、それらを持っている生物の骨格や殻などの構造の主要な成分です。ジョンは、機能的潜在能力が作用するように刺激するため、神経細胞と筋肉の適切な機能にも必要です。細胞外液とサイトゾル間の電解質の置換中に発生する [22] 。電解質は細胞に入り、イオンチャネルと呼ばれる細胞膜タンパク質によって作成されたチャネルを介してそれらから抜け出します。たとえば、筋肉の緊張は、これらのチャネルと尿細管を介したカルシウム、ナトリウム、カリウムイオンの流れに依存します(筋肉繊維の細胞膜に詰め物が電気衝動の拡散を加速します) [23] 。
トランジショナル金属は、微量の生物で発生し、その中で最も広く普及しているのは亜鉛と鉄です [24] [25] 。これらの金属はいくつかのタンパク質と補因子の成分であり、カタラーゼや酸素輸送タンパク質などの酵素、例えばヘモグロビンなどの機能にも必要です [26] 。これらの補因子は、酵素補因子が触媒中に修飾される可能性があるにもかかわらず、常に元の形に戻った後、触媒補因子を変更できるにもかかわらず、1つのタイプのタンパク質と永久に関連しています。マイクロエレメントである金属は、特定のコンベヤーで体の細胞に伝達され、タンパク質がそれらを蓄積することに関連しています。 [27] [28] 。
異化は、エネルギーの放出を伴うより単純な化合物への複合的な有機化合物の分解または酸化により、化学反応のグループです。彼らの共通の目標は、身体の生命プロセスを維持するために必要なエネルギーまたは基質を提供することです。これらのプロセスの詳細な性質は、生物の個々のグループで異なります。しかし、これらのすべての形態の代謝は、還元粒子(有機物、アンモニア、硫化水素、鉄イオンなど)と受容体(酸素、硝酸塩、硫酸塩など)の間に電子を伝達できる酸化還元電位を作成することを目的としています。 [29] 。動物代謝では、これらの反応は、エネルギーの放出により、単純な化合物、ほとんどの場合二酸化炭素と水への有機粒子の分解につながります。
動物生物における異化反応の最も一般的なパターンは、3つの主要な段階に分けることができます。それらの最初の間、有機物質の大きな分子 – タンパク質、多糖または脂質は、消化器系で小さな粒子に消化されます。その後、それらは細胞に輸送され、さらに単純な化合物(通常はアセチルCoA)に折り畳まれ、その間にエネルギーが放出されます。最後に、アセチル基は、エネルギーがNADHとGTPに伝達されるクレブスサイクルで二酸化炭素に酸化されます。得られたNADHは呼吸鎖で酸化され、最終的にATPに保存されたエネルギーが放出されます。この段階では、NADHからの陽子は酸素に移され、有機化合物 – 水の酸化でいっぱいの2番目の製品の生産につながります。
消化 [ 編集 | コードを編集します ]
澱粉、セルロース、タンパク質などの高分子は細胞に直接吸収できないため、事前に小さな分子に広がる必要があります。消化酵素の主なグループは、タンパク質をアミノ酸に分解するタンパク質、脂質を脂肪酸に分解するグルコシダーゼを分解するグルコシダーゼを模倣する多糖類またはリパーゼです。微生物は消化器酵素を周囲に分泌します [30] [最初に30] 、動物が消化管の適切に特殊な細胞でそれらを産生しますが [32] 。これらの細胞外酵素によって放出されるアミノ酸と糖は、活性輸送プロセスで特別なタンパク質を使用して細胞の内部に輸送されます [33] [34] 。
有機化合物の異化 [ 編集 | コードを編集します ]

異化トレイルの一般的な特徴は、有機化合物をより小さな分子に広げることです。その結果、エネルギーは細胞に役立つ形式で放出されます。新たな小さな化学分子は、細胞で使用するか、そこから排泄されます。炭水化物の異化は、主にそれらを小さな粒子に広げることで構成されています。それらは単糖に広がる直後に細胞に輸送されます [35] 。異化グルコーストレイルの次の段階はグリコリスであり、その間、グルコースやフルクトース、ピルビン酸、ATPに関連するエネルギーからの糖から形成されます [36] 。ピルビン酸はいくつかの代謝経路に見られる元素ですが、その分子の大部分はアセチルCoAに変換され、クエン酸のサイクルに含まれています。サイクル中にいくつかのATP粒子も作成されますが、その最も重要な製品は上から形成されています + 酸化アセチルCoAの時点。グルコース酸化プロセスの最終生成物は粒子COです 2 、h 2 oとエネルギー。グルコース分布の別の経路は、NADPHの補酵素とrybozaなどのペントスの産生 – 糖核酸成分の産生が減少します。
嫌気性条件下では、ピュリチー + 、グリコリズムで再利用できます。復元する2番目の方法 + 酢アルデヒドへのピルビン酸の脱炭酸があり、その後、アルコール性デヒドロゲナーゼによるエタノールへの還元があります。両方のプロセスは発酵と呼ばれます。上記のものを除いて、微生物の世界には他にも多くの発酵があります。
脂肪の異化は、加水分解プロセスを通じて行われ、その間に脂肪酸とグリセロールが放出されます。グリセロールはグリコリゼ化されますが、アセチルCoAの形成とのベータ酸化中に脂肪酸が分解し、クエン酸のサイクルに入ります。グラムの脂肪酸の酸化は、炭水化物にその構造に多くの酸素が含まれているため、同じ量のグルコースの酸化よりも多くのエネルギーを引き起こします。
アミノ酸は、タンパク質やその他の分子を構築するための材料として、または尿素、水、二酸化炭素への酸化後 – エネルギー源として使用できます。 [37] 。酸化プロセスは、トランスメージ中のアミン基の除去から始まります。それは鳥類のサイクルに入り、炭素骨格をケトクワの形で残します。これらの酸のいくつかは後にクエン酸サイクルで異なる役割を果たします。たとえば、それらは完全にグルタミン酸-α-ケトグルタル酸です [38] 。グルコニックアミノ酸は、糖新生プロセスでもグルコースに変換することができます(以下を参照) [39] 。
有機化合物の細胞構造と分子を組織することは、エネルギー細胞への一定の供給のおかげでのみ可能です。従属栄養生物は、有機化合物からのみエネルギーを得ることができます。酸化的リン酸化は、細胞に役立つエネルギーを生成する重要な要素です。光オートトロピアという名前で記述された生物は、光エネルギーを使用し、化学結合のエネルギーに電磁波のエネルギーを変換することができます。プロカリオンに属する生物のそれほど大きくないグループ – 化学療法栄養栄養生物は、化学合成の過程で無機化合物の酸化からエネルギーを使用する能力を持っています。
酸化的リン酸化 [ 編集 | コードを編集します ]
酸化的リン酸化の過程で、とりわけ、有機化合物分子から採取された電子などクエン酸サイクルは酸素に伝染し、放出されたエネルギーはATPの作成に使用されます。ユーカリオットでは、これは呼吸鎖と呼ばれるミトコンドリア膜で見つかったタンパク質のグループを介して起こります。プロカリオットでは、これらのタンパク質は細胞の内膜にあります [40] 。これらのタンパク質は、還元分子(たとえば、NADH)から酸素分子に電子を移動するときに生成されたエネルギーを使用して、内側の細胞膜を介してプロトンを伝達します [41] 。 Prokaryiontsの電子受容体は、酸素以外の化合物である可能性があります。 [42] 、硫黄化合物 [43] 。
ミトコンドリアマトリックスから脳脳空間へのプロトンの移動は、膜の両側間の濃度と電位の違いを生成し、電気化学的ポテンシャルを生成します [44] 。プロトンは、ATPシンタゼと呼ばれる酵素のイオンチャネルを介してミトコンドリアマトリックスに戻ることができます。正電荷の流れにより、シンタゼのアクティブ中心が形状を変化させ、ADPをATPに変化させるおかげで、酵素軸の回転が発生します。 [17] 。
無機化合物からのエネルギー [ 編集 | コードを編集します ]
化学軟骨栄養は、いくつかの原核生物に特徴的な一種の代謝です。彼らは無機化合物の酸化からエネルギーを獲得します。水素を使用できます [45] 、還元硫黄化合物(イオンs 2- 、硫化水素およびチオシアルツノウs 2 o 3 2- )) [46] 、鉄イオン(II)Fe 2+ [47] またはアンモニア [48] 還元電位の源泉として、酸素や窒素などの受容体を犠牲にしてこれらの化合物の酸化からエネルギーを導き出す [49] 。これらの微生物学的プロセスは、酢酸、硝化、脱窒などのグローバルな生物地球化学的サイクルで非常に重要です。土壌の肥沃度も彼らのコースに依存します [50] [51] 。
太陽エネルギー結合 [ 編集 | コードを編集します ]
植物やシアノバクテリアなどの光合成生物では、電子移動は有機化合物の酸化の結果ではありませんが、光の光量子吸収のおかげで発生します。 [52] 。
太陽エネルギーは、植物、シアノバクテリア、紫色の細菌、緑硫黄菌、および一部の原生生物など、光オートトロピアによって結合することができます。このプロセスは、光合成の過程で有機化合物への二酸化炭素結合でしばしば特定されます。ただし、これらの2つのメカニズムはプロカリオットに対して独立して機能する可能性があります。たとえば、紫と緑の硫黄細菌は、石炭を結合し、有機化合物の発酵プロセスを実行しながら、光をエネルギー源として使用できます。 [53] [54] 。
太陽エネルギーの結合は、酸化的リン酸化と比較的類似したプロセスであり、プロトン濃度勾配はそのコースで形成され、そのコースではATPのシンターゼを通る流れがアデノシン科科の産生を引き起こします。 [17] 。光合成電子輸送鎖は、光合成反応中心と呼ばれる感光性タンパク質複合体によって駆動されます。これらの複合体は、最大吸収を示す波長に応じて2つの基本的なタイプに分割され、ほとんどの光合成細菌、1つのタイプの反応中心が区別され、植物とシアノバクテリア – 2つの反応中心が区別されます。 [55] 。
植物では、Fotosystem IIは太陽エネルギーを使用して水の電子を受け取り、反応の生産によって酸素の放出につながります。これらの電子はその後、B6Fシトクロム複合体に移動し、そのエネルギーを使用して葉緑体のティラコイド膜を通ってプロトンを運ぶ [56] 。ミトコンドリアの場合のように、ATPシンターゼのイオンチャネルを介して戻るこれらのプロトンはATP合成を駆動します。次に、電子は光化学系に移動し、次のエネルギーを壊した後、コエンザイムNADPに移すことができます。 + (これはカルヴィナサイクルの過程に必要です)、またはティラコイド膜を介して後続のプロトンを伝達するために使用される [57] 。
anabolizm これは、複雑な粒子の合成にエネルギーが使用される代謝プロセスのグループです。これらの分子は、すべての生細胞の建築材料であり、比較的小さなサイズの単純な化合物から段階的に作成されます。アナボリズムの3つの基本段階を区別できます。最初の段階には、アミノ酸、単糖、イソプレノイド、ヌクレオチドの産生、つまり生体分子の基本要素が含まれます。第2段階では、これらの分子はATPからのエネルギーを持つ反応性型のために活性化されますが、第3段階は、タンパク質、多糖類、脂質、核酸の複雑な分子の産生分子の組み合わせです。
個々の生物は、生成された分子のタイプの数が異なります。独立栄養、たとえば植物は、二酸化炭素や水などの単純な粒子で作られた複雑な粒子を細胞に組み込みます。順番に、異系は、単糖またはアミノ酸などの生産に、より複雑な物質が必要です。エネルギー源のタイプは、生物の分類の基準として使用できます。光オートトロフィスと光栄養栄養生物は、日光からエネルギーを獲得し、化学療法栄養栄養栄養栄養栄養素と化学療法栄養栄養生物 – 無機化合物の酸化の反応によるものです。
炭素結合 [ 編集 | コードを編集します ]


現在地球上で見つかったほとんどすべての有機化合物は、光合成の過程で形成されました。光合成は、二酸化炭素などの無機化合物の複雑なプロセスです(何が 2 )および水、有機化合物が生成されます。日光のエネルギーはこのプロセスを実行するために使用され、by -Productは通常酸素です。光合成の最初の段階では、ATPとNADPHは、上記の光合成反応中心によって生成されます。次に、両方の化合物を、比較的まっすぐにグルコースに変換された3-ホスホグリセリンアルデヒド合成に使用されます。炭素結合反応は、カルヴィナベンソンサイクルにおけるルビスコ酵素の存在のおかげで発生します [58] 。植物は3種類の光合成を実行します 3 、c 4 とカム。この多様性は、どのような方法から生じます 2 彼はカルヴィナのサイクルに入る:光合成cで 3 cにいる間に直接結び付けられます 4 CAMは最初に4つの炭素原子を含む化合物に変換されます。最後の2種類の光合成は、さまざまな照明と水の状態への適応反応として発達しました [59] 。
光合成原核生物では、石炭結合メカニズムがより多様です。このプロセスは、カルヴィナベンソンサイクル、反対のクレブスサイクルで発生する可能性があります [60] またはアセチルCoAカルボキシル化中 [六十一] [62] 。プロカリオ酸化学療法栄養生物も何を結合します 2 カルバンベンソンサイクルを通して、彼らは無機化合物の酸化からのエネルギーを使用して反応を促進します [63] 。
炭水化物とグリカン [ 編集 | コードを編集します ]
炭水化物のアナボリズムでは、単純な有機酸をグルコースなどの単糖に変換し、その後、澱粉などの多糖類に結合することができます。ピルビン酸、乳酸、グリセロール、3-ホスホグリシアンアルデヒド、アミノ酸などの化合物からのグルコースの合成は、糖新生と呼ばれます。このプロセス中、グリシリシに関連するいくつかの段階では、ピルビン酸は一連の反応を使用してグルコース-6-リン酸に変換されます [36] 。ただし、これは解糖プロセスの単純な逆転ではありません。これは、一部の反応が非クリティカル酵素によって触媒されるためです。これは、グルコースの作成と故障の間の章を作成し、これらの両方のプロセスが同時にできるようにするため、重要です。 [六十四] [65] 。
脂肪は典型的なエネルギー貯蔵化合物ですが、人間などの脊椎動物では、これらの生物がアセチルCoAアセチルをピログロン酸に変換できないため、脂肪酸をグルコースに加工することはできません。 [66] 。したがって、長期飢erは脊椎動物の生物を促進し、脂肪酸を代謝できない脳などの臓器のグルコースに代わるケトン体を生成するようにします [六十七] 。植物や細菌など、他の生物は、代謝にグリキシランサイクルを導入することにより、この問題を解決しました。クレブスサイクルのデカルボキシル化の段階をバイパスし、アセチルCoAをシュウ酸に変換します。これはグルコース産生に使用できます [68] [66] 。
多糖類とグリカンは、酵素による単糖の連続的な付着の結果として生じます – グリコソトランフェラーゼ – 反応性ドナー(Urynodifhosphate)から新興の多糖のヒドロキシル基の受容体への受容体へ。ヒドロキシル単糖リングのそれぞれがアクセプターになる可能性があるため、多糖チェーンはしばしば分岐構造を持っています [69] 。生成された多糖類は、代謝機能を独立して実行できます。また、オリゴサチャルトランスフェラーゼと呼ばれる酵素によって脂質またはタンパク質に変換することもできます [70] [71] 。
脂肪酸、イソプレノイド、ステロイド [ 編集 | コードを編集します ]

脂肪酸は、脂肪酸の合成、酵素が重合し、アセチルCoAユニットを減少させるおかげで発生します。それらのアシル鎖は、アシル基の付着の反応の過程で拡張され、アルコールに還元され、アルケン基への脱水、アルカノへの再還元が拡張されます。脂肪酸の生合成は2つのグループに分けられます。動物とキノコでは、これらの反応はすべて、単一の多機能タイプIタンパク質によって行われます。 [72] 、植物や細菌のプラスチック中に、個々のタイプII酵素は各反応を個別に実行します [七十三] [74] 。
テルペンとイソプレノイドは脂質の大きなグループです。カロテノイド;彼らは最も多くのクラスの天然植物製品を作成します [75] 。これらの化合物は、ピロリン酸によって提供されるイソプレンユニットの結合と修正の過程で形成されます [76] 。これらのピロリン酸塩はさまざまな方法で発生する可能性があります。動物や古細菌では、アセチルCoA分子からのMealon Acid Trailで合成されます [77] 、植物やバクテリアにいる間、非emissaryトレイルはピルビン酸と3-ホスホグリセリンアルデヒドの基質として使用します [78] [76] 。これらのイソプレンドナーが最も重要な反応の1つは、ステロイド生合成の反応です。イゾプレンユニットはここで接続してスクアレンを形成し、その後、ラノステロールリングのグループに変換されます [79] 。これは、コレステロールやエルゴステロールなど、他のステロイドに変換できます。 [80] [79] 。
タンパク質 [ 編集 | コードを編集します ]
個々の生物は、20の塩基性アミノ酸の合成スキルの点で異なる場合があります。ほとんどのバクテリアと植物はそれらすべてを合成できますが、哺乳類は10しか合理化できません10しかありません [9] 。残りの10個のアミノ酸は、さらに体の機能に必要なものに、食物を供給する必要があります。それらはすべて、解糖プロセス、クエン酸サイクル、またはペントソリン酸トレイルのおかげで発生します。窒素はグルタミン酸とグルタミンによって供給されます。アミノ酸の合成は、適切なアルファケト酸分子の形成に依存し、透過層化後にアミノ酸に流れ込みます [81] 。
アミノ酸は、ペプチド結合で鎖に結合する過程でタンパク質に入ります。各タンパク質には、ユニークなアミノ酸配列があります。アルファベットの文字を単語と呼ばれるほぼ無限の数の組み合わせで組み合わせることができるように、アミノ酸はシーケンスを組み合わせて、多種多様なタンパク質を作成します。接続する前に、エステル結合を使用してtRNA分子に接続することにより、アミノ酸を活性化する必要があります。アミノアシル-TRNAは、酵素によって触媒されるATP依存性反応に形成されます – tRNAのアミノアシルのシンタゼ [82] 。このアミノアシル玄関は、mRNAに含まれる情報に従って、新興タンパク質鎖に含まれます [83] 。
ヌクレオチドの合成と利用 [ 編集 | コードを編集します ]
ヌクレオチドは、大量の代謝エネルギーを必要とするプロセスでアミノ酸、二酸化炭素、ギ酸から形成されます。 [84] 。このため、ほとんどの生物はヌクレオチドの再使用のメカニズムを開発しました [84] [85] 。プリンはヌクレオシドのように合成されます。アデニンとグアニンの両方は、グリシンとグルタミンのアミノ酸から生成された元のイノシンヌクレオシドから形成され、テトラヒドロピアンのコーエンザイムからアスパラギン酸とアントイオンが生成されます。ピラミジンはオロス酸から合成され、グルタミンとアスパラギン酸から形成されます [八十六] 。
代謝戦略の比較 [ 編集 | コードを編集します ]
生きている生物は、生きるために次の基板を必要としています [八十七] :
- それらが構築されている構造、主に要素C、H、O、N、S、最も重要なのは石炭の供給源です。
- 電子ドナーは、酸化によってエネルギーを提供するか、酸化された基質を減らします( co
2 )有機化合物を生産する。 - エネルギー基質に応じてエネルギーを放出する電子受容体(酸化剤)。
同じ関係が異なる役割を果たすことができます。石炭の供給源の中で、あなたは有機化合物を区別することができます(酸化が低い、ヘテロトリーフで石炭があります)または co
2 エネルギーを消費する削減を必要とする(独立栄養学)。主なエネルギー源は、太陽放射と化合物の酸化です。電子ドナーは無機化合物と有機化合物に分けることができ、酸素は電子受容体間で区別できます。代謝軌跡の可能な組み合わせのほとんどは、生物に含まれていますが、フォトリトロオートトロフィス、化学糸栄養栄養生物、酸素、嫌気性化学硬化症が最も重要です [八十七] 。
| エネルギー源 | 日光 | 写真- | – ストロフ | ||
| 化学物質 | 化学療法 – | ||||
| 電子源 | 有機的な関係 | 器官- | |||
| 無機関係 | ベッド- | ||||
| 石炭源 | 有機的な関係 | ヘテロ – | |||
| 無機関係 | 自動 – | ||||
| Fotosynteza | 無酸素性光合成 | Chemosynteza | Ane -Free Breathing | 酸素呼吸 | 発酵 | |
|---|---|---|---|---|---|---|
| 石炭源 | 同化何 2 [88] | 同化何 2 (ハロバクテリアを除く);他の有機化合物も使用します(その後、独立栄養素とは見なされません) [89] | 同化何 2 [88] | 有機的な関係 | 有機的な関係 | 有機的な関係 |
| エネルギー源 | 光エネルギー [88] | 光エネルギー [90] | 単純な無機化合物(硫黄、アンモニウム塩、窒素、天然硫黄、鉄塩、水素)またはメタンの酸化 [91] | 有機化合物の酸化、電気化学勾配の作成 [92] 、短い呼吸鎖 [93] | 有機化合物の酸化(解糖、クレブスサイクル);電気化学勾配、呼吸鎖の生産 | グリコール化(アルコール発酵など)またはなし(例:乳ヘテロ採取)を通過する有機化合物の酸化 [九十四] |
| 電子源 | 水(酸素放出を伴う水のフォトリーズ) [90] | 無機化合物の還元(特に硫黄化合物、水素:H 2 S、h 2 、p fe 2+ [90] |
単純な無機化合物またはメタン [91] | 有機的な関係 | 有機的な関係 | 有機的な関係 [95] (通常、外部電子受容体の欠如なので、それは有機化合物に直接転送されます – 繁殖するための基質 + )) [96] |
| 電子受容体 | NADP + (明るい光合成段階で) [97] | 周期的な電子の輸送(環状リン酸化) [97] | 酸素(好気性生物の場合)または酸化鉱物(硫酸塩、硝酸塩、炭酸塩) [91] | 酸化鉱物化合物(硫酸塩、硝酸塩など)、 co 2 以下の頻度では、一部の有機化合物(フマランなど) [98] |
空気 | 有機化合物;同じ基質は1つの酸化生成物を与え、もう1つは還元された(指示の反応)を与えます。電子伝達の間接段階はありません [96] |
| 生物の例 | 植物、シアノバクテリア [90] | 硫黄と眠れない紫色の細菌、緑の細菌 [90] | 硝化細菌、水素菌、鉄細菌、無色の硫黄菌、メタン [91] | 脱窒細菌、脱硫菌、メタネン [98] | 植物、菌類、哺乳類 | Saccharomyces酵母 – アルコール発酵、乳酸酸菌 – 牛乳発酵 [95] |
酸化還元反応の生体異物と代謝 [ 編集 | コードを編集します ]
すべての生物は、食物として使用できない化合物に絶えずさらされており、代謝機能を実行しないため、細胞に入ると有害になる可能性があります。これらの潜在的に危険な物質は、生体異物と呼ばれます [99] 。薬物、薬物、天然毒、抗生物質などの生体異物は、特定の生体異物および代謝酵素を使用して解毒されます。人間では、これらはとりわけですシトクロムオキシダーゼP450 [100] 、UDP – Glukuronosyltransferaza [101] 私 s -Glutathioneトランスフェラーゼ [102] 。これらの酵素は3つの段階で動作します:異種性(フェーズI)の酸化、親水性基(フェーズII)をその分子に付着させ、水で細胞から除去する(多細胞生物では、その後の消化が可能です)。これらの反応は、危険物質の生分解と汚染された土壌と水のバイオレメディア化の基礎であるSozologyにとって非常に重要です。 [103] 。並外れた種類の微生物は、ほとんどすべてのタイプの生体異物に対処できるようにします [104] 。
酸化ストレスは、酸素生物にとって同様の問題です [105] 。タンパク質構造中の酸化的リン酸化や脱硫酸塩結合の作成などのプロセスは、活性酸素型を引き起こします。 [106] 。これらの酸化剤は、とりわけの構造の破壊を引き起こしますタンパク質と核酸は、抗酸化物質と酵素によって中和されます:カタラーゼとペルオキシダーゼ [107] [108] 。
生物の熱力学 [ 編集 | コードを編集します ]
他のすべての化学反応と同様に、生物で発生する反応は、熱エネルギーと作業の流れを説明する熱力学の原則の対象となります。
自由エンタルピー(ΔG)の変化は、システムの総エネルギー(実際にはエンタルピーシステム)の一部であり、作業を実行するために使用できますが、化学ポテンシャルに相当する有用なエネルギーです。エントロピアはシステムの障害の程度です)そして、熱力学の2番目の原則によれば、エントロピーの総値は、自発プロセスの上昇傾向を示し、システムのバランスに達すると最大値を取得します。システムにおける遊離エンタルピー(ΔG)の変化と一定温度でのエントロピー(ΔS)の変化と圧力条件の関係は、次の方程式を表現します [109] :
どこ: ΔH – エンタルピアの変更(暖かい)、 t – 絶対温度
生化学反応が発生する条件下では、エンタルピーの変化は、反応の内部エネルギーの変化(ΔE)にほぼ等しくなります。
どこ: Δf – 遊離反応エネルギー
ΔGが陰性である場合、反応は自然に発生し、自由の自由損失があり(反応はエクソレゲチック)、高い値では、反応は実際には一方向でのみ起こり、本質的に不可逆的に不可逆的です。 ΔGが陽性の場合、反応は外部からエネルギーが提供されるときにのみ発生します(遊離エンタルピア;反応はエンドエネルギーです)。高い正値では、システムが安定しており、反応が不足しているかわずかな傾向を示すと結論付けることができます。 ΔGがゼロに等しい場合、システムはバランスの状態にあり、結果の変化はありません [109] 。
ATPは、細胞内の主要なエネルギーコンベアです [初め] 。 ATP加水分解中に放出される自由エネルギーは、その送達を必要とする反応を実行するために使用されます(エンドエネルギー)。エネルギー(ATP分布)を引き起こす反応との熱力学的に逆反応の結合のおかげで、反応バランスがシフトされ、最初のバランスが可能です [109] 。
たとえば、ヘキソキナーゼ酵素によって触媒されるグリコリズムの最初の反応:
- グルコース + p 私 →グルコース-6-リン酸 +H。 2 o(Δgº= +13.8 kj/mol)
- ATP→ADP + P 私 (Δgº= –30.5 kj/mol)
結合後:
- グルコース + ATP→グルコース-6-リン酸 + ADP +H。 + (Δgº= –16.7 kj/mol = –30.5 kj/mol + 13.8 kj/mol)
システムはバランスの状態を達成するよう努めているため、反応ΔF(作業を行うために使用できる)の自由エネルギーはそれ自体を低下させ、エントロピー – 増加する傾向があります。反応がバランスから離れているほど、エントロピーの成長を支持して作業を実行する可能性が低くなります。細胞代謝の場合、特定の反応の基質と生成物の比率がバランスの状態にないことが特徴的です。ただし、代謝トレイルの一部の反応は状態またはバランスに近いものですが、通常は少なくとも1つであり、通常はバランスからはほど遠い状態であるため、本質的に不可逆的になり、一方向に発生します。同時に、これらの反応を触媒する酵素の活性を刺激または阻害することにより、それらは調節メカニズムの対象となります [110] 。たとえば、ΔGが解糖反応で測定された場合、すべての反応は、ヘキソシナーゼ、ホスホフルクトシナーゼ、ピルビン酸キナーゼが触媒するものを除き、バランスに近いことがわかります。それらは本質的に不可逆的であり、自由エネルギーの大きな違いに関連していますが、他の段階はわずかな減少によって特徴付けられます [110] 。
熱力学の基本原理は、閉じた無生物システム用に策定されています [110] 細胞のユニークな複雑さは熱力学の2番目の原則と矛盾しているように見えますが、実際には、すべての生物は実際には、環境で物質とエネルギーを常に言及するオープンシステムです。それらは熱力学的バランスの状態にとどまりませんが、周囲のエントロピーを増やすことで高い複雑さの状態を維持する散逸システムです(例えば、物質とエネルギーを血流または繁殖地に置き換えることにより) [111] 。これは、自発的な(エネルギー供給を必要としない)不採算反応と非採算アナボリズムプロセスの組み合わせのおかげで達成されます。熱力学の2番目の原則は、体内の順序の程度の増加が周囲の環境の順序の減少によって補償されるため、満たされたままです。したがって、システム全体のエントロピーは絶えず増加しています。代謝は秩序を維持し、障害を生み出すと言えます [112] 。
細胞および細胞の外側への酸素およびその他の物質の一定の流れにより、固定状態での代謝が可能になります。その後、さまざまな反応の基質と生成物の濃度は比較的一定のレベルのままですが、個々の反応は必ずしもバランスの状態ではなく、代謝産物のレベルは必ずしも変化しません。細胞は、変化する条件に応じて、重要な化合物の濃度を常に調整することができます [110] 。
ほとんどの生物の環境は常に変化の対象となるため、恒常性と呼ばれる安定した状態の状態を維持するために、代謝反応を正確に調節する必要があります [113] [114] 。代謝規制により、生物は外部刺激や環境の相互作用に対応することもできます。 [115] 。代謝ルートを調整するメカニズムを理解するには、2つの重要な概念を定義する必要があります。まず第一に、酵素を通るトレイルの「調整」は、刺激に応じてそのペースが増加または落ちる方法です。第二に、酵素によって行使される「コントロール」は、これらの変化がトレイルの全体的なルートに及ぼす効果です [116] 。たとえば、この活動の修正がこのトレイルのプロセスのプロセスに少し影響を与える場合、アクティビティを大幅に変更する能力を示す酵素は、特定のトレイルを制御する酵素として含まれません。 [117] 。
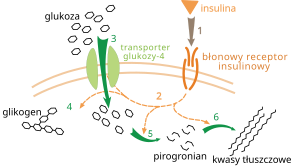
代謝調節は多くの方法で発生します。代謝性トレイルの基本的な調整は、基質の濃度の変化に対する自動応答で構成されています。たとえば、製品の数の減少は、バランスのために反応コースを加速することができます [116] 。多くの場合、これは個々のトレイル酵素の活動のアロステリックな調節です [118] 。外部調節は、他の細胞からの信号によって細胞代謝の変化を引き起こします。これらの信号は通常、ホルモンや成長因子などの水溶性物質の形を持ち、細胞の表面の特定の受容体によって知覚されます [119] 。その後、内部信号伝送チェーンによってセルの内部に送信されます。タンパク質リン酸化を介して [120] 。
外部調節の非常によく知られているメカニズムの例は、グルコース代謝に対するインスリンの効果です [121] 。インスリンは、体内のグルコースの増加に応じて産生されるホルモンです。ホルモンをインスリン受容体と結合させると、プロテインキナーゼのグループを活性化し、細胞を刺激して血液からグルコースを収集し、それを予備の物質(たとえば、脂肪酸やグリコーゲンに変換します [122] 。次に、グリコーゲン代謝は、ホスホリラーゼ、酵素破壊グリコーゲン、およびそれを作成するグリコーゲンシンターゼによって制御されます。これらの酵素は、ホスホリラーゼを活性化しながら、二重角化 – リン酸化がグリコーゲンシンターゼを非アクティブ化する制御されています。インスリンは、タンパク質ホスファターゼを活性化し、これらの酵素のリン酸化を阻害することにより、グリコーゲン合成を引き起こします [123] 。

上記の最も重要な代謝ルート、たとえばグリコリスやクエン酸サイクルは、3つのドメインすべての生物で発生し、最後の共通の祖先に現れなければなりませんでした [124] [5] 。それは原核生物であり、おそらくアミノ酸、炭水化物、ヌクレオチド、脂肪酸の外部代謝を伴うメタンゲンでした [125] [126] 。進化中にこれらのルートのさらなる開発を停止することは、最適なパフォーマンス、最小複雑さ、および基本的な代謝ニーズの満足度の結果である可能性があります [6] [7] 。酵素に基づく最初の代謝ルートは、Purynのヌクレオチド代謝に含まれる可能性があると考えられています。 [127] [128] 。
新しい代謝ルートの形成と進化のメカニズムを説明する多くの仮説が作成されています。彼らはとりわけ想定したその後、短いプライマリトレイルに新しい酵素を追加し、個々のサイクルの重複と分化、および以前に既存の酵素を新しく出現したトレイルに含めること [129] 。確かに、進化におけるこれらのメカニズムの相対的な参加は決定されていません。遺伝的研究により、特定のトレイル内のほとんどの酵素は通常共通の起源を持っていることが明らかになりました。 [130] [131] 。別の可能性は、異なるルートで使用される普遍的な「モジュール」の存在です。 [132] 。
生物の進化は、代謝経路の消失をもたらす可能性があります。たとえば、一部の寄生虫では、特定の代謝プロセスが生命に必要であることを止めます。準備ができているアミノ酸、ヌクレオチド、炭水化物は宿主から直接吸収される可能性があるため [133] 。同様に、還元された代謝は、内共生形態で観察されます [134] 。

代謝は通常、個々の代謝ルートとその要素の分析に焦点を当てた還元主義的方法を使用して研究されます。このような分析の方法の1つは、その投与の瞬間から最終代謝産物の作成まで、身体内の与えられた放射性物質の経路を研究することです [136] 。酵素触媒代謝反応を分離することができます。これにより、条件の阻害剤に対する動態と反応を調べることができます。 試験管内で 。同時に、代謝プロセスに関与する小さな分子を識別することが可能です。そのようなすべての物質の収集は、メタボロームと呼ばれます。一般に、この方法は、単純な代謝ルートの構造と機能をテストする場合に効果的ですが、より複雑なプロセスでは失敗します。 [137] 。
代謝ネットワークは、物質と物質自体の量との間の相互作用量の可能性があるため、通常非常に複雑です。ただし、使用された研究手法により、ゲノムに含まれる情報に基づいて生化学反応全体を再構築することができます。これにより、コースを説明および予測できる全体的な数学モデルを構築できます。 [138] 。このようなモデルの最大の精度は、代謝をテストする古典的な方法と遺伝子発現に関するプロテオームおよびDNA配列の知識に関する研究を組み合わせることによって得られます。 [139] 。
この情報は、主に遺伝子工学で使用できます。酵母、植物、細菌などの生物は、抗生物質、インスリン、ビタミンなど、さまざまな物質を生産するためにそれらを使用するために遺伝子組み換えされています [140] [141] [142] 。遺伝的修正は通常、コストを削減し、製品生産プロセスの効率を高め、by -Productsの数を減らすことを目的としています。 [143] 。
代謝に関する研究の歴史 [ 編集 | コードを編集します ]

「代謝」という用語は、ギリシャ語の単語μεταβολισlueに由来します – 「メタボリスモ」は変化を決定し、転覆する(例:政府) [144] 。代謝プロセスの科学的研究の歴史は、動物の最初の研究から現代の生化学における個々の反応の顕微鏡分析まで、400年をカバーしています。人間の代謝を調べることを目的とした最初の実験は、本で実施され、提示されました 静的医学のAR サントリオサントリオ [145] 。彼は、食べたり、飲んだり、眠ったり、仕事をしたり、性交し、性交し、ポストと排便後に体重を測定しました。彼は、彼が言ったように、ほとんどの食べ物が「無意識の汗」を通して失われていることに気づきました。
これらの初期の研究の間、代謝機能を備えた生命プロセスはまだ特定されていません。その後、未知の生命力は復活因子と見なされました [146] 。 19世紀に、酵母によって行われたアルコール発酵に関する研究中、ルイパスツールは、このプロセスが酵母細胞に含まれる物質によって触媒され、「発酵剤」と呼ばれることに気付きました。彼のメモには、「アルコール発酵は生命プロセスと酵母細胞の組織に関連しており、その死や分解に関連していない」と読みました。 [147] 。 1828年にフリードリッヒヴォーラーによって実施された無機物質からの有機化合物(尿素)の最初の成功した合成と一致した発見 [148] 、細胞で発生する有機化合物と反応は、他の現象や化学物質と一般的に違いはないことを証明しました。
細胞生物学の研究からの化学代謝反応に関する研究の分離は、20世紀初頭にエドゥアルド・ブッフナーによる酵素の発見とともに起こりました。この瞬間は、生化学の誕生の従来の瞬間を決定します [149] 。 20世紀はこの分野で知識の急速な発展をもたらしました。科学の世界は主にハンス・クレブスによるものです [150] 。彼はサイクルの存在を発見しました:Orninecic、citric、グリオキシン酸 [151] [68] 。クロマトグラフィー、構造X-レイ、NMR分光法、電子顕微鏡、および分子動力学シミュレーションなどの技術は、生化学開発のペースに大きな影響を与えます。それらは、細胞内で実行される多くの分子および代謝ルートの識別と詳細な分析を可能にしました。
- ↑ a b c Berg Jeremy M.、Tymoczko John L.、Stryer Lubert: 生化学 。ワルシャワ:PWN Scientific Publishing House、2007。ISBN 978-83-01-14379-4 。 ( pol。 )) 。 著者を確認してください:1。
- ↑ Peter A Mayes、PhD、DSC:Bioenergetyka:ATPの役割。 In:Robert K Murray、Franciszek Kokot、Aleksander Koj、Zenon Aleksandrowicz: 生化学ハルペラ 。ワルシャワ:PZWL Medical Publishing House、2006、pp。159–166。 ISBN 83-200-3347-0 。
- ↑ フリードリッヒC. 硫黄酸化細菌の生理学と遺伝学 。 「ADV Microb Physiol」。 39、s。 235–89、1998。PMID: 9328649 。
- ↑ David C. Dorman、Frederic J.M. Moulin、Brian E. McManus、Kristen C. Mahle、R。ArdenJames I Melanie F. Struve。 急性硫化水素吸入によって誘導されるシトクロムオキシダーゼ阻害:ラット脳、肝臓、肺、鼻上皮の硫化組織濃度との相関 。 「毒性科学」。 Tom 65、2002。NR。 s。 18–25。
- ↑ a b スミスE、モロヴィッツH. 中間代謝の普遍性 。 „ proc natl acci u s a”。 101、s。 13168–73、2004。PMID: 15340153 。
- ↑ a b EbenhöhO、ハインリッヒR. 代謝経路の進化的最適化。 ATPおよびNADH生産システムの化学量論の理論的再構築 。 「ブル数学バイオル」。 63、s。 21–55、2001。PMID: 11146883 。
- ↑ a b Meléndez-HeviaE、Waddell T、Cascante M. クレブスのクエン酸サイクルのパズル:進化中の代謝経路の設計における化学的に実行可能な反応の断片を組み立てる 。 「J Mol Evol」。 43、s。 293–303、1996。PMID: 8703096 。
- ↑ Michie K、LöweJ。 細菌細胞骨格の動的フィラメント 。 「Annu Rev Biochem」。 75、s。 467–92、2006。PMID: 16756499 。 ( 。 )) 。
- ↑ a b c d そうです デビッド・L・ネルソン、マイケル・M・コックス: Lehingerの生化学の原則 。 W. H. Freeman and Company、2005、s。 841. ISBN 0-7167-4339-6 。 ( 。 )) 。
- ↑ Fahy E、Subramaniam S、Brown H、Glass C、Merrill A、Murphy R、Raetz C、Russell D、Seyama Y、Shaw W、Shimizu T、Spener F、Van Meer G、Vannieuwenhze M、White S、Witztum J、Dennise E. 脂質の包括的な分類システム 。 „ J脂質Res」。 46、s。 839–61、2005。PMID: 15722563 。 ( 。 )) 。
- ↑ 脂質の命名法 。 IUPAC-IUB生化学命名法(CBN)に関する委員会。 ( 。 )) 。
- ↑ Hegardt F. ミトコンドリア3-ヒドロキシ-3-メチルグルタリルCoAシンターゼ:ケトゲン化におけるコントロール酵素 。 「バイオケムJ」。 338(PT 3)、s。 569–82、1999。PMID: 10051425 。 ( 。 )) 。
- ↑ Raman R、Raguram S、Venkataraman G、Paulson J、Sasisekharan R. グリコミクス:グリカンの構造機能関係への統合システムアプローチ 。 「NATメソッド」。 2、s。 817–24、2005。PMID: 16278650 。 ( 。 )) 。
- ↑ Sierra S、Copper B、Kaiser R. HIV-1のウイルス学とその複製の基本 。 「J Clin Virol」。 34、s。 233–44、2005。PMID: 16198625 。 ( 。 )) 。
- ↑ a b Wimmer M、Rose I. 酵素触媒グループ移動反応のメカニズム 。 「Annu Rev Biochem」。 47、s。 1031–78、1978。PMID: 354490 。 ( 。 )) 。
- ↑ ミッチェルP. 9番目のハンス・クレブスの講義。生きているシステムにおけるコンパートメントとコミュニケーション。リガンド伝導:化学、浸透圧、化学反応システムの一般的な触媒原理 。 「Eur J Biochem」。 95、s。 1–20、1979。PMID: 378655 。 ( 。 )) 。
- ↑ a b c d Dimroth P、von Ballmos C、Meier T。 F-ATPシンターゼの触媒および機械的サイクル。 Cycles Reviewシリーズで4番目 。 「embo rep」。 7、s。 276–82、2006。PMID: 16607397 。 ( 。 )) 。
- ↑ アン・コールストン、ジョン・カーナー、ジョアン・ハットナー、アシニ・スリバスタバ。 スタンフォード大学医学部栄養コース 。 「栄養原則と臨床栄養」、2006年。サミット。 ( 。 )) 。
- ↑ Pollak N、DölleC、Ziegler M. 還元する力:ピリジンヌクレオチド – 多数の機能を備えた小分子 。 「バイオケムJ」。 402、s。 205–18、2007。PMID: 17295611 。 ( 。 )) 。
- ↑ a b Heymsfield S、Waki M、Kehayias J、Lichtman S、Dilmanian F、Kamen Y、Wang J、Pierson R. 改善された体組成モデルを使用したin vivoでの人間の化学的および元素分析 。 「Am J Physiol」。 261、s。 E190–8、1991。PMID: 1872381 。 ( 。 )) 。
- ↑ SychrováH。 アルカリ金属陽イオンの輸送と恒常性を研究するためのモデル生物としての酵母 。 「Physiol Res」。 53 Suppl 1、s。 91–8、2004。PMID: 15119939 。 ( 。 )) 。
- ↑ レビタンI. ニューロンおよび他の細胞のイオンチャネルの変調 。 「Annu Rev Neurosci」。 11、s。 119–36、1988。PMID: 2452594 。 ( 。 )) 。
- ↑ Dulhunty A. 1950年代から新しいミレニアムへの励起制御の結合 。 「Clin Exp Pharmacol Physiol」。 33、s。 763–72、2006。PMID: 16922804 。 ( 。 )) 。
- ↑ マハンD、シールズR. 出生から体重の145キログラムまでの豚のマクロおよびミクロミネラル組成 。 „ J amim Sci」。 76、s。 506–12、1998。PMID: 9498359 。 [アーカイブ 住所 ]。 ( 。 )) 。
- ↑ Husted S、Mikkelsen B、Jensen J、Nielsen N. 誘導結合プラズマ質量分析、同位体比質量質量分析、および多変量統計を使用した大麦(Hordeum vulgare)の元素指紋分析 。 「肛門生物分析化学」。 378、s。 171–82、2004。PMID: 14551660 。 ( 。 )) 。
- ↑ フィニーL、オハロランT. 細胞内の遷移金属種分化:金属イオン受容体の化学からの洞察 。 “化学”。 300、s。 931–6、2003。PMID: 12738850 。 ( 。 )) 。
- ↑ Couusins R、Liuzzi J、Lichten L. 哺乳類の亜鉛輸送、人身売買、および信号 。 „ J Biol Chem」。 281、s。 24085–9、2006。PMID: 16793761 。 ( 。 )) 。
- ↑ Dunn L、Rahmanto Y、Richardson D. 新しいミレニアムにおける鉄の摂取と代謝 。 「Trends Cell Biol」。 17、s。 93–100、2007。PMID: 17194590 。 ( 。 )) 。
- ↑ ニールソンK、コンラッドP. 人生:過去、現在、未来 。 「Philos Trans R Soc Lond B Biol Sci」。 354、s。 1923–39、1999。PMID: 10670014 。 ( 。 )) 。
- ↑ HäseC、Finkelstein R. 細菌の細胞外亜鉛含有メタロプロテアーゼ 。 「Microbiol Rev」。 57、s。 823–37、1993。PMID: 8302217 。 ( 。 )) 。
- ↑ Gupta R、Gupta N、Rathi P. 細菌リパーゼ:生産、精製、生化学的特性の概要 。 「Appl Microbiol Biotechnol」。 64、s。 763–81、2004。PMID: 14966663 。 ( 。 )) 。
- ↑ ホイルT. 消化器系:理論と実践をリンクします 。 「br j看護師」。 6、s。 1285–91、1997。PMID: 9470654 。 ( 。 )) 。
- ↑ Souba W、Pacitti A. アミノ酸が細胞に入る方法:メカニズム、モデル、メニュー、およびメディエーター 。 „ jpen j親の経腸nutr」。 16、s。 569–78、1992。PMID: 1494216 。 ( 。 )) 。
- ↑ Barrett M、Walmsley A、Gould G. 促進糖輸送体の構造と機能 。 「Curr Opin Cell Biol」。 11、s。 496–502、1999。PMID: 10449337 。 ( 。 )) 。
- ↑ ベルG、Burant C、Takeda J、Gould G. 哺乳類の促進糖輸送体の構造と機能 。 „ J Biol Chem」。 268、s。 19161–4、1993。PMID: 8366068 。 ( 。 )) 。
- ↑ a b BouchéC、Serdy S、Kahn C、Goldfine A. グルコースの細胞運命と2型糖尿病におけるその関連性 。 「エンドクルRev」。 25、s。 807–30、2004。PMID: 15466941 。 ( 。 )) 。
- ↑ 次に、w、ハリントンh。 アミノ酸代謝 。 「Annu Rev Biochem」。 32、s。 355–98、1963。PMID: 14144484 。
- ↑ ブロスナンJ. グルタミン酸、アミノ酸と炭水化物代謝の界面で 。 「j nutr」。 130、s。 988S – 90S、2000年。PMID: 10736367 。
- ↑ ヤングV、アジャミa。 グルタミン:皇帝または彼の服? 。 「j nutr」。 131、s。 2449S – 59S;ディスカッション2486S – 7S、2001年。PMID: 11533293 。
- ↑ Hosler J、Ferguson-Miller S、Mills D. エネルギー伝達:呼吸器錯体を通るプロトン移動 。 「Annu Rev Biochem」。 75、s。 165–87、2006。PMID: 16756489 。
- ↑ シュルツB、チャンS. ミトコンドリア呼吸酵素の構造とプロトンポンピング戦略 。 「Annu Rev Biophys Biomol struct」。 30、s。 23–65、2001。PMID: 11340051 。
- ↑ Cava F.、Zafra O.、Berenguer J. 硝酸還元酵素を含むシトクロムCは、BC呼吸器錯体の関与なしにThermus Thermophilusの脱窒の電子輸送に役割を果たします。 。 「Mol Microbiol」。 2(70)、pp。507–18、2008年10月。Doi: 10.1111/j.1365-2958.2008.06429.x 。 PMID: 18761683 。
- ↑ Balk M.、AltinbaşM。、Rijpstra Wi。、Sinning’sDamstéJS。、Stams AJ。 Desulfatirhabdium Butyrativorans Gen。 11月、sp。 11月、嫌気性バイオリアクターから分離された酪酸酸化、硫酸還元細菌。 。 「int J Syst Evol Microbiol」。 Fri 1(58)、pp。110–5、2008年1月。Doi: 10.1099/ijs.0.65396-0 。 PMID: 18175693 。
- ↑ Capaldi R、Aggeler R。 F(1)F(0)タイプATPシンターゼのメカニズム、生物学的ロータリーモーター 。 「トレンドBiochem Sci」。 27、s。 154–60、2002。PMID: 11893513 。
- ↑ フリードリッヒB、シュワルツE. 好気性化学リソトロフィスにおける水素利用の分子生物学 。 「Annu Rev Microbiol」。 47、s。 351–83、1993。PMID: 8257102 。
- ↑ フリードリッヒC. 硫黄酸化細菌の生理学と遺伝学 。 「ADV Microb Physiol」。 39、s。 235-89、1998。PMID: 9328649 。
- ↑ Weber K、Achenbach L、Coates J. 微生物ポンプ鉄:嫌気性微生物鉄の酸化と還元 。 「Nat Rev Microbiol」。 4、s。 752-64、2006。PMID: 16980937 。
- ↑ Jetten M、Strous M、Van De Pas-Schoonen K、Schalk J、Van Dongen U、Van de Graaf A、Logemann S、Muyzer G、Van Loosdrecht M、Kuenen J. アンモニウムの嫌気性酸化 。 「FEMS Microbiol Rev」。 22、s。 421–37、1998。PMID: 9990725 。
- ↑ サイモンJ. 呼吸器亜硝酸アンモニアの酵素学と生体エネルギー 。 「FEMS Microbiol Rev」。 26、s。 285–309、2002。PMID: 12165429 。
- ↑ コンラッドR. 大気微量ガスのコントローラーとしての土壌微生物(H 2 、Co、ch 4 、OCS、n 2 o、そしていいえ) 。 「Microbiol Rev」。 60、s。 609–40、1996。PMID: 8987358 。
- ↑ Barrea J、右M、AzcónR、Azcón-Aguilar c。 根圏における微生物協力 。 „ J Exp Bot」。 56、s。 1761–78、2005。PMID: 15911555 。
- ↑ ネルソンN、ベンシェムA. 酸素性光合成の複雑なアーキテクチャ 。 „ Nat Rev Mol Cell Biol」。 5、s。 971–82、2004。PMID: 15573135 。 ( 。 )) 。
- ↑ van der Meer M、Schouten S、Bateson M、NübelU、Wieland A、KühlM、De Leeuw J、SinningheDamstéJ、Ward D. イエローストーン国立公園からのアルカリ性珪質温泉微生物マットにおける緑色の非硫黄様菌による炭素代謝のディールの変動 。 「Appl Environ Microbiol」。 71、s。 3978–86、2005。PMID: 16000812 。
- ↑ Tichi M、Tabita f。 光栄養代謝中のRhodobacter Capsulatus酸化還元系のインタラクティブな制御 。 「jバクテリオール」。 183、s。 6344–54、2001。PMID: 11591679 。
- ↑ アレンJ、ウィリアムズJ. 光合成反応中心 。 「febs lett」。 438、s。 5–9、1998。PMID: 9821949 。
- ↑ ネルソンN、ベンシェムA. 酸素性光合成の複雑なアーキテクチャ 。 „ Nat Rev Mol Cell Biol」。 5、s。 971–82、2004。PMID: 15573135 。
- ↑ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T. 光化学系の周りの周期的な電子の流れは、光合成に不可欠です 。 “自然”。 429、s。 579–82、2004。PMID: 15175756 。
- ↑ Miziorko H、Lorimer G. リブロース-1,5-ビスリン酸カルボキシラーゼオキシゲナーゼ 。 「Annu Rev Biochem」。 52、s。 507-35、1983。PMID: 6351728 。
- ↑ Dodd A、Borland A、Haslam R、Griffiths H、Maxwell K. 粉砕菌酸代謝:プラスチック、幻想 。 „ J Exp Bot」。 53、s。 569–80、2002。PMID: 11886877 。
- ↑ HüglerM、Wirsen C、Fuchs G、Taylor C、Sievert S. プロテオバクテリアのエプシロン細分化のメンバーによる還元トリカルボン酸サイクルを介した独立栄養CO2固定の証拠 。 「jバクテリオール」。 187、s。 3020–7、2005。PMID: 15838028 。
- ↑ Strauss G、Fuchs G. 光栄養性細菌chlorofxus aurantiacus、3-ヒドロキシプロピオン酸サイクルの新規独立栄養CO2固定経路の酵素 。 「Eur J Biochem」。 215、s。 633–43、1993。PMID: 8354269 。
- ↑ 木材H. 炭素とエネルギーの供給源としてのCOまたはCO2とH2との生活 。 „ faseb j”。 5、s。 156–63、1991。PMID: 1900793 。
- ↑ Shovely J、Van Keulen G、Meijer W. ほとんど何もないものから:化学療法栄養栄養栄養学における二酸化炭素固定 。 「Annu Rev Microbiol」。 52、s。 191–230、1998。PMID: 9891798 。
- ↑ ローフルA、ヘスB 解糖の設計 。 「Philos Trans R Soc Lond B Biol Sci」。 293、s。 5–22、1981。PMID: 6115423 。
- ↑ Pilkis S、El-Maghrabi M、Claus T. 肝臓糖新生の制御におけるフルクトース-2,6-ビスリン酸。代謝産物から分子遺伝学まで 。 「糖尿病ケア」。 13、s。 582–99、1990。PMID: 2162755 。
- ↑ a b SINS S. グリオキシレートサイクルの再想起:酢酸微生物同化の代替経路 。 „ Mol Microbiol」。 61、s。 274–6、2006。PMID: 16856935 。
- ↑ フィンP、サイコロJ. 飢vに対するタンパク質分解および脂肪分解反応 。 “栄養”。 22、s。 830–44、2006。PMID: 16815497 。
- ↑ a b Kornberg H、Krebs H. 修飾されたトリカーボン酸サイクルによるC2-ユニットからの細胞成分の合成 。 “自然”。 179、s。 988–91、1957。PMID: 13430766 。
- ↑ Rademacher T、Parekh R、Dwek R. グリコビオロジー 。 「Annu Rev Biochem」。 57、s。 785–838、1988。PMID: 3052290 。
- ↑ Opdenakker G、Rudd P、Ponting C、Dwek R. 糖生物学の概念と原則 。 „ faseb j”。 7、s。 1330–7、1993。PMID: 8224606 。
- ↑ McConville M、Menon A. グリコシルホスファチジルイノシトール脂質の細胞生物学と生化学の最近の発展(レビュー) 。 「モル膜biol」。 17、s。 1–16、2000。PMID: 10824734 。
- ↑ Chirala S、Wakil S. 動物脂肪酸シンターゼの構造と機能 。 「脂質」。 39、s。 1045–53、2004。PMID: 15726818 。
- ↑ White S、Zheng J、Zhang Y. II型脂肪酸生合成の構造生物学 。 「Annu Rev Biochem」。 74、s。 791–831、2005。PMID: 15952903 。
- ↑ Ohlrogge J、Jawor J. 脂肪酸合成の調節 。 「Annu Rev Plant Physiol Plant Mol Biol」。 48、s。 109–136、1997。PMID: 15012259 。
- ↑ Duby V、R。 植物のテルペノイド生合成のための非メバロン酸経路の概要 。 「J Biosci」。 28、s。 637–46、2003。PMID: 14517367 。 [アーカイブ 住所 ]。
- ↑ a b Kuzuyama T, Seto H. イソプレン単位の生合成の多様性 。 「Nat Prod Rep」。 20、s。 171–83、2003。PMID: 12735695 。
- ↑ Grochowski L、Xu H、White R. Methanocaldococcus jannaschiiは、イソペンテニル二リン酸の生合成のために修飾されたメバロン酸経路を使用しています 。 「jバクテリオール」。 188、s。 3192–8、2006。PMID: 16621811 。
- ↑ lichtenthaler H. 植物におけるイソプレノイド生合成の1-ドデオキシ-D-キシルロース-5-リン酸経路 。 「Annu Rev Plant Physiol Plant Mol Biol」。 50、s。 47–65、1999。PMID: 15012203 。
- ↑ a b Schroepfer G. ステロール生合成 。 「Annu Rev Biochem」。 50、s。 585–621、1981。PMID: 7023367 。
- ↑ Lees N、Skaggs B、Kirsch D、Bard M. Saccharomyces cerevisiaeのエルゴステロール生合成経路における後期遺伝子のクローニング – レビュー 。 「脂質」。 30、s。 221–6、1995。PMID: 7791529 。
- ↑ アーサーC. ガイトン 、 ジョンE. ホール 、 医学生理学の教科書 、Elsevier、2006、s。 855–6、ISBN 0-7216-0240-1 。
- ↑ Ibba M、SöllD アミノアシル-TRNA合成のルネッサンス 。 「embo rep」。 2、s。 382–7、2001。PMID: 11375928 。
- ↑ ポーランドP、セルD. タンパク質生合成のメカニズム 。 「バクテリオールRev」。 33、s。 264–301、1969。PMID: 4896351 。
- ↑ a b ルドルフF. ヌクレオチドの生化学と生理学 。 「j nutr」。 124、s。 124S – 127S、1994年。PMID: 8283301 。 Zreenner R、Stitting M、Sunwald U、Boldt R。 植物のピリミジンおよびプリン生合成と分解 。 「Annu Rev Plant Biol」。 57、s。 805–36、2006。PMID: 16669783 。
- ↑ Stasolla C、Katahira R、Thorpe T、Ashihara H. 高等植物におけるプリンおよびピリミジンヌクレオチド代謝 。 „ J Plant Physiol」。 160、s。 1271–95、2003。PMID: 14658380 。
- ↑ スミスJ. ヌクレオチド合成の酵素 。 「Curr Opin struct Biol」。 5、s。 752–7、1995。PMID: 8749362 。
- ↑ a b Weiner 2005↓ 、s。 84–86。
- ↑ a b c Kunicki-Goldfinger 1994↓ 、s。 178–179。
- ↑ Kunicki-Goldfinger 1994↓ 、s。 190–197。
- ↑ a b c d そうです Weiner 2005↓ 、s。 89–91。
- ↑ a b c d Weiner 2005↓ 、s。 87–89。
- ↑ Prescott 2002↓ 、s。 190。
- ↑ Kunicki-Goldfinger 1994↓ 、s。 141–147。
- ↑ Kunicki-Goldfinger 1994↓ 、s。 158–166。
- ↑ a b Weiner 2005↓ 、s。 95。
- ↑ a b Kunicki-Goldfinger 1994↓ 、s。 147–148。
- ↑ a b スターンズJ.C.、スレットM.G.、カイザーJ.C: ダミーの微生物学 。ウィリー、2015年、s。 134. ISBN 978-1-118-87118-8 。
- ↑ a b Weiner 2005↓ 、s。 93–95。
- ↑ テストB、クリームS. 薬物代謝の生化学 – はじめに:パート1.原則と概要 。 「Chem Biodivers」。 3、s。 1053–101、2006。PMID: 17193224 。
- ↑ ダニエルソンP. シトクロムP450スーパーファミリー:人間の生化学、進化、薬物代謝 。 「Curr Drug Metab」。 3、s。 561–97、2002。PMID: 12369887 。
- ↑ キングC、リオスG、グリーンM、テフリーT. UDP-グルクロノシルトランスフェラーゼ 。 「Curr Drug Metab」。 1、s。 143–61、2000。PMID: 11465080 。
- ↑ シーハンD、ミードG、フォーリーV、ダウドC. グルタチオントランスフェラーゼの構造、機能、および進化:古代の酵素スーパーファミリーの非哺乳類メンバーの分類への影響 。 「バイオケムJ」。 360、s。 1–16、2001。PMID: 11695986 。
- ↑ GalvãoT、Mohn W、by Lorenzo V. 微生物の生分解と生体伝達遺伝子プールの調査 。 「トレンドバイオテクノロール」。 23、s。 497–506、2005。PMID: 16125262 。
- ↑ Janssen D、Dinkla I、Poelarends G、Terpsstra P. 生体異物化合物の細菌分解:新規酵素活性の進化と分布 。 「環境マイクロビオール」。 7、s。 1868–82、2005。PMID: 16309386 。
- ↑ デイビスK. 酸化ストレス:好気性生活のパラドックス 。 「Biochem Soc Symp」。 61、s。 1–31、1995。PMID: 8660387 。
- ↑ Tu B、Weissman J. 真核生物の酸化タンパク質の折り畳み:メカニズムと結果 。 「J Cell Biol」。 164、s。 341–6、2004。PMID: 14757749 。
- ↑ SIES H. 酸化ストレス:酸化剤と抗酸化物質 。 「exp physiol」。 82、s。 291–5、1997。PMID: 9129943 。
- ↑ Vertuani S、Angusti A、Manfredini S. 抗酸化物質と抗酸化促進剤ネットワーク:概要 。 「Curr Pharm des」。 10、s。 1677–94、2004。PMID: 15134565 。
- ↑ a b c Murray R. K.、Granner D. K.、Rodwell V. W。: 生化学ハルペラ 。ワルシャワ:PZWL Medical Publishing House、2017、pp。111–117。 ISBN 978-83-200-4554-3 。
- ↑ a b c d Karp G。: 細胞および分子生物学 。 Wiley、2010、s。 91–92、108。ISBN 978-0-470-48337-4 。
- ↑ Von Logs U、Liu J. 微生物寿命は常に負のエントロピーを食べますか?微生物成長の熱力学的分析 。 「Biochim Biophys Acta」。 1412、s。 191–211、1999。PMID: 10482783 。
- ↑ デミレルY、サンドラーS. 熱力学と生体エネルギー 。 「Biophys Chem」。 97、s。 87–111、2002。PMID: 12050002 。
- ↑ アルバートR. 細胞生物学のスケールフリーネットワーク 。 「J Cell Sci」。 118、s。 4947–57、2005。PMID: 16254242 。
- ↑ ブランドM. エネルギー代謝の調節分析 。 „ J Exp Biol」。 200、s。 193–202、1997。PMID: 9050227 。
- ↑ ソイアーO、サラテM、ボンヘッファーS. 信号変換ネットワーク:トポロジ、応答、生化学プロセス 。 „ J Theor Biol」。 238、s。 416–25、2006。PMID: 16045939 。
- ↑ a b ソルターM、ノウルズR、ポグソンC 代謝制御 。 「エッセイバイオケム」。 28、s。 1–12、1994。PMID: 7925313 。
- ↑ Westerhoff H、Groen A、Wanders R. 代謝制御とそのアプリケーションの最新の理論(レビュー) 。 「Biosci Rep」。 4、s。 1–22、1984。PMID: 6365197 。
- ↑ FellD、Thomas S. 代謝フラックスの生理学的制御:マルチサイト変調の要件 。 「バイオケムJ」。 311(Pt 1)、s。 35–9、1995。PMID: 7575476 。
- ↑ ヘンドリクソンW. 細胞膜を横切る生化学信号の形質導入 。 「Q Rev Biophys」。 38、s。 321–30、2005。PMID: 16600054 。
- ↑ コーエンP. マルチサイトリン酸化によるタンパク質機能の調節 – 25年の更新 。 「トレンドBiochem Sci」。 25、s。 596–601、2000。PMID: 11116185 。
- ↑ Liehard G、Slot J、James D、Muckler M. 細胞がグルコースを吸収する方法 。 「SCI AM」。 266、s。 86–91、1992。PMID: 1734513 。
- ↑ ローチP. グリコーゲンとその代謝 。 「Curr Med」。 2、s。 101–20、2002。PMID: 11949930 。
- ↑ NewGard C、Brady M、O’Doherty R、Saltiel A. グルコース処理の組織化:タンパク質ホスファターゼ-1のサブユニットを標的とするグリコーゲンの新たな役割 。 “糖尿病”。 49、s。 1967–77、2000。PMID: 11117996 。
- ↑ ロマノA、コンウェイT. 炭水化物代謝経路の進化 。 「res microbiol」。 147、s。 448–55、1996。PMID: 9084754 。
- ↑ コッホA. バクテリアはどのようにして来たのですか? 。 「ADV Microb Physiol」。 40、s。 353–99、1998。PMID: 9889982 。
- ↑ Ouzounis C、Kyrpides N. 進化における主要な細胞プロセスの出現 。 「febs lett」。 390、s。 119–23、1996。PMID: 8706840 。
- ↑ ギルバートW .. 生命の起源:RNAの世界 。 “自然”。 319、s。 618、1986。doi: 10.1038/319618a0 。
- ↑ Caetano-Anolles G、Kim HS、Mittenthal Jee。 タンパク質アーキテクチャの系統発生分析から推測される最新の代謝ネットワークの起源 。 「Proc Natl Acad Sci USA」。 104、s。 9358–63、2007。PMID: 17517598 。
- ↑ Schmidt S、Sunyaev S、Bork P、Dandekar T. 代謝産物:経路進化のための援助の手? 。 「トレンドBiochem Sci」。 28、s。 336–41、2003。PMID: 12826406 。
- ↑ ライトS、クラウリスP 大腸菌における代謝酵素の進化のネットワーク分析 。 「BMC Bioinformatics」。 5、s。 15、2004。PMID: 15113413 。
- ↑ Alves R、Chaleil R、Sternberg M. 代謝における酵素の進化:ネットワークの視点 。 「J Mol Biol」。 320、s。 751–70、2002。PMID: 12095253 。
- ↑ Spirin V、Gelfand M、Mironov A、Mirny L. 進化的文脈における代謝ネットワーク:マルチスケール構造とモジュール性 。 „ proc natl acci u s a”。 103、s。 8774–9、2006。PMID: 16731630 。
- ↑ ローレンスJ. 病原体のゲノム戦略における一般的なテーマ 。 「Curr Opin Genet Dev」。 15、s。 584–8、2005。PMID: 16188434 。 Wernengreen J. 良くも悪くも:細胞内相当性と寄生のゲノム的結果 。 「Curr Opin Genet Dev」。 15、s。 572–83、2005。PMID: 16230003 。
- ↑ Paul C、Papp B、Lercher M、Csermely P、Oliver S、Hurst L. 最小限の代謝ネットワークの進化における偶然と必要性 。 “自然”。 440、s。 667–70、2006。PMID: 16572170 。
- ↑ Sterck L、Rombauts S、Vandepoele K、RouzéP、van de Peer Y. 植物にはいくつの遺伝子がありますか(…そしてなぜそこにいるのですか? 。 「Curr Opin Plant Biol」。 10、s。 199–203、2007。PMID: 17289424 。
- ↑ レニーM. 栄養と代謝におけるトレーサーの使用の紹介 。 「Proc Nutr Soc」。 58、s。 935–44、1999。PMID: 10817161 。
- ↑ フォードR. 分子細胞生物学の非線形世界における運動モデルの開発 。 “代謝”。 46、s。 1489–95、1997。PMID: 9439549 。
- ↑ ボロディナI、ニールセンJ. 代謝ネットワークを介してゲノムからin silico細胞まで 。 「Curr Opin Biotechnol」。 16、s。 350–5、2005。PMID: 15961036 。
- ↑ GianChandaniは、Brautgan D、Papin J. システム分析は、生化学ネットワークの統合機能を特徴付けます 。 「トレンドBiochem Sci」。 31、s。 284–91、2006。PMID: 16616498 。
- ↑ Thykaer J、Nielsen J. ベータラクタム生産の代謝工学 。 「Metab Eng」。 5、s。 56–69、2003。PMID: 12749845 。
- ↑ González-Pajuelo M、Meynal-Salens I、Mendes F、Eyrade J、Vacoconciles I、Soucaille P。 グリセロールからの1,3-プロパンジオールの工業生産のためのアセトブチル菌の代謝工学 。 「Metab Eng」。 7、s。 329–36、2005。PMID: 16095939 。
- ↑ KrämerM、Bongaerts J、Bovenberg R、Kremer S、MüllerU、Orf S、Wubbolts M、Raeven L. シキミ酸の微生物生産のための代謝工学 。 「Metab Eng」。 5、s。 277–83、2003。PMID: 14642355 。
- ↑ Koffas M、Roberge C、Lee K、Stephanopoulos G. 代謝工学 。 「Annu Rev Biomed Eng」。 1、s。 535–57、1999。PMID: 11701499 。
- ↑ 代謝 。オンライン語源辞書。 [アクセス2007-02-20]。
- ↑ エクノヤンg。 Santorio Sanctorius(1561–1636) – 代謝バランス研究の創設者 。 「Am J Nephrol」。 19、s。 226-33、1999。PMID: 10213823 。
- ↑ ウィリアムズ、H。S。(1904) 科学の歴史:5巻。 Volume IV:化学および生物科学の現代開発 2007-03-26に取得されたHarper and Brothers(ニューヨーク)
- ↑ Dubos J .. ルイパスツール:科学の無料ランス、ゴランツ。マンチェスターK. L.(1995)ルイパスツール(1822 – 1895)で引用 – チャンスと準備された心。 。 「トレンドバイオテクノロール」。 13、s。 511–515、1951。PMID: 8595136 。
- ↑ Kinne-SaffranE、Can R. 尿素のバイタリズムと統合。 FriedrichWöhlerからHans A. Krebsまで 。 「Am J Nephrol」。 19、s。 290-4、1999。PMID: 10213830 。
- ↑ Eduard Buchnerの1907年 ノーベル講義 Na http://nobelprize.org 2007-03-20にアクセス
- ↑ コーンバーグH. クレブスと彼の三位一体のサイクル 。 „ Nat Rev Mol Cell Biol」。 1、s。 225-8、2000。PMID: 11252898 。
- ↑ Cancer H A、Henseleit K(1932)「動物体の尿素形成に関する研究」。 Z. Physiol。化学。 210、33-66。 クレブスH、ジョンソンW. 動物組織におけるケトン酸の代謝 。 「バイオケムJ」。 31、s。 645-60、1937。PMID: 16746382 。
- ジェレミー・マーク・バーグ、ジョン・L・ティモッツコ、ラーバー・ストライヤー、ニール・D・クラーク、ゾフィア・シュウェイコウスカ・クリスカ、アルトゥル・ジャルモフスキ、ハリナ・オーガスティニアック: 生化学 。ワルシャワ:PWN Scientific Publishing House、2007。ISBN 978-83-01-14379-4 。
- Bハムズ、ナイジェルMフーパー、リラ・フリニエッカ、カジミエルツ・ゼムムニッキ、ハリナ・オーガスニアック: 生化学 。ワルシャワ:PWN Scientific Publishing House、2007。ISBN 978-83-01-13872-1 。
- władysławJ。H. Kunicki-Goldfinger: 細菌の生活 。ワルシャワ:PWN Scientific Publishing House、1994。ISBN 83-01-11323-5 。
- ニコルズ、D。G。Iファーガソン、S。J。 バイオエネルギー2 PWN Scientific Publishing House、Warsaw、1995。ISBN 978-83-01-11661-3
- ランシングM.プレスコット: 微生物学 。 McGraw Hill Higher Education、2002。ISBN 978-0072485226 。
- 1月のワイナー: 生物圏の生命と進化 。ワルシャワ:PWN Scientific Publishing House、2005年。ISBN 83-01-14174-3 。
- 一般情報
- ヒト代謝
- ジェームズ・バグゴット、シャロン・E・デニス: Netbiochemのトピック 。 1994-95。 [アクセス2009-02-06]。 ( 。 )) 。 (人間の代謝ルート、学校レベルに関するガイド)
- マイケル・W・キング: 医療生化学ページ 。 [アクセス2009-02-06]。 ( 。 )) 。 (人間の代謝に関する材料のリソース)
- データベース
- 代謝ルート


Recent Comments