Von Hippla-Lindau Protein-Wikipedia、無料百科事典

von hippla-lindauタンパク質 、 VHLタンパク質 、 pvhl – 遺伝子によってコード化されたタンパク質 VHL 、染色体3では、この遺伝子は抑制性遺伝子であり、その変異は癌の発生につながります。遺伝子のドイツの突然変異 VHL それらは、中枢神経系、バレーボール、副腎コード、膵臓、およびその他の臓器の定義された豊富な血管新生がんである若い年齢での発生を特徴とするフォンヒプラリンダウ疾患を引き起こします。
遺伝子の名前は病気の名前から来ています。 1988年3月にNatureで公開された作品で最初に使用されました。BerndSeizingerと彼の同僚の研究では、局所的な病原性遺伝子が3P25で決定されました。 [2] 。
遺伝子構造 VHL およびVHLタンパク質 [ 編集 | コードを編集します ]
遺伝子 VHL 軌跡3p26-P25の短い染色体肩3に位置しています。遺伝子 VHL 3つのエクソンと642ペアのDNAコーディング原理があります [3] 。最初のエクソン内の遺伝子の2つの開始コドンは、VHLタンパク質形式の2つの形態を作成します。 1つ目には213のアミノ酸があり、遺伝子DNAが最初の開始コドンからmRNAに処方されると発生し、2番目の開始コドンは位置54にあり、コサック開始翻訳のコンセンサスシーケンスが前にあります。この出発点とmRNA翻訳からの遺伝子の転写は、160のアミノ酸で構成されるVHLタンパク質の合成につながります。 19 [4] 高分子量のタンパク質の最初の形態とは異なり、VHL 30 [5] 。 VHLアイソフォームであることがわかりました 30 それは主に細胞質とVHLアイソフォームに見られます 19 細胞核では、これらのタンパク質の機能が同一ではないことを示唆しています [6] [7] 。ミトコンドリアにおけるPVHLの存在は、マークされたGFP抗体を使用して1つの研究で示されています [8] 。タンパク質関数の説明に分子量が無関係である場合、PVHLマーキングが使用されます。
PVHLタンパク質の転写産物は、細胞内の2つのmRNAアイソフォームの細胞で発現し、1つはエクソン2、もう1つはこのエクソンを欠いている分裂に代わるものであることがわかりました。変異した遺伝子を持っている人だから VHL エクソン2の奪取は、完全に吹き飛ばされた症候群のフォンヒプラとリンダウを持っていますが、長いタンパク質アイソフォームのみが抑圧者機能を持っているようです。これまでのところ、代替のスプリントに屈するmRNAが屈したことはまだ証明されていません 無駄に 翻訳 [9] 。

遺伝子のプロモーター配列 VHL 繰り返しが豊富です GC 、お父さんのカセットとシーケンスはありません ccaat ;転写開始は、おそらくSP1タンパク質の推定結合の場所で発生します。最初の開始コドンからの5 ‘DNAスレッドの終わりに向けて60ペアの原理が発生します VHL 。プロモーター配列には、転写因子の結合因子の多くの予想される場所がありますが、これまでのところ、遺伝子発現の検査メカニズムは知られていません VHL 。遺伝子エンコーディングシーケンスは、11のALU繰り返しがある3’utr領域に先行します [11] 。
遺伝子発現 VHL フォンバイポとリンダウ病で癌が発生する組織に限定されません。子宮内生物と成体生物の両方で多数の種類の細胞で発生します [3] 。胚形成中、多数の遺伝子 VHL 実質的にすべての組織タイプは、胎児の生命の6週目から検出され、特に泌尿生殖器、脳、脊髄、感覚ターン、視力器官、気管支呼吸上皮の組織で形成されたVHLのmRNAが特に大量に形成されました。 [9] 。強化された遺伝子発現の分布 VHL したがって、それはフォン・カバとリンダウに占有されている組織に正確に対応していません。 [十] 。発達中の適切な腎臓で( メタネフロス )) VHL 近位チャネルで(クラム細胞癌の出身地から)発現しますが、PVHLタンパク質はヘンルループの細胞でも豊富に合成されています [9] [12番目] 。タンパク質の2つの形態、VHLの発現に違いの証拠はありません 19 私はvhlです 30 異なる胎児組織間 [十] 。

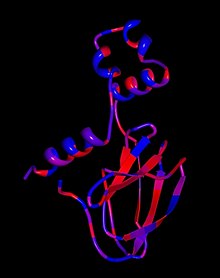

PVHLタンパク質は、PVHLを間接的または直接結合する多数のタンパク質を含む複合体の細胞で機能します。これまでのところ、このタンパク質のグループには以下が含まれていることがわかっています。
- 顔c [13] 、およびエロンギナCエロンギナb [13] 、cul2 [14] I RBX1(ROC1またはHRT1とも呼ばれます) [15] ;複合体には、SSAT2アセチルトランスフェラーゼも含まれます [16] ;
- HIF-1 [17] ;
- Fibronectyna [18] ;
- 微小管を形成するチューブリン [7] ;
- 転写因子SP1 [19] ;
- プロテインキナーゼC(PKC-δ等型、PKC-ζおよびPKC-λ) [20] [21] ;
- Deubikikwityne酵素ファミリー、VDU1およびVDU2のタンパク質(VHLインタラクション脱ユビキチン化酵素-1/2) [22] [23] ;
- p53タンパク質 [24] ;
- RPB1タンパク質、RNA IIポリメラーゼサブユニットの過リン酸化型 [25] ;
- アミノ酸残基1-57内のn-koniecタンパク質を結合するイミディドペプチダーゼ。
- DAD 1(お父さん結合タンパク質1)結合タンパク質、HIVは1-187 PVHLの面積に結合します。
- Filamine(Artin Binding Protein、Archbishop)もこの領域に加わります。
細胞内の高濃度では、PVHLタンパク質分子はアミノ酸残基96-122を介して互いに互いに互いに存在する可能性がありますが、PVHL分子が生理学的濃度で互いに関連していることは証明されていません。 [26] 。
細胞内のPVHLタンパク質関数の範囲には以下が含まれます。
- 基質Bioraを認識するタンパク質として、E3 Ubwikwitinリガーゼの活性を備えたElongin C、Elonggin B、およびKolarlina(CUL2)を含む複合体で機能します。 [27] 、プロテアソームにおけるHIF1-αタンパク質の分解と、HIF1-αによって活性化される遺伝子誘導遺伝子の転写の阻害を引き起こします。
- SP1を介したいくつかの成長因子(VEGFなど)の転写の阻害。
- PKC-δ、PKC-ζ、PKC-λタンパク質キナの非定型ルートを阻害することにより、細胞内シグナル伝達のプロセスを変更する [20] [21] [28] ;
- フィブロネクチンPVHLと結合することにより、細胞外マトリックスの形成に影響を与える可能性があります [十] ;
- 微小管のチューブリンと結合することにより、彼は彼らのデポリミレーションを阻害します。このPVHL関数は、Ubwikwitin E3 VBC複合体のリガーゼの活性に依存しません。これは、省電源Cを結合していない変異したPVHLタンパク質がマイクロチューブを安定化する能力を維持するため [7] ;
- 原因不明の方法では、細胞周期を制御します。セル VHL – / – 彼らは、プラズマ流入を制限するなどの要因で実験的に作用した後、サイクルを離れることができません [29] [30] ;サイクルを離れる能力は、PVHLの導入とともにセルに回復しました。 PVHLサイクルコントロールは多因子であるようです:2つの研究では、PVHLがD1スクレイピングを阻害することがわかりました。 [最初に30] [32] ;別の研究では、PVHLがTGFαを阻害することが示されました。これは、遺伝子が最近HIFタンパク質によって調節されていると特定されています。 [33] 。
ある作業では、PVHLが関連していることが証明されました 無駄に p53タンパク質を使用して、それらを安定化し、mdm2タンパク質によるp53のユビキン化を防止します。さらに、DNA損傷(遺伝毒性ストレス)の条件では、PVHLはp53とp300タンパク質の相互作用、およびその後のp53アセチル化を促進し、このタンパク質の転写活性の増加と細胞周期とアポトーシス吸収の停止の有効性をもたらします。これは、PVHLがサプレッサータンパク質として作用するHIF-αメカニズムからアクセスできないことを望むことができるようです [24] 。
フィラミナとタンパク質結合HIVパパとのPVHL相互作用の重要性は明らかではありません [9] 。
遺伝子のヌクレオチド配列内 VHL 多くのコンセンサスキナーゼ配列が発見されているため、PVHLタンパク質機能の調節はキナーゼリン酸化で構成されている可能性があります [十] 。最近、VHLであることが実証されました 30 グリコーゲンシンターゼ3(GSK3)のキナーゼの基質です 試験管内で 私 無駄に [34] 。酵素リン酸化VHL 30 セリノワ68の残りの部分。以前、タンパク質はSeyna 72でエフォシル化する必要があります。 試験管内で カゼインキナーゼIを触媒します。同じ研究に示されているように、VHLタンパク質を変異させました 30 キナーゼの非サブストレートには、微小管の安定化に関連する機能はありません。
Genの同等物 VHL 動物で [ 編集 | コードを編集します ]
遺伝子配列 VHL 彼女は非常に保守的で、相同質遺伝子とげっ歯類の人間に似ています [35] [36] 。線虫で相同遺伝子が見つかりました caenorhabditis elegans [35] そしてフルーツ蝶ネクタイで [37] 。遺伝子配列の保守主義は、他のタンパク質と結合するドメインを形成する領域で特に大きい [38] 。 PVHL-Elongina B-Elongina C複合体は、酵母のSCF複合体に似ています。 Elongina CとCUL2は、それぞれ酵母タンパク質SKP1とCDC53に似ています。これらのタンパク質の類似性は、Ligasus E3 Ubwikwitinとしてヒト細胞のPVHLタンパク質複合体が機能するという後の確認された仮定によってもたらされました。 [39] 。遺伝子領域 VHL コドン14-53の間でコード8酸性アミノ酸の繰り返し[Gly-X-Glu-Glu-X] 8 (gxeex 8 )、鞭毛のフレアの側面での承認を示す Trypanosoma brucei [35] 。この事実の意味は不明のままです [十] 。
病理学的プロセスにおける役割 [ 編集 | コードを編集します ]
| 説明されている変異の総量 | 823 |
| フレームシフトを読みます | 297(36.08%) |
| 削除 | 235(28.55%) |
| 挿入 | 62(7.53%) |
| 点変異 | 496(60.27%) |
| ミスセンス(感覚の変化) | 399(48.48%) |
| ナンセンス | 97(11.79%) |
| g> a | 29 |
| g> a w cpg | 42 |
| c> t | 65 |
| c> t CPGで | 57 |
| a> t | 十 |
| a> g | 20 |
| a> c | 17 |
| t> g | 20 |
| t> c | 76 |
| t> a | 29 |
| c> a | 30 |
| c> g | 47 |
| g> t | 41 |
| G> c | 29 |
| 複雑な変異 | 2(0.24%) |
ホモ接合マウス VHL – / – 彼らは10.5〜12.5日間の子宮内生活を経験しています。流産の原因は、乱れたベアリングのvibularnesisです。おそらく、両方の対立遺伝子のそのような(非常にまれな)突然変異 VHL 人間では、胚の発達を等しく早期に防止します [41] 。前述のように、胚遺伝子変異 VHL ヒトヘテロ接合体では、ほとんど常にフォンヒプラリンダウ病を引き起こします。個々の症状の頻度による疾患の臨床分裂、主に腎臓の斜角細胞がん、染色腫瘍が消費される腫瘍は、遺伝子の突然変異の性質と相関していることが判明しました。 VHL 。したがって、短いPVHL分子の形成につながる大きな削除と早期翻訳終了は、タイプ1のタイプの特徴であり、ポイント変異、特にミスセンスはタイプ2の原因です [十] 。遺伝子の500を超える異なる胚変異が知られています VHL ;新しい突然変異のすべてのケースは、国際登録簿に報告されます [42] 。
| タイプ | 突然変異のタイプ | 分子欠陥 | HB R | HB CNN | RCC | フェオ | gep |
|---|---|---|---|---|---|---|---|
| 初め | Delecje、ナンセンス | HIF過剰生産と低酸素に対する反応の過剰発現 | + |
+ |
+ |
- |
- |
| 2a | ミスセンス | HIF過剰生産と低酸素に対する反応の過剰発現 微小管の不安定化 |
+ |
+ |
- |
+ |
+ |
| 2b | ミスセンス | HIF過剰生産と低酸素に対する反応の過剰発現 | + |
+ |
+ |
+ |
+ |
| 2c | ミスセンス | フィブロネクチンによるECM作成障害 p53依存メカニズム(?) |
- |
- |
- |
+ |
? |
| HB R-網膜血管腫; HB CNN-中枢神経系の血管腫。 RCC-腎臓細胞癌; PHEO-腫瘍腫瘍; GEP-膵臓神経内分泌腫瘍 | |||||||
遺伝子の体細胞変異 VHL また、散発性腎臓および生殖血管腫にも見られます。 VHL遺伝子の体細胞変異は約50%で満たされます [十] 。それらはまた、胚性血管腫の散発性症例の約30%で発見されましたが、誇張されました VHL この癌の細胞で [十] 。 Loh Gund VHL 散発性微小球膵臓腺腫に記載されています [44] 内膜袋(ELST)の腫瘍 [45] 。突然変異 VHL それらは散発性クロームではまれであり、他の癌では非常にまれです:肺、乳首、卵巣、test丸、子宮頸部、前立腺、大腸、膀胱、革、皮膚(悪性黒色腫)、胸膜、胸肉、胸肉の甲状腺癌がんが [9] 。
最近、胚神経腫の細胞における11Q染色体3セグメントと関連する遺伝子喪失の遠位の欠失が最近示唆されました。 VHL これらの細胞では、病気のより積極的な表現型の原因となる可能性があります [46] 。これは、低酸素症の影響下での未熟な腫瘍の区別の以前の報告をock笑するでしょう。 [47] 。 VHLのmRNAレベルの低下と患者の生存率の低下との間に強い相関が観察されました(P = 0.013)。 VHLの最大の予測値は、NTRK1(TRKA)の発現を示す腫瘍にあるようです [46] 。
VHL – Choroba Von Hippla I Lindaua
RCC-腎臓細胞がん
ecyty-ファミリータイプ2赤血球血症
- ↑ a b c d からのデータに基づいて作成されたモデル Min JH、Yang、H、Ivan、M、Gerrtler、F、Kaelin JR、WG、Pavletich、NP。 HIF-1ALPHA-PVHL複合体の構造:シグナル伝達におけるヒドロキシプロリン認識 。 “化学”。 296. 5574、s。 1886-1889、2002。PMID: 12004076 。 (PDBID = 1LM8)、MBTタンパク質ワークショップを使用。
- ↑ Siezinger Wah、Rzinius LJ、Laminer Jolns、Condere on YujelKäermerCarsdoは、同盟国かもしれません。 腎細胞癌に関連する染色体3の領域へのVon Hippel-Lindau疾患の地図 。 “自然”。 332. 6161、s。 268-269、1988。PMID: 2894613 。
- ↑ a b Latif、F、Tory、K、Gnarra、J、Yao、M、Duh、FM、Orcutt、ML、Stackhouse、T、Kuzmin、I、Modi、W、Geil、Lなど Von Hippel-Lindau疾患腫瘍抑制遺伝子の同定 。 “化学”。 260. 5112、s。 1235、1993。PMID: 8493574 。
- ↑ Schoenfeld、A、Davidowitz、EJ、Burk、Rd。 内部翻訳開始部位から開始された2番目の主要なネイティブVon Hippel-Lindau遺伝子製品は、腫瘍抑制因子として機能します 。 「Proc Nat Acad Sci」。 95、s。 8817-8822、1998。PMID: 9671762 。
- ↑ Iliopoulos、O、Kibel、A、Gray、S、Kaelin、WG、Jr。 ヒトフォンヒッペルリンダウ遺伝子産物による腫瘍抑制 。 「自然医学」。 1、s。 822-826、1995。PMID: 7585187 。
- ↑ Iliopoulos、O、Onh、M、Kaelin、WG、Jr。 PVHL19は、内部翻訳開始から生じるフォンヒッペルリンダウ遺伝子の生物学的に活性な産物です 。 「Proc Natl Acad Sci USA」。 95、s。 11661-11666、1998。PMID: 9751722 。
- ↑ a b c Hergovich、A、Lisztwan、J、Barry、R、Ballschmter、P、Krek、W。 Von Hippel-Lindau腫瘍サプレッサータンパク質PVHLによる微小管安定性の調節 。 「Natl Cell Biol」。 5、s。 64-70、2003。PMID: 12510195 。
- ↑ Shiao、YH、Resau JH、Nagashima K、Anderson LM、Ramakrishna G. Von Hippel-Lindau腫瘍抑制因子は、ミトコンドリアを標的とします 。 「がん解像度」。 60. 11、s。 2816-2819、2000。PMID: 20306593 。
- ↑ a b c d そうです リチャーズ、FM、スコフィールド、PN、フレミング、S、マーハー、ER。 ヒト胚形成中のフォンヒッペルリンダウ疾患腫瘍サプレッサー遺伝子の発現 。 「Hum Mol Genet」。 5、s。 639-644、1996。PMID: 8733131 。
- ↑ a b c d そうです f g h 私 リチャーズ、FM。 フォンヒッペルリンダウ病の分子病理と VHL 遺伝子 。 「分子医学の専門家レビュー」、2001年。
- ↑ それは数字でした。 ヒトフォンヒッペルリンダウ腫瘍抑制遺伝子の全長3 ‘非翻訳領域の分離と特性評価 。 「人間の遺伝学」。 98. 9、s。 666-671、1996。PMID: 8931697 。
- ↑ ケスラー、PM。 ヒト胎児腎臓およびマウス中のフォンヒッペルリンダウ腫瘍抑制遺伝子VHLの発現
胚形成 。 「モル」。 1、pp。457-466、1995。 96091169 。 - ↑ a b Kibel、A、Iliopoulos、O、Decaprio、JA、Kaelin、WG。 von hippel-lindau腫瘍抑制タンパク質のエロンギンBおよびCへの結合 。 “化学”。 269. 5229、s。 1400-1401、1995。PMID: 7660130 。
- ↑ 一時停止A、Lee、S、Worrell、Ra、Chen、DY、Burgess、WH、Linehan、WM、Klausner、Rd。 Von Hippel-Lindau腫瘍抑制遺伝子産物は、タンパク質のCDC53ファミリーのメンバーであるヒトCUL-2と安定した複合体を形成します 。 „ proc natl acci u s a”。 94. 6、s。 2156-2161、1997。PMID: 9122164 。
- ↑ カムラ、T、ミネソタ州コンラッド、ヤン、Q、コナウェイ、RC、コナウェイ、JW。 SCFおよびVHL E3ユビキチンリガーゼのRBX1サブユニットは、Cullins CDC53とCUL2のRUB1修飾を活性化します 。 「遺伝子開発」。 13、s。 2928-2933、1999。
- ↑ Baek、JH、Liu、YV、McDonald、KR、Wesley、JB、Hubbi、Me、Byun、H、Semenza、GL。 SSAT2は、HIF-1alphaを調節するユビキチンリガーゼ複合体の重要な成分です 。 „ J Biol Chem」。 Epub、2007。PMID: 17558023 。
- ↑ Maxwell、PH、Wiesener、MS、Chang、GW、Clifford、SC、Vaux、EC、Cockman、Me、Wykoff、CC、Pugh、CW、Maher、ER、Ratcliffe、PJ。 腫瘍抑制タンパク質VHLは、酸素依存性タンパク質分解の低酸素誘導性因子を標的としています 。 “自然”。 399. 6733、s。 271-275、1999。PMID: 10353251 。
- ↑ Ohh、M、Yauch、RL、Lonergan、KM、Whaley、JM、Stemmer-Rachamimov、AO、Louis、DN、Gavin、BJ、Kley、N、Kaelin、WG、Iliopoulos、O。 Von Hippel-Lindau腫瘍抑制因子タンパク質は、細胞外フィブロネクチンマトリックスの適切な集合に必要です 。 「モルセル」。 1. 7、s。 959-968、1998。PMID: 9651579 。
- ↑ Mukhopadhyay、D、Knebebelmann、B、Cohen、HT、Anant、S、Sukhatme、VP。 Von Hippel-Lindau腫瘍抑制因子遺伝子産物はSP1と相互作用して、血管内皮成長因子プロモーター活性を抑制します 。 「モル細胞biol」。 17、s。 5629-5639、1997。PMID: 97415639 。
- ↑ a b Okuda, H, Saitoh, K, Hirai, S, Iwai, K, Takaki, Y, Baba, M, Minato, N, Ohno, S, Shuin, T. Von Hippel-Lindau腫瘍抑制性タンパク質は、活性化された非定型プロテインキナーゼのユビキチン化を媒介します 。 „ J Biol Chem」。 276. 47、s。 43611-43617、2001。PMID: 11574546 。
- ↑ a b Pal、S、Claffey、KP、Dvorak、HF、Mukhopadhyay、D。 Von Hippel-Lindau遺伝子産物は、タンパク質キナーゼC経路をブロックすることにより、腎細胞癌における血管透過性因子/血管内皮成長因子の発現を阻害します 。 „ J Biol Chem」。 272、s。 27509-27512、1997。PMID: 98010573 。
- ↑ Li、Z、Wang、D、Na、X、Schoen、Sr、Messing、Em、Wu、G。 フォンヒッペルリンダウ腫瘍抑制因子の基質としての脱ユビキチン化酵素サブファミリーの識別 。 「Biochem Biophys Res Commun」。 294. 3、s。 700-709、2002。PMID: 12056827 。
- ↑ Li、Z、Na、X、Wang、D、Schoen、Sr、Messing、Em、Wu、G。 新規脱ユビキチン化酵素のユビキチン化には、Von Hippel-Lindau腫瘍抑制タンパク質への直接結合が必要です 。 „ J Biol Chem」。 277. 7、s。 4656-4662、2002。PMID: 11739384 。
- ↑ a b Roe、J、Kim、H、Lee、S、Kim、S、Cho、E、Youn、H。 Von Hippel-Lindauタンパク質によるp53安定化とトランス活性化 。 「分子細胞」。 22. 3. s。 395-405。 PMID: 16678111 。
- ↑ Kuznetsova AV、Meller J、Schnell PO、Nash JA、Ignacak ML、Sanchez Y、Conaway JW、Conaway RC、Pzyzyk-Krzeska MF。 Von Hippel-Lindauタンパク質は、プロリンヒドロキシル化モチーフを介してRNAポリメラーゼIIの過剰リン酸化の大きなサブユニットに結合し、ユビキチン化のためにそれを標的にします 。 „ proc natl acci u s a”。 100. 5、s。 2706-2711、2003。PMID: 12604794 。
- ↑ Cohen、HT、Ghou、M、Welsh、Am、Zarghamee、S、Scholz、H、Mukhopadhyay、D、Kishida、T、Zbar、B、Knebelmann、B、Sukhatme、VP。 重要なフォンヒッペルリンダウ腫瘍抑制装置ドメインは、SP1結合と自己関連を媒介します 。 「Biochem Biophys Res Commun」。 266. 1、s。 43-50、1999。PMID: 10581162 。
- ↑ Iwai、K、Yamanaka、K、Kamura、T、Minato、N、Conaway、RC、Conaway、JW、Klausner、RD、Pause、A。 活性E3ユビキチンリガーゼ複合体の一部としてのVon Hippel-Lindau腫瘍サプレッサータンパク質の同定 。 „ proc natl acci u s a”。 96. 22、s。 12436-12441、1999。PMID: 10535940 。
- ↑ Datta、K、Nambudripad、R、Pal、S、Zhou、M、Cohen、HT、Mukhopadhyay、D。 腎がんにおけるVon Hippel-Lindau遺伝子産物によるインスリン様成長因子-I媒介細胞シグナル伝達の阻害 。 „ J Biol Chem」。 275. 27. s。 20700-20706。 PMID: 10748176 。
- ↑ Davidowitz、EJ、Schoenfeld、AR、Burk、Rd。 VHLは、細胞細胞と細胞電気のマトリックスシグナル伝達の統合を通じて腎細胞の分化と成長停止を誘導します 。 「モル細胞biol」。 21. 3、s。 865-874、2001。PMID: 11154273 。
- ↑ 一時停止、A、リー、S、ロナーガン、KM、クラウスナー、RD。 Von Hippel-Lindau腫瘍抑制遺伝子は、血清の離脱時に細胞周期の出口に必要です 。 „ proc natl acci u s a”。 95. 3、s。 993-998、1998。PMID: 9448273 。
- ↑ Bindra、RS、Vasselli、Jr、Stearman、R、Linehan、WM、Klausner、Rd。 腎癌細胞におけるサイクリンD1のVHLを介した低酸素調節 。 「がん解像度」。 62. 11、s。 3014-3019、2002。PMID: 12036906 。
- ↑ Zatyka、M、Da Silva、NF、Clifford、SC、Morris、Mr、Wiesener、MS、Eckardt、Ku、Houlston、RS、Richards、FM、Latif、F、Maher、ER。 発現アレイ分析によるフォンヒッペルリンダウ腫瘍抑制遺伝子のサイクリンD1およびその他の新規標的の同定と、フォンヒッペルリンダウ疾患の修飾子としてのサイクリンD1遺伝子型の調査 。 「がん解像度」。 62. 13、s。 3803-11、2002。PMID: 12097293 。
- ↑ グナラトナム、L、モーリー、M、フロノビッチ、A、デ・ポールセン、N、メカイル、K、パロリン、DA、ナムラ、E、ロリマー、IA、リー、s。 低酸素誘導性因子は、形質転換成長因子α/表皮成長因子受容体成長刺激経路を活性化します VHL ( – / – ) 腎細胞癌細胞 。 „ J Biol Chem」。 278. 45、s。 44966-44974、2003。 12944410 。
- ↑ Hergovich、A、Lisztwan、J、Thoma、CR、Wirbelauer、C、Barry、Re、Krek、W。 グリコーゲンシンターゼキナーゼ3による腫瘍抑制因子PVHLのプライミング依存性リン酸化と調節3 。 「モル細胞biol」。 26. 15、s。 5784-96、2006。PMID: 16847331 。
- ↑ a b c Woodward、ER、Buchberger、A、Clifford、SC、Hurst、LD、Affara、Na、Maher、ER。 VHL腫瘍抑制遺伝子の比較配列分析 。 「ゲノミクス」。 65. 3. s。 253-265。 PMID: 10857749 。
- ↑ Gao J、Naglich JG、Laidlaw J、Whaley JM、Seizinger BR、Kley N. ヒトフォンヒッペルリンダウ疾患腫瘍抑制遺伝子と相同性のマウス遺伝子のクローニングと特性評価:ヒトフォンヒッペルリンダウ疾患遺伝子の潜在的な組織化への影響 。 「がん解像度」。 55. 4、s。 743-747、1995。PMID: 7850784 。
- ↑ Adryan、B、Decker、HJ、Papas、TS、Hsu、T。 ショウジョウバエにおける気管の発達とフォン・ヒッペル・リンダウ腫瘍抑制因子ホモログ 。 「癌遺伝子」。 19. 24、s。 2803-2811、200。PMID: 10851083 。
- ↑ Aso, T, Yamazaki, K, Aigaki, T, Kitajima, S. ショウジョウバエvon Hippel-Lindau腫瘍抑制施設はE3ユビキチンリガーゼ活性を持っています 。 「Biochem Biophys Res Commun」。 276. 1、s。 355-361、2000。PMID: 11006129 。
- ↑ Stebbins、CE、Kaelin、WG、Pavletich、NP。 VHL-ELONGINC-ELONGINB複合体の構造:VHL腫瘍抑制機能への影響 。 “化学”。 284. 5413、s。 455-461、1999。PMID: 10205047 。
- ↑ https://web.archive.org/web/200729081185/http://194.167.35.168:2200/4daction/w_part_m [2007年6月24日アクセス]。
- ↑ Gnarra、Jr、Ward、JM、Porter、FD、Wagner、Jr、Devor、De、Grinberg、A、Emmert-Buck、Mr、Westphal、H、Klausner、RD、Linehan、Wm。 欠陥のある胎盤血管新生は、胚の致死性を引き起こします VHL – 欠損マウス 。 „ proc natl acci u s a”。 94、s。 9102-9107、1997。PMID: 97404355 。
- ↑ UMDセントラルWebサイト 。
- ↑ Shuin, T, Yamasaki, I, Tamura, K, Okuda, H, Furihata, M, Ashida, S. Von Hippel-Lindau疾患:分子病理学的基礎、臨床基準、遺伝子検査、腫瘍および治療の臨床的特徴 。 「臨床腫瘍学の日本ジャーナル」。 36. 6、s。 337-343、2006。PMID: 16818478 。
- ↑ Vortmeyer、AO、他 von hippel-lindauの対立遺伝子削除と突然変異( VHL )膵臓ミクロサイシスト腺腫における腫瘍抑制遺伝子 。 「Am J Pathol」。 151、s。 951-956、1997。PMID: 97468663 。
- ↑ Vortmeyer、AO、他 散発性内リンパSAC腫瘍で検出された体細胞フォンヒッペルリンダウ遺伝子変異 。 「がん解像度」。 60、s。 5963-5965、2000。PMID: 20535963 。
- ↑ a b Hoebeeck J、Vandesompele J、Nilsson H、De Preter K、van Roy N、De Smet E、Yigit N、De Paepe A、Laureys G、PåhlmanS、Speleman F. Von Hippel-Lindau腫瘍抑制因子遺伝子発現レベルは、神経芽細胞腫において予後値を持っています 。 「int j Cancer」。 119(3)、s。 624-629、2006。PMID: 16506218 。
- ↑ Attiyeh もしも 私はイニ 、 神経芽細胞腫における染色体1Pおよび11Qの欠失と結果。 、「The New England Journal of Medicine」、353(21)、 2005年 、s。 2243-53、PMID: 16306521 。
- ↑ 代替番号は括弧内で与えられました – しばらくの間、どの遺伝子コドンが最初のものであるかは不明でした。一部の研究者は、ヌクレオチドとアミノ酸に番号を付けました VHL 最初のcDNA(GenBank Accesion no L15409)コドンから VHL ;見て アナミン、彼も、hleth、lame 、、、 rase、lame、lame、molma。 ヒトフォンヒッペルランダウ疾患腫瘍抑制遺伝子のプロモーターの同定 。 「癌遺伝子」。 10、s。 2185-2194、1995。PMID: 7784063 。
- ↑ a b c https://web.archive.org/web/20072908111111 [2007年6月24日アクセス]。
- ↑ ウッドワード、 肥料の遺伝的素因:候補遺伝子の分析 GDNF 、 右 と VHL 。 「Hum Mol Genet」。 6、s。 1051-1056、1997。PMID: 97358578 。
- ↑ これは、トリクロロエテレンへの曝露から生じる可能性があります(Richards、2001)。
- ↑ クロシー、ペンシルベニア州、ENG、C、Ginalska-Malinowska、M、Lennard、TW、Wheeler、DC、Ponder、BA、Maher、ER。 家族性咽頭腫におけるフォンヒッペルリンダウ疾患の分子遺伝診断 。 「遺伝子付きJ」。 32、pp。885-886、1995。PMID: 8592333 。
- ↑ Neumann、HP、Bausch、B、McWhinney、SR、Bender、BU、Gimm、O、Franke、G、Schipper、J、Klisch、J、Althoefer、C、Zerres、K、Januszewicz、A、Eng、C。 非症候性軟質細胞腫における生殖線変異 。 「New Eng J with」。 346、pp。1459-1466、2002。PMID: 12000816 。
- ↑ a b c d Pastore、Y、Jedlickova、K、Guan、Y、Liu、E、Fahner、J、Hasle、H、Prchal、JF、Prchal、JT。 Von Hippel-Lindau腫瘍抑制因子遺伝子および先天性多生学の変異 。 「Am J Hum Genet」。 73、s。 412-419、2003。PMID: 12844285 。
- ↑ a b Kanno, H, Kondo, K, Ito, S, Yamamoto, I, Fujii, S, Torigoe, S, Sakai, N, Hosaka, M, Shuin, T, Yao, M. 散発性中枢神経系血管芽腫におけるフォンヒッペルリンダウ腫瘍抑制遺伝子の体細胞変異 。 「がん解像度」。 54、s。 4845-4847、1994。PMID: 8069849 。
- ↑ マッコイ家の突然変異。
- ↑ Gilcrease、MZ、Schmidt、L、Zbar、B、Truong、L、Rutledge、M、Wheeler、TM。 精巣上体の透明細胞乳頭嚢胞腫における体細胞フォンヒッペルリンダウ変異 。 「ハムパス」。 26、s。 1341-1346、1995。PMID: 8522307 。
- ↑ 税関、H、キシダ、T、Glavac、D、Chen、F、Flush、F、Hofler、H、Latif、F、Lerman、Wed、Zbar、B、Neumann、HPH。 ドイツの黒い森林地域におけるVon Hippel-Lindau(VHL)病気 。 「ハムジェネット」。 95、s。 551-556、1995。PMID: 7759077 。
- ↑ ベンダー、Bu、Eng、C、Olschewski、M、Berger、DP、Laubenberger、J、Altehofer、C、Kirste、G、Orszagh、M、Van Velthoven、V、Miosczka、H、Schmidt、D、Neumann、HPH。 VHL C.505 T-C変異は高齢に関連する浸透度を付与しますが、全体的な死亡率の増加はありません 。 「遺伝子付きJ」。 38、pp。508-514、2001。PMID: 11483638 。
- ↑ Neumann、HP et al。 複数の内分泌新生物を持つ家族の臨床管理における生殖細胞変異の直接的な遺伝子検査の結果、II型 。 「ジャマ」。 274 ,, s。 1149-1151、1995。PMID: 96011708 。
- ↑ Ritter、2000 et al。 フォン・ヒッペル・リンダウ病の変異体としての孤立した家族性褐色細胞腫 。 „ J Clin Endocrinol Metab」。 81、s。 1035-1037、1996。PMID: 96368564 。
- ↑ ang、so、chen、h、gordeuk、vr、sergueeva、ai、polyakova、la、miasnikova、gy、kralovics、r、stockton、dw、prchal、jt。 ロシアの固有の多菌炎症:中の突然変異 VHL 遺伝子 。 「血球分子分子distay」。 28、s。 57-62、
Recent Comments