酸化リン酸化 – ウィキペディア、無料百科事典

酸化的リン酸化 – 減少したヌクレオチドの酸化中に放出されるエネルギーの結果として、代謝跡はATPエネルギーに変換されます。しかし、生物は多くの異なる有機化合物を使用して、それらから代謝的に有用なエネルギーであるATP分子を生成し、主に酸化的リン酸化を行います。このトレイルは、ATP合成の代替方法、つまり発酵と比較して高効率のために支配的です。
酸化的リン酸化中、一連の酸化還元反応の結果として、電子は還元ヌクレオチド、NADHおよびFADHから移動します 2 、酸素電子受容体用。エネルギー貯蔵につながり、ATP合成に使用される反応。真核細胞では、ミトコンドリアに見られるタンパク質複合体で多くの酸化還元反応が起こります。原核生物細胞では、タンパク質複合体は細胞膜にあります。電子の伝達に関与する酵素のセットは、呼吸鎖と呼ばれます。ユーカリオットでは、5つの主要な酵素で構成されており、プロカリオットでは、多くの異なる酵素がドナーと電子受容体として発見されました。
呼吸鎖での電子の輸送中に放出されるエネルギーは、内側のミトコンドリア膜を介して陽子を伝達するために消費されます。このプロセスは、彼の探検家によって化学炎症と呼ばれていました。ポテンシャルエネルギーは、pH勾配と膜全体の電位の形で収集されます。この形式で蓄積されたエネルギーは、ATPシンターゼ酵素複合体によって使用され、濃度勾配に従ってプロトンが膜を通過できるようにします。この酵素は、オルトリン酸の残りの部分をADPに結合することにより生成されるATP化学結合のエネルギー、すなわちリン酸化反応のpHと電気勾配のエネルギーと電気勾配を変換します。 ATP合成反応の独自性は、流れる陽子によって駆動される酵素の部分の回転に関連しており、電気モーターの動作を思い出させます。酵素部分の回転は、ATP分子によって切断されます。
酸化的リン酸化は重要な代謝プロセスですが、その発生は、過酸化水素やフリーラジカルなどの活性酸素型の形成につながり、細胞の破壊、および疾患を引き起こし、おそらく老化を促進します。この代謝跡を実行する酵素は、シアン化物などの多くの薬物や毒に敏感です。
酸化的リン酸化は、ATPシンターゼによって行われた反応において、呼吸鎖と呼ばれる多くの反応と貯蔵エネルギーの消費と呼ばれる多くの反応におけるエネルギーの供給のために発生します。第1回と2回目の反応は結びついています。これは、秒なしでは発生しないことを意味します。電子輸送鎖に関与する多くのコンベアを介して行われる酸素分子の形での受容体のNAPH分子の形でのドナーからの電子の流れは、エネルギープロセスでエネルギーを放出します。 ATP合成は、エネルギーを提供する必要があるエンドエネルギープロセスです。呼吸鎖とATP合成の両方がタンパク質脂質膜で発生します。電子化学勾配と呼ばれる膜全体のイオン濃度の違いの生成のおかげで、電子輸送鎖からのエネルギーがATPシンタゼに伝達されます。膜を介して陽子を運ぶプロセスは化学炎症と呼ばれました [初め] 。膜を通るプロトンの移動は、膜に存在する酵素のおかげで起こり、電子輸送鎖の到着中に片側の陽子と他方の陽子と名前で決定されたプロトンポンプのおかげで起こります。これらの酵素は、電気電流が流れているときに動作します。
彼らの研究の結果として出現したのは、しばしばプロトノモーター力と呼ばれる電気化学勾配は、プロトン濃度の違い(勾配pH)の違いと電位の違い、変位粒子の負荷に起因する電位の違い(膜の片側に負電荷があり、他の正の陽性に)の違いで構成されています。ミトコンドリアの場合、電位差はより重要であり、葉緑体の場合、pH勾配がより重要です [2] 。
ATPシンターゼは電気化学勾配のエネルギーを消費し、膜を通って電荷(陽子)を戻すことができます [3] 。この酵素は、プロトコーター力の形のエネルギーを使用して複合体のタンパク質の1つを回転させる電気モーターのように機能します。売上高により、ATPの生産が可能になります。
酸化的リン酸化中に生成されるエネルギーの量は、発酵中に生成される量よりも間違いなく大きい。グリカリシウムは2つのATP分子のみを提供しますが、10個のNADH分子からの酸化的リン酸化の過程で、完全な酸化で形成された2つのmber [4] 。与えられたATPの量は最大の理論的性能です。実際、一部の陽子は膜に浸透し、ATPのシンタゼをバイパスし、電気化学勾配のATPへの交換能力を低下させます [5] 。
電子と陽子を運ぶ分子 [ 編集 | コードを編集します ]

呼吸鎖の発生は、動きにつながり、陽子と電子の両方です。ドナーからアクセプターへの電子の移動中、プロトンはタンパク質脂質膜を介して移動します。膜と可溶性分子のプロセスがプロセスに関与します。ミトコンドリアの呼吸鎖では、特に電子は、小さな可溶性タンパク質、シトクロムcによってブラシ間空間に伝染します。 [6] 。この分子は、シトクロムの成分であるヘミーに含まれる鉄原子の還元と酸化のおかげで、電子のみを伝達します。シトクロムCは、細菌の末梢空間でも検出されています [7] 。
周期的な還元と酸化のおかげで、親油性電子コンベア、コエンザイムQ10(Q)は、電子とプロトンの両方を透過します。 [8] 。高度に疎水性の特性を持つベンゾシノンの小さな分子は、膜に自由に拡散する可能性があります。 2つの電子と2つの陽子を採用した後、ウビチノンは還元された形に変換されます-ubichinol(qh 2 )。 qh 2 酸化中、彼は2つの電子を伝達し、2つのプロトンを放出し、酸化された形に戻ります – ウビコノン。その結果、膜の片側にある還元場所Qの位置とQH酸化場所のおかげで 2 2回目の後、ウビチノンは膜を介した陽子の移動に参加します [9] 。他のチノンは、電子輸送チェーンのウビチノン、たとえばメナキノンを除いて、いくつかの細菌に参加しています [十] 。
フラビン基の存在のおかげで、呼吸鎖移動電子に関与しているタンパク質 [11] [3] 、鉄硫黄中心とシトクロム。鉄の中心にはいくつかの種類があります。呼吸鎖で最も単純なものは、2つの鉄原子と2つの無機硫黄原子が含まれており、中心[2FE -2S]と呼ばれます。 [4fe -4s]と呼ばれる2番目のタイプには、4つの鉄原子と4つの硫黄原子で作られた立方体が含まれています。中心に含まれる各鉄原子は、通常はグループ-SHシステインであるアミノ酸によって調整されます。補因子を形成する金属イオンは、電子がタンパク質コンベアによって伝達されると減少します。この場合、陽子は電子とともに移動しません。電子は、多くの補因子を移動するときに比較的高い距離をカバーできます [12番目] 。これは、1.4 10未満の距離をすばやくカバーできるトンネル現象によるものです -9 m [13] 。
ユーカリオット電子輸送チェーン [ 編集 | コードを編集します ]
グリコリス、クエン酸サイクル、β酸化などの多くの異化代謝ルートは、NAPHの産生につながります。このコエンザイムには、標準電位が高い電子が含まれており、酸化中に大量のエネルギーが放出されます。セルは、制御されていない方法で、このすべてのエネルギーをすぐに放出するわけではありません。電子は、いくつかの酵素によって酸素に移されたNADHから採取され、誰もがある程度のエネルギーのみを放出します。 IVからの複合体を含むこの酵素のセットは、電子輸送の鎖と呼ばれ、内側のミトコンドリア膜に位置しています。呼吸鎖反応では、Amberも酸化されますが、追加のポイントでトレイルに入ります。
真核細胞では、電子を伝達する酵素、NAPHの酸化中に放出されるエネルギーを使用して、内部ミトコンドリア膜を介して陽子間空間に陽子を伝達し、膜全体に電気化学勾配を生成します。勾配の形で保存されたエネルギーは、ATP産生のためにATPシンターゼによって消費されます。ユーカリオットの酸化的リン酸化ミトコンドリアは、このプロセスの最もよく知られている例です。ミトコンドリアは、ほぼすべてのユーカリオットに存在しますが、通気性のあるnicsed engedプロトゾアなど トリコモナス膣 そして、プロトンが水素に変換されるキノコは、ハイドロゲンソームと呼ばれる修飾されたミトコンドリアに変換されます [14] [15] 。
Oksydoreduktaza Nadh-Koenzym Q(Kompleks I) [ 編集 | コードを編集します ]
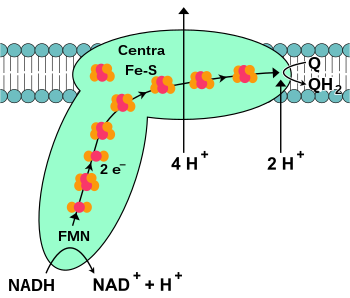
NADHまたは複合体Iのデヒドロゲナーゼとも呼ばれるNADH-ケンザイムQの酸化還元酵素は、電子輸送鎖の最初のタンパク質です [16] 。哺乳類の複合体であり、総質量が約1000 kDaの46のサブユニットで構成される巨大な酵素です [17] 。複合体の構造は細菌でのみよく理解されていました [18] 、ほとんどの生物では、複合体には文字lの形状があり、水平腕が膜にあり、ミトコンドリウムの内部に向けられた垂直に垂直に向けられています。 [19] [20] 。多くのミトコンドリア酵素の場合のように、個々のサブユニットをコードする遺伝子は、細胞核とミトコンドリアゲノムの両方に含まれています。
酵素によって触媒される反応には、NADHからコエンザイムQへの2つの電子の移動が含まれます。 十 (Ubichinon、Q)、親油性関係はミトコンドリア膜で自由に異なります。
電子輸送鎖の開始反応は、NAPH分子と複合体への接続と2つの電子の剥離から始まります。電子は、酵素の一部であるフラビンモノヌクレオチド(FMN)の一部である前立腺群によって複合体に伝染します。 2つの電子をFMNに移すと、還元型FMNHに変換されます 2 。次に、電子はその後の鉄硫黄中心を介して伝達されます。 [18] 。酵素にはセンター[2FE-2S]および[4FE-4S]が含まれています。
2つの電子の複合体を通過すると、4つのプロトンがミトコンドリアマトリックスからインターメンバーに移動します。プロトン移動メカニズムは完全には理解されておらず、おそらく立体構造の変化があり、ミトコンドリアマトリックスの側面に付着したプロトンがインターメンバーの側面に伝達され、そこのタンパク質から切断されます [21] 。鉄の中心を通って採取した電子は、最終的に膜のウビチノン分子に伝達されます [16] 。ウビチノンの還元もプロトン勾配の産生に寄与します。これは、両方の付着された陽子がミトコンドリアマトリックスから採取されており、ウビコノールの作成につながるためです。 2 )。
アンバービチノンの酸化還元酵素(複合体II) [ 編集 | コードを編集します ]

複雑なIIまたはアンバーデヒドロゲナーゼとも呼ばれるアンバービチノンの酸化還元酵素は、電子輸送鎖への電子入力の2番目のポイントです [22] 。これは、クエン酸サイクルの酵素と呼吸鎖の両方である特別な複合体です。複合体IIは4つのサブユニットで構成されており、フラビノアデニンジヌクレオチド(FAD)、シャラゾシアルカセンター、ヘム群の形の補因子を含みます。 [23] [24] 。ウビチノンを減少させながら、フマラン琥珀の酵素酸化。この反応では、NAPHの酸化中よりも少ないエネルギーが放出され、プロトンは内部ミトコンドリア膜を通過しません。複合体IIは、プロトン勾配の生産に参加していません。
寄生性線虫に属するなどのいくつかのユーカリオットで 上昇します 、複合体IIに類似した酵素、フマルンレダクターゼ(オキシドレダクターゼメナキノン:フマラン、QFR -メナキノール:フマレートオキシドレダクターゼ)が逆反応を行い、フマルンを減らします。これにより、寄生虫は嫌気性酸化リン酸化を導入することにより、大腸で普及している嫌気性条件で生き残ることができます。 [25] 。複雑なIIの異常な使用の別の例は、寄生プロトタイプです 熱帯熱マラリア原虫 。この生物では、複合体IIの操作を逆転させると、ウビチノンの繁殖が可能になり、ピリミジン生合成のユニークなプロセスで使用されます。 [26] 。
酸化還元酵素フラボタンパク質電子 – ビチノン伝達 [ 編集 | コードを編集します ]
フラボタンパク質転移電子のデヒドロゲナーゼとも呼ばれるフラボタンパク質酸化還元酵素転移電子ビチノン(オキシド還元酵素ETF-Q)は、電子輸送鎖への入り口の3番目のポイントです。これは、ミトコンドリアマトリックスに見られるフラボタンパク質移動電子から電子を受け取り、膜内のウビチノンのプールを減少させる酵素です。 [27] 。酵素にはフラビナとseelazo-siarkaタイプ[4FE-4S]の中心が含まれていますが、他の複合体とは異なり、それはトランスプレックスタンパク質ではありませんが、膜の内面に関連するままです。 [28] 。
哺乳類では、酵素は脂肪酸、アミノ酸の異化、コリンのβ酸化に重要な役割を果たし、電子受容体デヒドロゲナーゼアシロコアの機能を実行します [29] [30] 。植物では、酸化還元酵素ETF-Qはβ酸化に関与しませんが、長期にわたる暗闇の中で代謝に重要な役割を果たします。 [最初に30] 。
Oksydoreduktaza Koenzym Q-Cytochrom C(Kompleks III) [ 編集 | コードを編集します ]

シトクロムC還元とも呼ばれる酸化還元酵素Q-シトクロムCも、シトクロムBCの複合体と呼ばれます 初め または複雑なIII [32] [33] 。哺乳類では、酵素は2つの同一のサブユニットで構成されており、それぞれが11のタンパク質サブユニット、鉄中心[2FE-2S]と3つのシトクロムで構成されています。 初め および2つのシトクロムb [34] 。シトクロムは、1つ以上のヘム基を含む電子です。複合体IIIに存在する鉄原子は、+2または+3の酸化、+3の酸化、または電子を摂取または投与することに交互に見られます。
複合体IIIによって触媒される反応は、ユビチノールの分子を酸化し、シトクロムCの2つの分子、裾を含むタンパク質の還元で構成され、ミトコンドリア膜にゆるく関連しています。 2つの電子を運ぶケンザイムQ分子とは異なり、Citochom Cは1つの電子のみを移動します。
QH分子から1つの電子のみを伝達する可能性があるため 2 シトクロムCでは、複合体IIIで発生する反応は他の複合体に対する反応よりも複雑であり、Qサイクルと呼ばれる2つの段階で発生します [35] 。最初の段階では、3つの基質、酸化されたQH分子が複合体に関連付けられています 2 、シトクロムCおよびユビチノン分子。ユビチノールから収集された電子の1つは、シトクロムcに伝達されます。2番目の電子は、ミトコンドリアマトリックスの側面に接続されたウビチノンの分子に伝達されます。 QH分子から電子を収集した後に発生する陽子 2 それらはメンバー間スペースにリリースされます。ユビチノン分子は、ミトコンドリアマトリックスからプロトン接続複合体の反対側で縮小しました。ユビチノールから電子を収集した後、複合体から切断されます。同じことがシトクロムの減少で起こります。第2段階では、次のQH分子が酵素に取り付けられています 2 そして再び、電子の1つはシトクロムCに、もう1つは結合したセミチノン分子に移動します。その結果、セミチノンはQHに縮小されます 2 、およびミトコンドリアマトリックスから収集された2つの追加のプロトン。 QH分子が作成されました 2 それは複合体から離れ、酵素の酸化部分で酸化することができます [36] 。
膜の外側のウビチノンへのコエンザイムQの酸化と内側のウビチノールへの還元は、膜を介してプロトンを伝達する効果をもたらし、電気化学勾配の増加につながります [3] 。酸化ウビチノールの2つの段階は、プロトン移動の効率を高めます。 1つのシトクロムC分子のQ減少のサイクルがなければ、膜は1つのプロトンのみを伴うでしょう [3] 。
シトクロムCオキシダーゼ(IV複合体) [ 編集 | コードを編集します ]

複合体IVとも呼ばれるシトクロムCオキシダーゼは、電子輸送鎖の最後の酵素です [37] 。 IVミトコンドリア哺乳類複合体は、13のサブユニット、2つのヘム分子、および金属イオンの形の多くの補因子でできています – 3つの銅原子、1つのマグネシウム、1つの亜鉛 [38] 。
酵素は最終的な呼吸鎖反応を触媒し、電子を酸素に移し、同時に膜を膜に移動する [39] 。電子を摂取した後の酸素は還元され、ミトコンドリアマトリックスの陽子を接続し、水の形成につながります。水の形成の反応におけるミトコンドリアマトリックスの側面での膜を横切る陽子の移動と消費の両方が、プロトン勾配の増加につながります。触媒反応には、方程式によるシトクロムCの酸化と酸素還元が含まれます。
代替レダクターゼとオキシダーゼ [ 編集 | コードを編集します ]
電子輸送鎖の多くの真核生物は、上記の酵素と記録された酵素も撮ることができます。ミトコンドリア植物には、脳空間の側面にNADHまたはNADPHサイトゾルを酸素化できる追加の酵素があり、また電子をユビチノンのプールに移します [40] 。これらの酵素はミトコンドリア膜を介して陽子を伝達しないため、電気化学勾配の生成に関与しません [41] 。
異なる電子輸送チェーンの別の例は、植物、いくつかの菌類、原生生物、そしておそらくいくつかの動物で発生する代替オキシダーゼの発生です [42] [43] この酵素は、電気化学勾配を生成することなく、IIIおよびIV複合体をバイパスして、ユビチノールから酸素に直接電子を伝達し、酸素に伝達します。 [44] 。
(P)Hとウビチノールを超える代替オキシダーゼを備えた電子の輸送は、通常の経路でのATPの合成に無視できる程度になります。短い呼吸鎖の利点は完全には説明されていません。ただし、代替オキシダーゼは、寒く反応性のある酸素形態、病原体感染症、および完全な電子輸送鎖の効率を低下させるその他の要因の形でストレスに応じて生成されることが知られています。 [45] [46] 。電子移動の代替経路は、酸化ストレスと闘うことにより、生物の有害要因に対する耐性を高めることができます [47] 。
複合体の組織 [ 編集 | コードを編集します ]
呼吸鎖錯体を配置する最初のモデルは、内側のミトコンドリア膜に自由で独立した配置を想定していました [48] 。新しい研究では、酵素がスーパーコンプラーまたは「respsrosomes」と呼ばれるより大きな複合体を生成できることが示されています。 [49] 。このモデルでは、複合体は相互に相互作用する酵素のコレクションに組織されています [50] 。そのようなチームは、個々の複合体間で基質を伝達し、電子移動の速度と効率を高めることを可能にします [51] 。哺乳類で発生するスーパー – コンパスでは、一部の元素が他の要素よりも大量に存在する可能性があり、I/II/III/IV複合体とATPシンタゼとの関係は約1:1:3:7:4になります。 [52] 。ただし、スーパーコンパスの存在は確実ではなく、一部の結果は呼吸鎖錯体の分解のそのようなモデルを確認していません [17] [53] 。
プロカリオットの電子輸送チェーン [ 編集 | コードを編集します ]
真核細胞における呼吸鎖の構造と動作の一般的な類似性とは異なり、細菌や考古学において、電子の伝達に関与するはるかに多様な酵素があります。多くの化学物質は電子受容体として使用できます [54] 。ユーカリオットと同様に、後続のコンベアを介した電子の輸送は、膜を介した陽子の伝達と電気化学勾配の生成につながります。酸化的リン酸化のコースは、この例でよく学んだ 大腸菌 しかし、バクテリアでは、Archaanでは、プロセスの過程は比較的ほとんど理解されていません [55] 。
真核生物細胞と原核生物細胞間の酸化的リン酸化の主な違いは、ドナーまたは最終的な電子受容体としての細菌と生物による多くの異なる物質の使用です。これにより、多くの異なる環境条件での原核生物の成長が可能になります [56] 。例えば、 大腸菌 、酸化的リン酸化は、テーブルにリストされている多数の酸化化された還元化合物によって駆動できます。酸化還元電位は、酸化または還元中にエネルギーの量が放出されることを示しており、潜在的な値は減少するのに負のものであり、値は酸化に陽性です。
| 呼吸酵素 | Pary Redoks | 酸化還元電位
[wolty] |
|---|---|---|
| ANTデヒドロゲナーゼ | 炭化水素/アリ | –0.43 |
| ハイドロジェナザ | プロトン/水素 | –0.42 |
| Dehydregenaza Nadh | 彼ら + /nadh | –0,32 |
| デロゲナザグリセロール-3-フォスフォラノワ | DHP/Glicerolo-3-Fosforan | –0,19 |
| ピルビン酸オキシダーゼ | オクタン +二酸化炭素/ピルビン酸 | ? |
| 乳酸脱水素酵素 | ピロネート/Mleczan | –0,19 |
| デヒドロゲナザ d -Aminocvasis | 2-オキソコッカル +アンモニア/ d – アミノクバース | ? |
| グルコン酸デヒドロゲナーゼ | グルコニア/グルコース | –0,14 |
| アンバーのデヒドロゲナーゼ | フマラン/アンバー | +0.03 |
| ウビチノールオキシダーゼ | 酸素/水 | +0.82 |
| 硝酸レダクターゼ | Phytan/Phartyn | +0.42 |
| 亜硝酸レダクターゼ | 亜硝酸塩/アンモニア | +0,36 |
| reduktaza dimetylosulfotlenku | DMSO/DMS | +0,16 |
| トリメチルアミン酸化物還元酵素 | TMAO/TMA | +0,13 |
| 還元酵素フマラン | フマラン/アンバー | +0.03 |
表に示されているように、 大腸菌 ANT、水素、乳酸などの化合物を電子および硝酸塩ドナー、DMSOまたは酸素を代謝エネルギーの生産の受容体として使用できます。 [56] 。酸化還元の可能性が高いということは、反応中により多くのエネルギーを放出することを意味します。珍しいカップルは、酸化還元電位がほぼゼロであるアンバー/フマランで構成されています。したがって、mberの酸化により、酸素またはフマランの形で強い酸化剤が必要です。これらの代替反応は、それぞれアンバーデヒドロゲナーゼまたはフマラン還元酵素によって触媒されます [58] 。
一部のプロカリオットは、低酸化還元電位を持つ化合物のペアを使用しています。たとえば、ような硝化菌の硝化細菌 Nitrobacter 、硝酸塩を硝酸塩に酸化し、電子を酸素に伝達します。反応中に放出される少量のエネルギーは、膜とATP合成を介して陽子を伝達するのに十分ですが、同化プロセスに必要なNADHまたはNADPHを生成するには十分ではありません [59] 。この問題は、亜硝酸塩の酸化還元酵素のおかげで解決されます。これは、電子輸送鎖の反対の経過を強制するために十分に大きな原発性の力を生成し、NAPHの産生を引き起こすために解決されます。 [60] [六十一] 。
プロカリオットによる適切なドナーまたは電子アクセプターの使用は、環境要因によって規制されています [62] 。代謝プロセスの柔軟性は、多くのオキシダーゼとレダクターゼによる同じウビチノン胆汁の使用により可能です。これにより、多くの酵素が中間関係として膜に存在するウビチノンを共有することにより、協力することができます [57] 。モジュラー呼吸鎖により、酵素のセットを簡単に変更できます。
プロカリオットの代謝の多様性に加えて、それらは同じ反応を触媒する異なる酵素のセットも持っています。例えば、 大腸菌 電子受容体として酸素を使用するウビチノンの2つの異なるオキシダーゼがあります。良好な酸素の利用可能性の条件では、細胞は低酸素親和性のオキシダーゼを使用し、各電子に2つのプロトンを伝達できる。酸素レベルが低下すると、細胞は電子を酸素に伝達しますが、これは電気化学勾配の生成に関与しませんが、酸素に対する親和性が高くなります。 [63] 。
複合体Vとも呼ばれるATPシンターゼは、一連の酸化的リン酸化反応に関与する最後の酵素です。この酵素は、原核生物と真核生物の両方で、すべての生きている生物で発見されました [六十四] 。酵素は、ADPおよび無機リン酸塩からのATP合成の電気化学勾配の形で蓄積されたエネルギーを消費します(P 私 )。 1つのATP分子を合成するには、3〜4個の陽子からシンタゼを通過する必要があります [65] [66] 一部のセルでは、条件に応じて、プロトンの数が変化する場合があります [六十七] 。
リン酸化反応は可逆反応であり、反応の方向の1つの利点はプロトノーター力に依存します。プロトン勾配がない場合、ATPシンターゼはATP加水分解反応を行い、膜を介してプロトンを伝達します。ただし、プロトノーター力が十分に大きい場合、反対の反応が発生すると、濃度勾配に応じてプロトンが流れ、ADPはpに接続されます。 私 ATPの生産で [六十四] 。非常によく似た酵素h + -ブチウオールの膜に存在するAHTPaseは、陽子の内部のpHの減少を引き起こし、陽子を運び、同時にATPを加水分解します [68] 。
ATPシンターゼは、大きな複合体で、真菌のような形状です。哺乳類では、合成錯体は16のサブユニットで構成され、総質量は約600 kDaです [69] 。膜タンパク質であるドメインは、fという名前で決定されます o サブユニットCとイオンチャネルで作られたリングが含まれています。球状の部分が付いたコアは、fという名前で決定されます 初め 、ATP合成の場所です。ドメインf 初め 3つのグループに属する6つのサブユニットで構成されています。3つのαサブユニットと3つのβサブユニットです。球状部分を膜ドメインと接続するコアには、サブユニットγのみが含まれています [70] 。 αおよびβサブユニットはヌクレオチドに結合しますが、βサブユニットのみがATP合成の反応を触媒します。ドメインfから突き出ています 初め 、膜に向けられた、それは複合体の主要部分のアンカーサブユニット症候群αおよびβに似たサブユニットです。
イオンチャネルドメインを流れる陽子f o 、サブユニットを回転させますc [71] 。売上高はおそらく、クリフトクラウンCのアミノ酸のイオン化の変化によって引き起こされます。これは、イオンチャネルでサブユニットCのCingを駆動する静電変化を引き起こします [72] 。リングの回転は、αおよびβサブユニットの内部に車軸、γサブユニットを形成します。これは、ロッドの形の長い形のサブユニットのために回転できません。 αおよびβサブユニットの球状構造内のγサブユニットの回転動きは、βサブユニットの活性中心にエネルギーを提供し、ATP分子の分離を引き起こします [七十三] 。

ATP合成反応は、立体構造変化のメカニズムのおかげで発生します。βサブユニットの活性中心は、2つの周期的に変化する状態で発生します [74] 。最初の状態では開いていて、ADPおよびP分子を接続できます 私 。両方の基質が付着すると、タンパク質が形状を変化させ、粒子の接続を引き起こします。作成されたATP分子は、酵素に対して高い親和性を持ち、それに強く関連しています。最後の段階は、酵素を最初の状態に戻し、アクティブ中心が開き、ATP分子を放出し、後続の基質に開いたままにすることです。 ATP合成はエネルギー供給を必要としません。 γサブユニット回転エネルギーは、生成されたATP分子(アクティブ中心の開口)を取り外すために必要です。
一部の細菌と古細菌では、ATP合成は細胞膜を通るプロトンの流れではなく、ナトリウムイオンによって駆動されます。 [75] [76] 。芸術のような メタノコッカス また、シンタゼAを持っています 初め a o 、他の真核生物細菌および細胞に存在するATPシンターゼタンパク質とアミノ酸配列のわずかな類似性を持つ酵素の形態。おそらく一部の種では、シンターゼaの形式です 初め a o ナトリウムイオンによって駆動されます [77] しかし、これは、この形の酵素を持つすべての生物の場合である可能性があります [76] 。
強い酸化剤としての分子酸素は、理想的な最終電子受容体です。ただし、酸素の減少は有害な中間化合物を引き起こす可能性があります [78] 。 4つの電子の移動と4つのプロトンの接続が完全に無害である水の形成につながりますが、1つまたは2つの電子の移動は蜂起、特に反応性スーパーオキシドまたは過酸化物イオンにつながります。
ヒドロキシルラジカルなどの酸素とそれらの反応の産物の反応型は、タンパク質、脂質の酸化を引き起こし、DNAに突然変異を引き起こすため、細胞に非常に有害です。細胞の損傷は病気につながり、老化の原因の1つです [79] [80] 。
シトクロムオキシダーゼ複合体は非常に効果的に酸素の還元を水に還元し、中間化合物を部分的に還元することはほとんどありませんが、呼吸鎖の手術中に少量のオーブンと過酸化物イオンが生成されます。 [81] 。特に重要な反応は、複合体IIIのコエンザイムQの減少であり、間接的な関係として、非常に反応性のあるセミビチノンが発生します。この不安定な化合物は、電子が酸素に直接移動すると、電子の「漏れ」を引き起こし、過酸化物を生成する可能性があります。 [82] 。
反応性酸素型を中和するために、細胞には、ビタミンCやEを含む多数の抗酸化物質、および有害な化合物を分解する酵素があり、細胞を損傷から保護します。反応性酸素型から細胞を保護する酵素には、スーパーオキシドジスムターゼ、カタラーゼ、ペルオキシダーゼが含まれます [78] 。
酸化的リン酸化の発生を阻害するいくつかのよく知られている薬物と毒素があります。これらの各物質は、電子輸送鎖の1つの酵素のみの阻害剤ですが、リンクの1つの阻害はプロセス全体を停止します。たとえば、オリゴマイシンはATPシンターゼ阻害剤であり、ミトコンドリアマトリックスに戻ることができないプロトンを引き起こします。 [83] 。その結果、高濃度勾配を克服できないため、陽子を運ぶ呼吸鎖錯体は動作を停止します。 Nadhは酸化をやめ、クエン酸サイクルは上記の濃度の減少により停止します + 動作に必要なサイクル酵素の一部。
| 関係 | 応用 | 酸化的リン酸化への影響 |
|---|---|---|
| シアン化物、 一酸化炭素 |
毒 | それらは、酸素が付着するシトクロムオキシダーゼで鉄ミエゴ中心をブロックすることにより、呼吸鎖の発生を阻害します。その結果、電子は酸素に移されません [84] 。 |
| oligomycyna | 抗生物質 | ATPシンターゼ複合体の阻害剤であり、ドメインFによるプロトンの伝達をブロックします o [83] 。 |
| CCCP、 2,4-ジニトロフェノール |
ジョノフォアは脂質膜を介してイオンを伝達し、勾配の形成を防ぎます。その結果、ATP電気化学勾配を合成するには十分ではないため、リン酸化が広がります。 [85] 。 | |
| ロテノン | 農薬 | ubichononを結合する場所をブロックすることにより、複合体とウビチノンへの電子の伝達を停止します [八十六] 。 |
| ジャブチャンとソレル | それらは、アンバーデヒドロゲナーゼの複合阻害剤です(複合体II) [八十七] 。 |
すべての酸化的リン酸化阻害剤が毒素であるわけではありません。茶色の脂肪組織では、デコンパットタンパク質(UCP)によって調節されており、プロトン膜を通る移行を可能にするイオンチャネルの機能を満たし、呼吸と合成ATPの拡大につながります [88] 。リン酸化とは無関係の急速な呼吸の発生は、熱の形でエネルギーの放出につながり、冬の睡眠中に動物の適切な体温を維持することができます。タンパク質の拡散は、ストレスに対する細胞反応でより一般的な機能を持つこともあります [89] 。
酸化的リン酸化は、1906年にリン酸が細胞によって行われる発酵に重要な役割を果たすと述べたアーサー・ハーデンによって開始されました。以前は、リン酸プロセスに糖の包含のみが組み込まれていました [不明、明確化] [90] 。 1940年代の初め [91] 、1941年にFritz Lipmannが提案したエネルギーの伝達におけるATPの重要な役割についての論文を確認しました。 [92] 。その後、1949年、モリス・フリードキンとアルバート・L・レーニングは、コエンザイム・ナードが代謝ルート、クエン酸サイクル、およびATP合成を結ぶ化合物であることを証明しました。 [93] 。
今後20年間、ATP生産メカニズムは謎であり、科学者の研究はエネルギーが豊富な中間関係の検索で行われました。これは酸化とリン酸化反応の組み合わせになります。 [九十四] 。パズルは、1961年に化学拡張理論の出版物でピーター・ミッチェルによって解決されました [95] 。当初、ミッチェルの提案は疑問を提起しましたが、実験的確認により、1978年にノーベル賞クリエーターの理論と賞の受け入れにつながりました。 [96] [97] 。さらなる研究は、個々の反応を実行する酵素の決定、分離、および浄化に焦点を当てました。呼吸鎖の複合体の学習に関与する主な研究者の1人は、David E. GreenとATP Efraim Rackerシンターゼ複合体でした [98] 。 ATP合成メカニズムを説明する際のブレークスルーは、1973年にPaul Boyerによって提案された立体構造変化のメカニズムであり、1982年に提示された成分の回転の結果として、酵素によるATP合成を触媒するという形での開発のメカニズムでした。 [99] [74] 。その後、ジョンE.ウォーカーは、酸化的リン酸化に関与している酵素の構造に関する研究を実施しました。ウォーカーとボイヤーは、1997年に彼らの仕事でノーベル賞を受賞しました [100] 。
- ↑ ミッチェルP、モイルJ. 酸化的リン酸化の化学的仮説 。 “自然”。 213(5072)、s。 137–139、1967。doi: 10.1038/213137a0 。 PMID: 4291593 。
- ↑ Dimroth P、Kaim G、Matthey U. F(1)F(O)ATPシンターゼによるATP合成の膜電位の重要な役割 。 „ J. exp。 Biol。」。 203(Pt 1)、s。 51–59、2000。PMID: 10600673 。
- ↑ a b c d シュルツB、チャンS. ミトコンドリア呼吸酵素の構造とプロトンポンピング戦略 。 「Annu Rev Biophys Biomol struct」。 30、s。 23–65、2001。doi: 10.1146/annurev.biophys.30.1.23 。 PMID: 11340051 。
- ↑ リッチPR。 ケイリンの呼吸鎖の分子機械 。 „ Biochem。 Soc。トランス。」。 31(pt 6)、s。 1095–1105、2003。PMID: 14641005 。 [アーカイブ 住所 2013-01-13]。
- ↑ ポーターRK、ブランドMD。 ミトコンドリアプロトンコンダクタンスとH+/O比は、分離された肝細胞の電子輸送速度とは無関係です 。 „ Biochem。 J.」。 310(PT 2)、s。 379–382、1995。PMID: 7654171 。
- ↑ Mathews FS。 シトクロムの構造、機能、進化 。 „ prog。生物生物。モル。 Biol。」。 45(1)、s。 1–56、1985。Doi: 10.1016/0079-6107(85)90004-5 。 PMID: 3881803 。
- ↑ 木材PM。 なぜCタイプのシトクロムが存在するのですか? 。 „ Febs Lett。」。 164(2)、s。 223–226、1983。ドイ: 10.1016/0014-5793(83)80289-0 。 PMID: 6317447 。
- ↑ クレーンFL。 コエンザイムQ10の生化学的機能 。 「アメリカ栄養大学のジャーナル」。 20(6)、s。 591–598、2001。PMID: 11771674 。
- ↑ ミッチェルP. ケイリンの呼吸鎖の概念とその化学的結果 。 “化学”。 206(4423)、s。 1148–1159、1979。doi: 10.1126/science.388618 。 PMID: 388618 。
- ↑ ブリッタ ソバレ 、 ロバートK. 向かって 、 微生物ユビキノン:呼吸、遺伝子調節、酸化ストレス管理における複数の役割 [PDF]、「微生物学(Reading、Engl。)」、145(Pt 8)、1999、s。 1817–1830、doi: 10.1099/13500872-145-8-1817 、PMID: 10463148 [アクセス2009-02-18] 。
- ↑ ジョンソンD、ディーンD、スミスA、ジョンソンM 生物学的鉄硫黄クラスターの構造、機能、および形成 。 「Annu Rev Biochem」。 74、s。 247–281、2005。doi: 10.1146/annurev.biochem.74.082803.133518 。 PMID: 15952888 。
- ↑ Page CC、Moser CC、Chen X、Dutton PL。 生物学的酸化還元における電子トンネルの天然工学の原理 。 “自然”。 402(6757)、s。 47–52、1999。doi: 10.1038/46972 。 PMID: 10573417 。
- ↑ Leys D、スクルトンNS。 生物学の電気回路:タンパク質構造からの新たな原理 。 „ Curr。意見。 struct。 Biol。」。 14(6)、s。 642–647、2004。doi: 10.1016/j.sbi.2004.10.002 。 PMID: 15582386 。
- ↑ Boxma B、de Graaf RM、van der Staay GW、 et al 。 水素を生成する嫌気性ミトコンドリア 。 “自然”。 434(7029)、s。 74–79、2005。Doi: 10.1038/nature03343 。 PMID: 15744302 。
- ↑ van der Giezen M.、Tovar J.、Clark CG。 原生生物と菌類のミトコンドリオン由来のオルガネラ 。 「細胞学の国際レビュー」。 244、s。 175–225、2005。Doi: 10.1016/s0074-7696(05)44005-x 。 PMID: 16157181 。
- ↑ a b J. ハースト 、 呼吸器錯体によるエネルギー変換I-現在の知識の評価 、„ Biochem。 Soc。 Trans。」、Pt 3、33、2005、s。 525–9、doi: 10.1042/BST0330525 、PMID: 15916556 [アーカイブ 住所 2015-11-29] 。
- ↑ a b Lenaz G、Fato R、Genoa M、Bergamini C、Bianchi C、Biondi A. ミトコンドリア複合体I:構造的および機能的側面 。 「Biochim Biophys Acta」。 1757(9–10)、s。 1406–1420、2006。Doi: 10.1016/j.bbabio.2006.05.007 。 PMID: 16828051 。
- ↑ a b Sazanov L.A.、Hinchliffe P.(2006)Thermus Thermophilusの呼吸器複合体Iの親水性領域の構造。 Science 311、1430–1436。
- ↑ Baranova of、Holt PJ、Sazanov LA。 Escherichia coli呼吸器錯体Iの膜ドメインIの投影構造8 。 „ J.モル。 Biol。」。 366(1)、s。 140–154、2007。doi: 10.1016/j.jmb.2006.11.026 。 PMID: 17157874 。
- ↑ Friedrich T、BöttcherB 呼吸器錯体の総構造I:レゴシステム 。 „バイオチム。生物生物。 Acta」。 1608(1)、s。 1–9、2004。doi: 10.1016/j.bbabio.2003.10.002 。 PMID: 14741580 。
- ↑ ブランドU、Cherisher S、Diach S、Twiter K、Zicktermann V. NADHによるプロトンポンピング:ユビキノンオキシドレダクターゼ。酸化還元駆動の立体構造変化メカニズム? 。 „ Febs Lett。」。 545(1)、s。 9–17、2003。doi: 10.1016/s0014-5793(03)00387-9 。 PMID: 12788486 。
- ↑ セッキーニG. 呼吸鎖の複合IIの機能と構造 。 「Annu Rev Biochem」。 72、s。 77–109、2003。doi: 10.1146/annurev.biochem.72.121801.161700 。 PMID: 14527321 。
- ↑ Yankovskaya V.、Horsefield R.、Tornroth S.、Luna-Chavez C.、Miyoshi H.、Leger C.、Byrne B.、Cecchini G.、Iwata S.(2003)コハク酸デヒドロゲナーゼおよび反応性酸素種生成の建築。 Science 299、700–704。
- ↑ Horsefield R、Iwata S、Byrne B. 構造的観点からの複合II 。 „ Curr。タンパク質ペプト。 SCI。」。 5(2)、s。 107–118、2004。doi: 10,2174/1389203043486847 。 PMID: 15078221 。
- ↑ Kitara K、Sighf Hun、Miyadera H、Amino H、Takeo S. Ascaris SuumおよびFalciparumからの寄生虫ミトコンドリアの嫌気性呼吸における複合体IIの役割 。 „バイオチム。生物生物。 Acta」。 1553(1–2)、s。 123–139、2002。doi: 10.1016/S0005-2728(01)00237-7 。 PMID: 11803022 。
- ↑ ペインターHJ、モリシーJM、マザーMW、ヴァイディアAB。 血液段階のマラリア原虫におけるミトコンドリア電子輸送の特定の役割 。 “自然”。 446(7131)、s。 88–91、2007。doi: 10.1038/nature05572 。 PMID: 17330044 。
- ↑ Ramsay RR、Steenkamp DJ、Husain M. 電子トランスファーフラボタンパク質と電子トランスファーフラボタンパク質の反応:ユビキノンオキシドレダクターゼ 。 „ Biochem。 J.」。 241(3)、s。 883–892、1987。PMID: 3593226 。
- ↑ Zhang J、Frerman FE、Kim JJ。 電子移動フラボタンパク質 – ユビキノンオキシドレダクターゼとミトコンドリアウビキノンプールへの電子移動の構造 。 „ Proc。 natl。アカデミー。 SCI。アメリカ合衆国。”。 103(44)、s。 16212–16217、2006。doi: 10.1073/pnas.0604567103 。 PMID: 17050691 。
- ↑ それはケイ、スウェート・カケット、カウクでした。 ラット肝臓ミトコンドリアからの5つの異なるアシルCoAデヒドロゲナーゼの分離と特性。新しい2-メチル分岐鎖アシルCoAデヒドロゲナーゼの同定 。 „ J. Biol。化学。」。 258(2)、s。 1066–1076、1983。PMID: 6401712 。
- ↑ J F。 ルジカ 、 H. 骨 、 呼吸鎖の新しい鉄硫黄フラボタンパク質。脂肪酸ベータ酸化経路の成分 [PDF]、「Journal of Biological Chemistry」、252(23)、1977、s。 8440–5、PMID: 925004 。
- ↑ 石崎K、ラーソンTR、シャウアーN、ファーニーAR、グラハムIA、リーバーCJ。 シロイヌナズナの重要な役割電子トランスファーフラボタンパク質:暗い誘発性飢star中のユビキノンオキシドレダクターゼ 。 “植物細胞”。 17(9)、s。 2587–2600、2005。Doi: 10.1105/TPC.105.035162 。 PMID: 16055629 。
- ↑ Berry E、Guergova-Kuras M、Huang L、Crofts A. シトクロムBC複合体の構造と機能 。 「Annu Rev Biochem」。 69、s。 1005–1075、2000。doi: 10.1146/annurev.biochem.69.1.1005 。 PMID: 10966481 。
- ↑ Crofts AR。 シトクロムBC1複合体:構造のコンテキストでの機能 。 私は”年。牧師Physiol。 “。 66、s。 689-733、2004。doi: 10.1146/annurev.physiol.66.032102.150251 。 PMID: 14977419 。
- ↑ Iwata S、Lee JW、岡田K、 et al 。 11サブユニットウシミトコンドリアシトクロムBC1複合体の完全な構造 。 “化学”。 281(5373)、s。 64–71、1998。doi: 10.1126/science.281.5373.64 。 PMID: 9651245 。
- ↑ B.L. トランプワー 、 陽子Qサイクル。シトクロムBC1複合体による電子移動へのプロトン転座の結合によるエネルギー伝達 [PDF]、「Journal of Biological Chemistry」、265(20)、1990、s。 11409–12、PMID: 2164001 。
- ↑ Hunte C、Palsdottir H、Trumpower BL。 シトクロムBC1複合体におけるプロトン誘発経路とメカニズム 。 „ Febs Lett。」。 545(1)、s。 39–46、2003。doi: 10.1016/s0014-5793(03)00391-0 。 PMID: 12788490 。
- ↑ Calhoun M、Thomas J、Gennis R. 酸化還元駆動プロトンポンプのシトクロムオキシダーゼスーパーファミリー 。 「トレンドBiochem Sci」。 19(8)、s。 325–330、1994。doi: 10.1016/0968-0004(94)90071-X 。 PMID: 7940677 。
- ↑ Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S. 13サブユニット酸化シトクロムCオキシダーゼの2.8 aの全体の構造 。 “化学”。 272(5265)、s。 1136–1144、1996。doi: 10.1126/science.272.5265.1136 。 PMID: 8638158 。
- ↑ Yoshikawa S, Muramoto K, Shinzawa-Itoh K, et al 。 ウシ心シトクロムCオキシダーゼのプロトンポンピングメカニズム 。 „バイオチム。生物生物。 Acta」。 1757(9–10)、s。 1110–1116、2006。doi: 10.1016/j.bbabio.2006.06.004 。 PMID: 16904626 。
- ↑ Rasmusson AG、Bowel KL、Lthon You。 植物ミトコンドリアの代替NAD(P)hデヒドロゲナーゼ 。 「植物生物学の年次レビュー」。 55、s。 23–39、2004。doi: 10.1146/annurev.arplant.55.031903.141720 。 PMID: 15725055 。
- ↑ メンツRI、Day Da。 植物ミトコンドリアからの43 kDaロテノン非感受性ナドデヒドロゲナーゼの精製と特性評価 。 „ J. Biol。化学。」。 271(38)、s。 23117–23120、1996。doi: 10.1074/jbc.271.38.23117 。 PMID: 8798503 。
- ↑ マクドナルドA、vanlerberghe G. 動物の分岐ミトコンドリア電子輸送:いくつかの動物門における代替オキシダーゼの存在 。 「iubmb life」。 56(6)、s。 333–341、2004。doi: 10.1080/1521-6540400400876 。 PMID: 15370881 。
- ↑ Sluse Fe、Jarmuszkiewicz W. 分岐したミトコンドリア呼吸器ネットワークの代替オキシダーゼ:構造、機能、調節、および役割に関する概要 。 „ブラズ。 J. Med。 Biol。解像度。」。 31(6)、s。 733–747、1998。doi: 10.1590/s0100-879×1998000600003 。 PMID: 9698817 。
- ↑ ムーア・アル、シード・JN。 植物ミトコンドリアのシアン化物耐性の代替オキシダーゼの調節と性質 。 „バイオチム。生物生物。 Acta」。 1059(2)、s。 121–140、1991。doi: 10.1016/S0005-2728(05)80197-5 。 PMID: 1883834 。
- ↑ Vanlerberghe GC、McIntosh L. 代替オキシダーゼ:遺伝子から機能まで 。 「植物生理学と植物分子生物学の年次レビュー」。 48、s。 703–734、1997。doi: 10.1146/annurev.arplant.48.1.703 。 PMID: 15012279 。
- ↑ Ito Y, Saisho D, Nakazono M, Tsutsumi N, Hirai A. イネ中のタンデムアレンジの代替オキシダーゼ遺伝子の転写レベルは、低温で増加します 。 “遺伝子”。 203(2)、s。 121–129、1997。doi: 10.1016/S0378-1119(97)00502-7 。 PMID: 9426242 。
- ↑ Maxwell DP、Wang Y、McIntosh L. 代替オキシダーゼは、植物細胞のミトコンドリア反応性酸素産生を低下させます 。 „ Proc。 natl。アカデミー。 SCI。アメリカ合衆国。”。 96(14)、s。 8271–8276、1999。Doi: 10.1073/pnas.96.14.8271 。 PMID: 10393984 。
- ↑ レナズG. ミトコンドリアコエンザイムQプールの重要な評価 。 „ Febs Lett。」。 509(2)、s。 151–155、2001。doi: 10.1016/s0014-5793(01)03172-6 。 PMID: 11741580 。
- ↑ Heinemeyer J、Braun HP、Boekema EJ、Kouril R. 酵母ミトコンドリアからのシトクロムcレダクターゼ/オキシダーゼスーパーコンプレックスの構造モデル 。 „ J. Biol。化学。」。 282(16)、s。 12240–12248、2007。doi: 10.1074/jbc.m610545200 。 PMID: 17322303 。
- ↑ シェーガーH、ファイファーK. 酵母と哺乳類のミトコンドリアの呼吸鎖における超complexes 。 „ Embo J.」。 19(8)、s。 1777–1783、2000。doi: 10.1093/embs/19.8.1777 。 PMID: 10775262 。
- ↑ シェーガーH. ミトコンドリアとバクテリアの呼吸鎖のスーパーコンプレックス 。 „バイオチム。生物生物。 Acta」。 1555(1–3)、s。 154–159、2002。doi: 10.1016/S0005-2728(02)00271-2 。 PMID: 12206908 。
- ↑ シェーガーH、ファイファーK. 牛の心臓ミトコンドリアにおける酸化リン酸化複合体I-Vの比と呼吸鎖のスーパーコンプレックスの組成 。 „ J. Biol。化学。」。 276(41)、s。 37861–37867、2001。doi: 10.1074/jbc.m106474200 。 PMID: 11483615 。
- ↑ Gupta S、Wu ES、Hoechli L、 et al 。 ミトコンドリア内膜の酸化還元成分の横方向の拡散、衝突頻度、および電子移動の関係 。 „ Proc。 natl。アカデミー。 SCI。アメリカ合衆国。”。 81(9)、s。 2606–2610、1984。doi: 10.1073/pnas.81.9.2606 。 PMID: 6326133 。
- ↑ ニールソンkh。 訪問後の微生物学:新しいアプローチ、新しいデータ、新しい洞察 。 「生物の起源と生物圏の進化:生命の起源研究のための国際協会の雑誌」。 29(1)、s。 73–93、1999。doi: 10.1023/A:1006515817767 。 PMID: 11536899 。
- ↑ SchäferG、Engelhard M、MüllerV。 古細菌の生物エネルギー 。 „マイクロビオール。モル。 Biol。 Rev.」。 63(3)、s。 570–620、1999。PMID: 10477309 。
- ↑ a b Ingledew WJ、Poole RK。 大腸菌の呼吸鎖 。 „マイクロビオール。 Rev.」。 48(3)、s。 222–271、1984。PMID: 6387427 。
- ↑ a b G、Bongaerts J 大腸菌の代替呼吸経路:電子受容体に応答したエネルギーと転写調節 。 „バイオチム。生物生物。 Acta」。 1320(3)、s。 217–234、1997。doi: 10.1016/S0005-2728(97)00034-0 。 PMID: 9230919 。
- ↑ Cecchini G、SchröderI、Gunsalus RP、Maklashina E. 大腸菌のコハク酸デヒドロゲナーゼとフマレート還元酵素 。 „バイオチム。生物生物。 Acta」。 1553(1–2)、s。 140–157、2002。doi: 10.1016/S0005-2728(01)00238-9 。 PMID: 11803023 。
- ↑ 金曜日A、ボックE ニトロバクターの省エネ 。 「FEMS微生物学の文字」。 66(1–3)、s。 157–162、1990。doi: 10.1111/j.1574-6968.1990.tb03989.x 。
- ↑ Starkenburg Sr、Chain PS、Akuvedra-Soto LA、 et al 。 化学リトオート栄養栄養亜硝酸酸化細菌Nitrobacter Winogradskyi NB-255のゲノム配列 。 „ Appl。環境。マイクロビオール。」。 72(3)、s。 2050–2063、2006。doi: 10.1128/AEM.72.3.2050-2063.2006 。 PMID: 16517654 。
- ↑ Yamanaka T, Fukumori Y. ニトロバクターwinogradskyiの亜硝酸酸化システム 。 „ Microbiol。 Rev.」。 4(4)、s。 259–270、1988。PMID: 2856189 。
- ↑ Iuchi S、Lin EC。 遺伝子発現による大腸菌の酸化還元環境への適応 。 „モル。マイクロビオール。」。 9(1)、s。 9–15、1993。doi: 10.1111/j.1365-2958.1993.tb01664.x 。 PMID: 8412675 。
- ↑ M.W. カルホーン 私はイニ 、 大腸菌のエネルギー効率:好気性呼吸鎖の成分における変異の影響 [PDF]、「Journal of Bacteriology」、175(10)、1993、s。 3020–5、PMID: 8491720 。
- ↑ a b ボイヤーPD。 ATPシンターゼ – 素晴らしい分子機械 。 „ Annu。 Rev. Biochem。」。 66、s。 717–749、1997。doi: 10.1146/annurev.biochem.66.1.717 。 PMID: 9242922 。
- ↑ Van Walraven HS、Strotmann H、Schwarz O、Rumberg B. チオール調節葉緑体と2つのシアノバクテリア株からのATPシンターゼのH+/ATP結合比は4つです 。 „ Febs Lett。」。 379(3)、s。 309–313、1996。doi: 10.1016/0014-5793(95)01536-1 。 PMID: 8603713 。
- ↑ Yoshida M, Muneyuki E, Hisabori T. ATPシンターゼ – セルの素晴らしい回転エンジン 。 „ナット。 Rev. Mol。 Cell Biol。」。 2(9)、s。 669–677、2001。doi: 10.1038/35089509 。 PMID: 11533724 。
- ↑ Schemidt RA、Qu J、Williams JR、Brusilow WS。 F0遺伝子の発現および大腸菌のF1F0 ATPaseのCサブユニットの化学量論に対する炭素源の効果 。 „ J.バクテリオール。」。 180(12)、s。 3205–3208、1998。PMID: 9620972 。
- ↑ Nelson N、Perzov N、Cohen A、Hagai K、Padler V、Nelson H. V-ATPaseによるプロトン動力力生成の細胞生物学 。 „ J. exp。 Biol。」。 203(Pt 1)、s。 89–95、2000。PMID: 10600677 。
- ↑ Rubinstein JL、Walker JE、Henderson R. 電子凍結筋鏡検査によるミトコンドリアATPシンターゼの構造 。 „ Embo J.」。 22(23)、s。 6182–6192、2003。doi: 10.1093/EMBS/CDG608 。 PMID: 14633978 。
- ↑ レスリーAG、ウォーカー。 F1-ATPaseの構造モデルと回転触媒の影響 。 „哲学。トランス。 R. Soc。 Lond。、B、Biol。 SCI。」。 355(1396)、s。 465–471、2000。doi: 10.1098/rstb.2000.0588 。 PMID: 10836500 。
- ↑ Noji H, Yoshida M. セル内のロータリーマシン、ATPシンターゼ 。 „ J. Biol。化学。」。 276(3)、s。 1665–1668、2001。doi: 10.1074/jbc.R000021200 。 PMID: 11080505 。
- ↑ Capaldi R、Aggeler R。 F(1)F(0)タイプATPシンターゼのメカニズム、生物学的ロータリーモーター 。 「トレンドBiochem Sci」。 27(3)、s。 154–160、2002。doi: 10.1016/S0968 -0004(01)02051-5 。 PMID: 11893513 。
- ↑ Dimroth P、von Ballmos C、Meier T。 F-ATPシンターゼの触媒および機械的サイクル。 Cycles Reviewシリーズで4番目 。 「embo rep」。 7(3)、s。 276–282、2006。doi: 10.1038/sj.embor.7400646 。 PMID: 16607397 。
- ↑ a b グラスMJ、マイヤーズはい、ボイヤーPD。 牛肉心臓ミトコンドリアF1アデノシントリホスファターゼの触媒部位協調性。初期速度、結合中間体、および酸素交換測定値と交互の3サイトモデルの相関 。 „ J. Biol。化学。」。 257(20)、s。 12030–12038、1982。PMID: 6214554 。
- ↑ Dimroth P. 細菌ナトリウムイオン結合エネルギー 。 「アントニー・ヴァン・レウウェンフック」。 65(4)、s。 381–395、1994。doi: 10.1007/bf00872221 。 PMID: 7832594 。
- ↑ a b ビーカーB、ミュラーV。 Delta Mu Na+は、Archaeon MethanosarcinaMazeiGö1の膜小胞でのDelta Mu Na(+) – 翻訳F1F0-ATPシンターゼを介してATPの合成を駆動します。 。 „ J.バクテリオール。」。 176(9)、s。 2543–2550、1994。PMID: 8169202 。
- ↑ ミュラーV. 古細菌A1A0 ATPaseのモーターの例外的な変動:6〜13イオン結合部位を含む多量体からモノマーローターまで 。 „ J. BioEnerg。 Biomembr。」。 36(1)、s。 115–125、2004。doi: 10.1023/b:job.0000019603.68282.04 。 PMID: 15168615 。
- ↑ a b デイビスK. 酸化ストレス:好気性生活のパラドックス 。 「Biochem Soc Symp」。 61、s。 1–31、1995。PMID: 8660387 。
- ↑ ラタンはい。 生物学的老化の理論:遺伝子、タンパク質、およびフリーラジカル 。 „フリーラディック。解像度。」。 40(12)、s。 1230–1238、2006。doi: 10,1080/10715760600911303 。 PMID: 17090411 。
- ↑ Valko M、Leibfritz D、Moncol J、Cronin MT、Mazur M、Telser J. 正常な生理学的機能とヒト疾患におけるフリーラジカルと抗酸化物質 。 „ int。 J. Biochem。 Cell Biol。」。 39(1)、s。 44–84、2007。doi: 10.1016/j.biocel.2006.07.001 。 PMID: 16978905 。
- ↑ ラハS、ロビンソンB ミトコンドリア、酸素フリーラジカル、病気、老化 。 「トレンドBiochem Sci」。 25(10)、s。 502–508、2000。doi: 10.1016/s0968 -0004(00)01674-1 。 PMID: 11050436 。
- ↑ フィンケルT、ホルブルックニュージャージー州。 酸化剤、酸化ストレス、老化の生物学 。 「自然」、s。 239–247、2000。doi: 10.1038/35041687 。 PMID: 11089981 。
- ↑ a b Joshi S、Huang YG。 ウシ心ミトコンドリアのATPシンターゼ複合体:タンパク質を付与するオリゴマイシン感受性は、ジシクロヘキシルカルボジミド感受性ATPaseに不可欠です 。 „バイオチム。生物生物。 Acta」。 1067(2)、s。 255–258、1991。doi: 10.1016/0005-2736(91)90051-9 。 PMID: 1831660 。
- ↑ Tsubaki M. ウシ心臓シトクロムCオキシダーゼのFEA3キューブ両核部位へのシアン化物結合のフーリエ変換赤外線研究:二核部位でのレドックス結合立体構造変化の意味 。 “生化学”。 32(1)、s。 164–173、1993。doi: 10.1021/bi00052a022 。 PMID: 8380331 。
- ↑ Heytler pg。 酸化的リン酸化のuncouplers 。 „メタ。エンツィモール。」。 55、s。 462–442、1979。Doi: 10.1016/0076-6879(79)55060-5 。 PMID: 156853 。
- ↑ ランバートAJ、ブランドMD。 キノン結合部位の阻害剤は、ミトコンドリアNADHからの急速なスーパーオキシド産生を可能にします:ユビキノンオキシドレダクターゼ(複合体I) 。 „ J. Biol。化学。」。 279(38)、s。 39414–39420、2004。doi: 10.1074/jbc.m406576200 。 PMID: 15262965 。
- ↑ Dervartanian DV、Veeger C. コハク酸デヒドロゲナーゼに関する研究。 I.精製酵素のスペクトル特性と酵素競争阻害剤複合体の形成 。 „バイオチム。生物生物。 Acta」。 92、s。 233–247、1964年11月。PMID: 14249115 。
- ↑ Ricqure D、Shouildud F. 分離タンパク質ホモログ:UCP1、UCP2、UCP3、STUCP、ATUCP 。 „ Biochem。 J.」。 345 pt 2、s。 161–179、2000。doi: 10.1042/0264-6021:3450161 。 PMID: 10620491 。
- ↑ BoreckýJ、Vercesi ae。 ミトコンドリアタンパク質と代替オキシダーゼの植物脱共役ミトコンドリアタンパク質:エネルギー代謝とストレス 。 「ビリスク。担当者」。 25(3-4)、S。 271-286、2005。Doi: 10.1007/s10540-005-2889-2 。 PMID: 16283557 。
- ↑ ハーデンA、若いWJ。 酵母ジュースのアルコール発酵 。 „ Proc。 R. Soc。 (Lond。)」。 B(77)、s。 405–420、1906。
- ↑ Kalckar HM。 概念の起源酸化的リン酸化 。 „モル。細胞。 Biochem。」。 5(1–2)、s。 55–63、1974。doi: 10.1007/BF01874172 。 PMID: 4279328 。
- ↑ リップマンF. リン酸塩エネルギーの代謝生成と利用 。 「adv enzymol」。 1、s。 99–162、1941。
- ↑ フリードキンM、リーンガーAL。 ジヒドロジフォスホピリジンヌクレオチドと酸素の間の電子輸送に結合した無機リン酸のエステル化 。 „ J. Biol。化学。」。 178(2)、s。 611–623、1949。
- ↑ スレーターEC。 呼吸鎖におけるリン酸化のメカニズム 。 “自然”。 172(4387)、s。 975、1953。Doi: 10.1038/172975A0 。
- ↑ ミッチェルP. 化学浸潤タイプのメカニズムによる電子および水素移動へのリン酸化の結合 。 “自然”。 191(4784)、s。 144、1961。doi: 10.1038/191144a0 。 PMID: 13771349 。
- ↑ ミルトンH.サイアーJR: ピーター・ミッチェルと重要な力 。 [アクセス2007-08-23]。
- ↑ ピーター・ミッチェル: デイビッド・ケイリンの呼吸鎖の概念とその化学的結果 。 [の:] ノーベル講義 [オンライン]。ノーベル財団、1978。[2007-07-21にアクセス]。
- ↑ プルマン私、ペネフスキーHS、ダッタA、ラッカーE 酸化リン酸化を触媒する酵素の部分分解能。 I.可溶性、ジニトロフェノール刺激アデノシントリホスファターゼの精製と特性 。 „ J. Biol。化学。」。 235(11)、s。 3322–3329、1960。
- ↑ Boyer PD、Cross RL、Momsen W. 酸素交換反応の分子説明に基づく酸化的リン酸化におけるエネルギー結合のための新しい概念 。 „ Proc。 natl。アカデミー。 SCI。アメリカ合衆国。”。 70(10)、s。 2837–2839、1973。doi: 10.1073/PNAS.70.10.2837 。 PMID: 4517936 。
- ↑ 1997年のノーベル化学賞 。ノーベル財団。 [アクセス2007-07-21]。
- ジェレミー・マーク・バーグ、ジョン・L・ティモッツコ、ラーバー・ストライヤー、ニール・D・クラーク、ゾフィア・シュウェイコウスカ・クリスカ、アルトゥル・ジャルモフスキ、ハリナ・オーガスティニアック: 生化学 。ワルシャワ:PWN Scientific Publishing House、2007。ISBN 978-83-01-14379-4 。







Recent Comments