Benetzung – Wikipedia
Fähigkeit einer Flüssigkeit, Kontakt mit einer festen Oberfläche aufrechtzuerhalten


Benetzung ist die Fähigkeit einer Flüssigkeit, den Kontakt mit einer festen Oberfläche aufrechtzuerhalten, die aus intermolekularen Wechselwirkungen resultiert, wenn beide zusammengebracht werden. Der Benetzungsgrad (Benetzbarkeit) wird durch ein Kraftgleichgewicht zwischen Adhäsions- und Kohäsionskräften bestimmt. Das Benetzen befasst sich mit drei Phasen der Materie: Gas, Flüssigkeit und Feststoff. Aufgrund des Aufkommens vieler Nanomaterialien in den letzten zwei Jahrzehnten (z. B. Graphen,) ist es heute ein Schwerpunkt in Studien der Nanotechnologie und der Nanowissenschaften.[1]Kohlenstoffnanoröhre, Bornitrid-Nanomesh[2]).
Die Benetzung ist wichtig für die Bindung oder Haftung von zwei Materialien.[3] Die Benetzung und die Oberflächenkräfte, die die Benetzung steuern, sind auch für andere verwandte Effekte verantwortlich, einschließlich Kapillareffekten.
Es gibt zwei Arten der Benetzung: nicht reaktive Benetzung und aktive Benetzung.[4][5]
Erläuterung[edit]
Adhäsionskräfte zwischen einer Flüssigkeit und einem Feststoff bewirken, dass sich ein Flüssigkeitstropfen über die Oberfläche ausbreitet. Kohäsionskräfte in der Flüssigkeit führen dazu, dass sich der Tropfen zusammenballt und Kontakt mit der Oberfläche vermieden wird.
| Abb. 2 | Kontaktwinkel | Grad von Benetzung |
Wechselwirkungsstärke | |
|---|---|---|---|---|
| Fest-flüssig | Flüssigkeit – Flüssigkeit | |||
| S. | θ = 0 | Perfekte Benetzung | Stark | Schwach |
| C. | 0 <θ <90 ° | Hohe Benetzbarkeit | Stark | Stark |
| Schwach | Schwach | |||
| B. | 90 ° ≤ θ <180 ° | Geringe Benetzbarkeit | Schwach | Stark |
| EIN | θ = 180 ° | Nicht benetzend | Schwach | Stark |
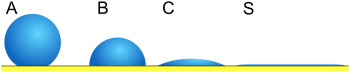
Der Kontaktwinkel (θ), wie in Abbildung 1 dargestellt, ist der Winkel, unter dem die Grenzfläche zwischen Flüssigkeit und Dampf auf die Grenzfläche zwischen Feststoff und Flüssigkeit trifft. Der Kontaktwinkel wird durch das Gleichgewicht zwischen Adhäsions- und Kohäsionskräften bestimmt. Wenn die Tendenz eines Tropfens, sich über eine flache, feste Oberfläche auszubreiten, zunimmt, nimmt der Kontaktwinkel ab. Somit liefert der Kontaktwinkel ein inverses Maß für die Benetzbarkeit.[6]
Ein Kontaktwinkel von weniger als 90 ° (niedriger Kontaktwinkel) zeigt normalerweise an, dass die Benetzung der Oberfläche sehr günstig ist und sich die Flüssigkeit über einen großen Bereich der Oberfläche verteilt. Kontaktwinkel von mehr als 90 ° (hoher Kontaktwinkel) bedeuten im Allgemeinen, dass die Benetzung der Oberfläche ungünstig ist, so dass die Flüssigkeit den Kontakt mit der Oberfläche minimiert und ein kompaktes Flüssigkeitströpfchen bildet.
Für Wasser kann eine benetzbare Oberfläche auch als hydrophil und eine nicht benetzbare Oberfläche als hydrophob bezeichnet werden. Superhydrophobe Oberflächen haben Kontaktwinkel von mehr als 150 ° und zeigen fast keinen Kontakt zwischen dem Flüssigkeitstropfen und der Oberfläche. Dies wird manchmal als “Lotus-Effekt” bezeichnet. Die Tabelle beschreibt unterschiedliche Kontaktwinkel und ihre entsprechenden Fest / Flüssig- und Flüssig / Flüssig-Wechselwirkungen.[7] Für Nichtwasserflüssigkeiten wird der Begriff lyophil für Bedingungen mit geringem Kontaktwinkel verwendet und lyophob wird verwendet, wenn sich höhere Kontaktwinkel ergeben. In ähnlicher Weise gelten die Begriffe omniphob und omniphil sowohl für polare als auch für unpolare Flüssigkeiten.
Hochenergetische vs. energiearme Oberflächen[edit]
Flüssigkeiten können mit zwei Haupttypen fester Oberflächen interagieren. Traditionell wurden feste Oberflächen in energiereiche und energiearme Feststoffe unterteilt. Die relative Energie eines Festkörpers hat mit der Masse des Festkörpers selbst zu tun. Feststoffe wie Metalle, Gläser und Keramiken werden als “harte Feststoffe” bezeichnet, da die chemischen Bindungen, die sie zusammenhalten (z. B. kovalent, ionisch oder metallisch), sehr stark sind. Daher ist eine große Energiemenge erforderlich, um diese Feststoffe aufzubrechen (alternativ ist eine große Energiemenge erforderlich, um die Masse zu schneiden und zwei separate Oberflächen herzustellen), so dass sie als “energiereich” bezeichnet werden. Die meisten molekularen Flüssigkeiten erreichen eine vollständige Benetzung mit energiereichen Oberflächen.
Die andere Art von Feststoff sind schwache Molekülkristalle (z. B. Fluorkohlenwasserstoffe, Kohlenwasserstoffe usw.), bei denen die Moleküle im Wesentlichen durch physikalische Kräfte (z. B. Van-der-Waals-Kräfte und Wasserstoffbrückenbindungen) zusammengehalten werden. Da diese Feststoffe durch schwache Kräfte zusammengehalten werden, ist eine sehr geringe Energiemenge erforderlich, um sie zu brechen, weshalb sie als “energiearm” bezeichnet werden. Je nach Art der gewählten Flüssigkeit können energiearme Oberflächen eine vollständige oder teilweise Benetzung ermöglichen.[8][9]
Es wurde über dynamische Oberflächen berichtet, die bei Anwendung geeigneter Reize Änderungen der Oberflächenenergie erfahren. Beispielsweise wurde gezeigt, dass eine Oberfläche mit photonengetriebenen Molekülmotoren Änderungen im Wasserkontaktwinkel erfährt, wenn zwischen bistabilen Konformationen unterschiedlicher Oberflächenenergien umgeschaltet wird.[10]
Benetzung energiearmer Oberflächen[edit]
Niedrigenergieoberflächen interagieren hauptsächlich mit Flüssigkeiten durch dispersive Kräfte (van der Waals). William Zisman brachte mehrere wichtige Ergebnisse hervor:[11]
Zisman beobachtete, dass cos θ linear mit der Oberflächenspannung (γ) ansteigtLV) der Flüssigkeit nahm ab. So konnte er eine lineare Funktion zwischen cos θ und der Oberflächenspannung (γ) herstellenLV) für verschiedene organische Flüssigkeiten.
Eine Oberfläche ist bei γ benetzbarerLV und θ ist niedrig. Zisman nannte den Schnittpunkt dieser Linien, wenn cos θ = 1 ist, die kritische Oberflächenspannung (γ)c) dieser Oberfläche. Diese kritische Oberflächenspannung ist ein wichtiger Parameter, da sie nur für den Feststoff charakteristisch ist.
Wenn man die kritische Oberflächenspannung eines Festkörpers kennt, ist es möglich, die Benetzbarkeit der Oberfläche vorherzusagen.[6]
Die Benetzbarkeit einer Oberfläche wird durch die äußersten chemischen Gruppen des Feststoffs bestimmt. Unterschiede in der Benetzbarkeit zwischen Oberflächen mit ähnlicher Struktur sind auf Unterschiede in der Packung der Atome zurückzuführen. Wenn eine Oberfläche beispielsweise verzweigte Ketten aufweist, weist sie eine schlechtere Packung auf als eine Oberfläche mit geraden Ketten. Eine niedrigere kritische Oberflächenspannung bedeutet eine weniger benetzbare Materialoberfläche.
Ideale feste Oberflächen[edit]
Eine ideale Oberfläche ist flach, starr, perfekt glatt, chemisch homogen und weist eine Kontaktwinkelhysterese von Null auf. Eine Nullhysterese impliziert, dass die vor- und zurückgehenden Kontaktwinkel gleich sind. Mit anderen Worten existiert nur ein thermodynamisch stabiler Kontaktwinkel. Wenn ein Flüssigkeitstropfen auf eine solche Oberfläche gegeben wird, wird der charakteristische Kontaktwinkel wie in 1 dargestellt gebildet. Außerdem kehrt der Tropfen auf einer idealen Oberfläche in seine ursprüngliche Form zurück, wenn er gestört wird.[7][11] Die folgenden Ableitungen gelten nur für ideale feste Oberflächen; Sie gelten nur für den Zustand, in dem sich die Grenzflächen nicht bewegen und die Phasengrenzlinie im Gleichgewicht liegt.
Minimierung der Energie, drei Phasen[edit]

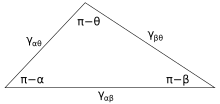
Abbildung 3 zeigt die Kontaktlinie, in der sich drei Phasen treffen. Im Gleichgewicht muss die Nettokraft pro Längeneinheit, die entlang der Grenzlinie zwischen den drei Phasen wirkt, Null sein. Die Komponenten der Nettokraft in der Richtung entlang jeder der Grenzflächen sind gegeben durch:
wobei α, β und θ die gezeigten Winkel und γ sindij ist die Oberflächenenergie zwischen den beiden angegebenen Phasen. Diese Beziehungen können auch durch ein Analogon zu einem Dreieck ausgedrückt werden, das als Neumann-Dreieck bekannt ist (siehe Abbildung 4). Das Neumann-Dreieck stimmt mit der geometrischen Einschränkung überein, die
und das Anwenden des Sinusgesetzes und des Cosinusgesetzes auf sie erzeugt Beziehungen, die beschreiben, wie die Grenzflächenwinkel von den Verhältnissen der Oberflächenenergien abhängen.[12]
Da diese drei Oberflächenenergien die Seiten eines Dreiecks bilden, werden sie durch die Dreiecksungleichungen γ eingeschränktij <γjk + γich k Dies bedeutet, dass keine der Oberflächenspannungen die Summe der beiden anderen überschreiten kann. Wenn drei Flüssigkeiten mit Oberflächenenergien, die diesen Ungleichungen nicht folgen, in Kontakt gebracht werden, existiert keine Gleichgewichtskonfiguration, die mit 3 übereinstimmt.
Vereinfachung der planaren Geometrie, Youngsche Beziehung[edit]
Wenn die β-Phase durch eine flache starre Oberfläche ersetzt wird, wie in Abbildung 5 gezeigt, ist β = π, und die zweite Nettokraftgleichung vereinfacht sich zur Young-Gleichung.[13]

- [14]
Dies bezieht sich auf die Oberflächenspannungen zwischen den drei Phasen: fest, flüssig und gasförmig. Anschließend wird der Kontaktwinkel eines Flüssigkeitströpfchens auf einer festen Oberfläche aus der Kenntnis der drei beteiligten Oberflächenenergien vorhergesagt. Diese Gleichung gilt auch, wenn die “Gas” -Phase eine andere Flüssigkeit ist, die mit dem Tröpfchen der ersten “Flüssigkeits” -Phase nicht mischbar ist.
Vereinfachung der planaren Geometrie, Youngsche Beziehung aus Variationsberechnung abgeleitet[edit]
Betrachten Sie die Schnittstelle als Kurve
zum
wo
ist ein freier Parameter. Die zu minimierende freie Energie ist
mit den Einschränkungen
was wir schreiben können als
und festes Volumen
.
Der modifizierte Lagrange unter Berücksichtigung der Einschränkungen ist daher
wo
sind Lagrange-Multiplikatoren. Per Definition der Schwung
und der Hamiltonianer
was berechnet wird, um zu sein:
Nun erinnern wir uns, dass die Grenze in der frei ist
Richtung und
ist ein freier Parameter. Deshalb müssen wir haben:
An der Grenze
und
Deshalb stellen wir die Young-Gleichung wieder her.
Nicht ideale glatte Oberflächen und der Young-Kontaktwinkel[edit]
Die Young-Gleichung geht von einer vollkommen flachen und starren Oberfläche aus, die oft als ideale Oberfläche bezeichnet wird. In vielen Fällen sind Oberflächen weit von dieser idealen Situation entfernt, und zwei werden hier betrachtet: der Fall von rauen Oberflächen und der Fall von glatten Oberflächen, die noch real sind (endlich starr). Selbst in einer perfekt glatten Oberfläche nimmt ein Tropfen ein breites Spektrum von Kontaktwinkeln an, das vom sogenannten fortschreitenden Kontaktwinkel reicht.
auf den sogenannten zurückgehenden Kontaktwinkel,
. Der Gleichgewichtskontaktwinkel (
) kann berechnet werden aus
und
wie von Tadmor gezeigt wurde[15] wie,
wo
Die Young-Dupré-Gleichung und der Ausbreitungskoeffizient[edit]
Die Young-Dupré-Gleichung (Thomas Young 1805; Anthanase Dupré und Paul Dupré 1869) schreibt vor, dass weder γSG noch γSL kann größer sein als die Summe der beiden anderen Oberflächenenergien.[16][17] Die Konsequenz dieser Einschränkung ist die Vorhersage einer vollständigen Benetzung, wenn γSG > γSL + γLG und Nullbenetzung, wenn γSL > γSG + γLG. Das Fehlen einer Lösung für die Young-Dupré-Gleichung ist ein Indikator dafür, dass es für diese Situationen keine Gleichgewichtskonfiguration mit einem Kontaktwinkel zwischen 0 und 180 ° gibt.[18]
Ein nützlicher Parameter zum Messen der Benetzung ist der Spreizparameter S.,
Wann S. > 0 benetzt die Flüssigkeit die Oberfläche vollständig (vollständige Benetzung). Wann S. <0 tritt eine teilweise Benetzung auf.
Die Kombination der Definition der Ausbreitungsparameter mit der Young-Beziehung ergibt die Young-Dupré-Gleichung:
welches nur physikalische Lösungen für θ hat, wenn S <0 ist.
Die Jasper-Anand-Gleichung für flache und gekrümmte Oberflächen[edit]
Mit Verbesserungen bei Messtechniken wie AFM, konfokaler Mikroskopie und REM konnten Forscher Tröpfchen in immer kleineren Maßstäben erzeugen und abbilden. Mit der Verringerung der Tröpfchengröße kamen neue experimentelle Beobachtungen der Benetzung. Diese Beobachtungen bestätigten, dass die modifizierte Youngsche Gleichung auf den Mikro-Nanoskalen nicht gilt.
Für ein sitzendes Tröpfchen kann die freie Energie des Dreiphasensystems ausgedrückt werden als:[19]
Bei konstantem Volumen im thermodynamischen Gleichgewicht reduziert sich dies auf:[19][20]
Normalerweise ist die VdP Begriff wurde für große Tröpfchen jedoch vernachlässigt VdP Arbeit wird in kleinen Maßstäben bedeutsam. Die Änderung des Drucks bei konstantem Volumen an der Grenze zwischen freier Flüssigkeit und Dampf ist auf den Laplace-Druck zurückzuführen, der proportional zur mittleren Krümmung ist und nicht Null ist. Das Lösen der obigen Gleichung für konvexe und konkave Oberflächen ergibt:[20]
Wobei die konstanten Parameter A, B und C definiert sind als:
,
und
.
Diese Gleichung bezieht sich auf den Kontaktwinkel
, eine geometrische Eigenschaft eines sitzenden Tröpfchens für die Massenthermodynamik, die Energie an der Dreiphasenkontaktgrenze
und die Krümmung der Oberfläche
. Für den Sonderfall eines sitzenden Tröpfchens auf einer ebenen Fläche
::
Die ersten beiden Terme in der obigen Gleichung sind die modifizierte Youngsche Gleichung, während der dritte Term auf den Laplace-Druck zurückzuführen ist. Diese nichtlineare Gleichung sagt das Vorzeichen und die Größe von κ, die Abflachung des Kontaktwinkels in sehr kleinen Maßstäben und die Kontaktwinkelhysterese korrekt voraus.[20]
Computergestützte Vorhersage der Benetzung[edit]
Für viele Oberflächen- / Adsorbatkonfigurationen sind Oberflächenenergiedaten und experimentelle Beobachtungen nicht verfügbar. Da Benetzungswechselwirkungen bei verschiedenen Anwendungen von großer Bedeutung sind, ist es häufig erwünscht, das Benetzungsverhalten verschiedener Materialoberflächen mit bestimmten kristallographischen Orientierungen in Bezug auf Wasser oder andere Adsorbate vorherzusagen und zu vergleichen. Dies kann aus atomistischer Sicht mit Werkzeugen wie Molekulardynamik und Dichtefunktionaltheorie erfolgen.[21][22] In der theoretischen Vorhersage der Benetzung durch ab initio Ansätze wie DFT, Eis wird üblicherweise durch Wasser ersetzt. Dies liegt daran, dass DFT-Berechnungen im Allgemeinen unter der Annahme von Bedingungen einer thermischen Bewegung von Atomen von Null durchgeführt werden, was im Wesentlichen bedeutet, dass die Simulation bei absolutem Nullpunkt durchgeführt wird. Diese Vereinfachung liefert jedoch Ergebnisse, die für die Adsorption von Wasser unter realistischen Bedingungen relevant sind, und die Verwendung von Eis für die theoretische Simulation der Benetzung ist üblich.[23]
Nicht ideale raue feste Oberflächen[edit]

Im Gegensatz zu idealen Oberflächen weisen reale Oberflächen keine perfekte Glätte, Steifheit oder chemische Homogenität auf. Solche Abweichungen von der Idealität führen zu einem Phänomen, das als Kontaktwinkelhysterese bezeichnet wird und als Differenz zwischen dem Vorschub (θ) definiert istein) und zurücktreten (θr) Kontaktwinkel[24]
Wenn der Kontaktwinkel zwischen dem vorrückenden und dem zurückgehenden Fall liegt, wird die Kontaktlinie als fixiert betrachtet und es kann ein hysteretisches Verhalten beobachtet werden, nämlich eine Kontaktwinkelhysterese. Wenn diese Werte überschritten werden, erfolgt die Verschiebung der Kontaktlinie, wie in Abbildung 3, entweder durch Ausdehnen oder Zurückziehen des Tröpfchens.[25] Fig. 6 zeigt die vor- und zurückgehenden Kontaktwinkel. Der fortschreitende Kontaktwinkel ist der maximale stabile Winkel, während der zurückgehende Kontaktwinkel der minimale stabile Winkel ist. Eine Kontaktwinkelhysterese tritt auf, weil auf einem nichtidealen Feststoff viele verschiedene thermodynamisch stabile Kontaktwinkel gefunden werden. Diese variierenden thermodynamisch stabilen Kontaktwinkel werden als metastabile Zustände bezeichnet.[11]
Eine solche Bewegung einer Phasengrenze, die vor- und zurückgehende Kontaktwinkel beinhaltet, ist als dynamische Benetzung bekannt. Der Unterschied zwischen dynamischen und statischen Benetzungswinkeln ist proportional zur Kapillarzahl.
Wenn eine Kontaktlinie vorrückt und mehr von der Oberfläche mit Flüssigkeit bedeckt, wird der Kontaktwinkel vergrößert und hängt im Allgemeinen mit der Geschwindigkeit der Kontaktlinie zusammen.[25][26] Wenn die Geschwindigkeit einer Kontaktlinie ungebunden erhöht wird, nimmt der Kontaktwinkel zu, und wenn sie sich 180 ° nähert, wird die Gasphase in einer dünnen Schicht zwischen der Flüssigkeit und dem Feststoff mitgerissen. Dies ist ein kinetischer Nichtgleichgewichtseffekt, der sich daraus ergibt, dass sich die Kontaktlinie mit einer so hohen Geschwindigkeit bewegt, dass keine vollständige Benetzung auftreten kann.
Eine bekannte Abweichung von den idealen Bedingungen ist, wenn die interessierende Oberfläche eine raue Textur aufweist. Die raue Textur einer Oberfläche kann in eine von zwei Kategorien fallen: homogen oder heterogen. Bei einem homogenen Benetzungsregime füllt die Flüssigkeit die Rillen einer rauen Oberfläche aus. Bei einem heterogenen Benetzungsregime besteht die Oberfläche jedoch aus zwei Arten von Flecken. Ein wichtiges Beispiel für eine solche Verbundoberfläche ist eine, die aus Luft- und Feststoffflecken besteht. Solche Oberflächen haben unterschiedliche Auswirkungen auf die Kontaktwinkel von Benetzungsflüssigkeiten. Cassie-Baxter und Wenzel sind die beiden Hauptmodelle, die versuchen, die Benetzung strukturierter Oberflächen zu beschreiben. Diese Gleichungen gelten jedoch nur, wenn die Tropfengröße im Vergleich zur Oberflächenrauheitsskala ausreichend groß ist.[27] Wenn die Tröpfchengröße mit der der darunter liegenden Säulen vergleichbar ist, sollte der Effekt der Linienspannung berücksichtigt werden.[28]
Wenzels Modell[edit]

Das Wenzel-Modell (Robert N. Wenzel, 1936) beschreibt das homogene Benetzungsregime (siehe Abbildung 7) und wird durch die folgende Gleichung für den Kontaktwinkel auf einer rauen Oberfläche definiert:[27]
wo
ist der scheinbare Kontaktwinkel, der dem stabilen Gleichgewichtszustand entspricht (dh dem minimalen Zustand der freien Energie für das System). Das Rauheitsverhältnis r ist ein Maß dafür, wie sich die Oberflächenrauheit auf eine homogene Oberfläche auswirkt. Das Rauheitsverhältnis ist definiert als das Verhältnis der tatsächlichen Fläche der festen Oberfläche zur scheinbaren Fläche.
θ ist der Young-Kontaktwinkel, wie er für eine ideale Oberfläche definiert ist. Obwohl die Wenzel-Gleichung zeigt, dass sich der Kontaktwinkel einer rauen Oberfläche vom intrinsischen Kontaktwinkel unterscheidet, beschreibt sie nicht die Kontaktwinkelhysterese.[29]
Cassie-Baxter-Modell[edit]

Bei einer heterogenen Oberfläche reicht das Wenzel-Modell nicht aus. Ein komplexeres Modell ist erforderlich, um zu messen, wie sich der scheinbare Kontaktwinkel ändert, wenn verschiedene Materialien beteiligt sind. Diese heterogene Oberfläche, wie sie in Abbildung 8 dargestellt ist, wird mit der Cassie-Baxter-Gleichung (Cassie-Gesetz) erklärt:[27]
Hier das rf ist das Rauheitsverhältnis der feuchten Oberfläche und f ist der Anteil der festen Oberfläche, der von der Flüssigkeit benetzt wird. Es ist wichtig zu wissen, wann f = 1 und rf = rwerden die Cassie-Baxter-Gleichungen zur Wenzel-Gleichung. Wenn andererseits viele verschiedene Fraktionen der Oberflächenrauheit vorhanden sind, wird jede Fraktion der Gesamtoberfläche mit bezeichnet
.
Eine Zusammenfassung von allen
gleich 1 oder der Gesamtfläche. Cassie-Baxter kann auch in der folgenden Gleichung neu gefasst werden:[30]
Hier ist γ die Cassie-Baxter-Oberflächenspannung zwischen Flüssigkeit und Dampf, γich, sv ist die Feststoffdampfoberflächenspannung jeder Komponente und γich, sl ist die feste Flüssigkeitsoberflächenspannung jeder Komponente. Ein erwähnenswerter Fall ist, wenn der Flüssigkeitstropfen auf das Substrat gegeben wird und kleine Lufteinschlüsse darunter entstehen. Dieser Fall für ein Zweikomponentensystem wird bezeichnet durch:[30]
Hierbei ist der Hauptunterschied zu beachten, dass für die zweite Oberflächenspannungskomponente keine Oberflächenspannung zwischen dem Feststoff und dem Dampf besteht. Dies liegt an der Annahme, dass sich die freiliegende Luftoberfläche unter dem Tröpfchen befindet und das einzige andere Substrat im System ist. Anschließend wird die Gleichung ausgedrückt als (1 – f). Daher kann die Cassie-Gleichung leicht aus der Cassie-Baxter-Gleichung abgeleitet werden. Experimentelle Ergebnisse bezüglich der Oberflächeneigenschaften von Wenzel gegenüber Cassie-Baxter-Systemen zeigten den Effekt der Fixierung für einen Young-Winkel von 180 bis 90 °, einem Bereich, der nach dem Cassie-Baxter-Modell klassifiziert wurde. Dieses Flüssigkeits / Luft-Verbundsystem ist weitgehend hydrophob. Nach diesem Punkt wurde ein scharfer Übergang zum Wenzel-Regime gefunden, bei dem der Tropfen die Oberfläche benetzt, jedoch nicht weiter als bis zu den Rändern des Tropfens. Tatsächlich repräsentieren die Young-, Wenzel- und Cassie-Baxter-Gleichungen die Transversalitätsbedingungen des Variationsproblems der Benetzung.[31][32]
Vorläuferfilm[edit]
Mit dem Aufkommen der hochauflösenden Bildgebung haben Forscher begonnen, experimentelle Daten zu erhalten, die sie dazu veranlassten, die Annahmen der Cassie-Baxter-Gleichung bei der Berechnung des scheinbaren Kontaktwinkels in Frage zu stellen. Diese Gruppen[who?] Ich glaube, der scheinbare Kontaktwinkel hängt weitgehend von der Dreifachlinie ab. Die Dreifachlinie, die mit der heterogenen Oberfläche in Kontakt steht, kann nicht wie der Rest des Tropfens auf der heterogenen Oberfläche ruhen. Theoretisch sollte es der Oberflächenunvollkommenheit folgen. Diese Biegung in der Dreifachlinie ist ungünstig und wird in realen Situationen nicht gesehen. Eine Theorie, die die Cassie-Baxter-Gleichung beibehält und gleichzeitig das Vorhandensein des minimierten Energiezustands der Dreifachlinie erklärt, hängt von der Idee eines Vorläuferfilms ab. Dieser Film mit einer Dicke im Submikrometerbereich bewegt sich vor der Bewegung des Tröpfchens voran und befindet sich um die Dreifachlinie. Darüber hinaus ermöglicht dieser Vorläuferfilm, dass sich die Dreifachlinie biegt und verschiedene Konformationen annimmt, die ursprünglich als ungünstig angesehen wurden. Diese Vorläuferflüssigkeit wurde unter Verwendung von Umgebungs-Rasterelektronenmikroskopie (ESEM) in Oberflächen mit in der Masse gebildeten Poren beobachtet. Mit der Einführung des Vorläuferfilmkonzepts kann die Dreifachlinie energetisch realisierbaren Konformationen folgen und so das Cassie-Baxter-Modell korrekt erklären.[33]
“Blütenblatteffekt” vs. “Lotuseffekt”[edit]

Die intrinsische Hydrophobizität einer Oberfläche kann verbessert werden, indem sie mit Rauhigkeitsskalen unterschiedlicher Länge strukturiert wird. Die rote Rose nutzt dies aus, indem sie eine Hierarchie von Mikro- und Nanostrukturen auf jedem Blütenblatt verwendet, um eine ausreichende Rauheit für die Superhydrophobie bereitzustellen. Insbesondere hat jedes Rosenblatt eine Ansammlung von Mikropapillen auf der Oberfläche und jede Papille hat wiederum viele Nanofalten. Der Begriff “Blütenblatteffekt” beschreibt die Tatsache, dass ein Wassertropfen auf der Oberfläche eines Rosenblatts kugelförmig ist, aber nicht abrollen kann, selbst wenn das Blütenblatt auf den Kopf gestellt wird. Die Wassertropfen behalten aufgrund der Superhydrophobie des Blütenblatts (Kontaktwinkel von ca. 152,4 °) ihre Kugelform bei, rollen jedoch nicht ab, da die Blütenblattoberfläche eine hohe Haftkraft mit Wasser aufweist.[34]
Beim Vergleich des “Blütenblatteffekts” mit dem “Lotuseffekt” sind einige auffällige Unterschiede zu beachten. Die Oberflächenstruktur des Lotusblatts und des Rosenblatts (siehe Abbildung 9) kann zur Erklärung der beiden unterschiedlichen Effekte verwendet werden.
Das Lotusblatt hat eine zufällig raue Oberfläche und eine Hysterese mit geringem Kontaktwinkel, was bedeutet, dass das Wassertropfen die Mikrostrukturräume zwischen den Stacheln nicht benetzen kann. Dadurch kann Luft in der Textur verbleiben, wodurch eine heterogene Oberfläche entsteht, die sowohl aus Luft als auch aus Feststoff besteht. Infolgedessen ist die Haftkraft zwischen dem Wasser und der festen Oberfläche extrem gering, so dass das Wasser leicht abperlen kann (dh “selbstreinigendes” Phänomen).
Die Mikro- und Nanostrukturen des Rosenblatts sind größer als die des Lotusblatts, wodurch der Flüssigkeitsfilm die Textur imprägnieren kann. Wie in 9 zu sehen ist, kann die Flüssigkeit jedoch in die größeren Rillen eintreten, jedoch nicht in die kleineren Rillen. Dies ist als das Cassie-imprägnierende Benetzungsregime bekannt. Da die Flüssigkeit die größeren Rillen benetzen kann, ist die Haftkraft zwischen Wasser und Feststoff sehr hoch. Dies erklärt, warum der Wassertropfen auch dann nicht abfällt, wenn das Blütenblatt schräg geneigt oder auf den Kopf gestellt ist. Dieser Effekt schlägt fehl, wenn das Tröpfchen ein Volumen von mehr als 10 µl hat, weil das Gleichgewicht zwischen Gewicht und Oberflächenspannung überschritten wird.[35]
Übergang von Cassie-Baxter zu Wenzel[edit]

Beim Cassie-Baxter-Modell sitzt der Tropfen auf der strukturierten Oberfläche, darunter eingeschlossene Luft. Während des Benetzungsübergangs vom Cassie-Zustand in den Wenzel-Zustand sind die Lufteinschlüsse nicht mehr thermodynamisch stabil und Flüssigkeit beginnt ab der Mitte des Tropfens zu keimen, wodurch ein “Pilzzustand” entsteht, wie in 10 gezeigt.[36] Die Penetrationsbedingung ist gegeben durch:
wo
-
- θC. ist der kritische Kontaktwinkel
- Φ ist der Anteil der Grenzfläche zwischen Feststoff und Flüssigkeit, bei dem der Tropfen mit der Oberfläche in Kontakt steht
- r ist feste Rauheit (für flache Oberfläche r = 1)

Die Penetrationsfront breitet sich aus, um die Oberflächenenergie zu minimieren, bis sie die Ränder des Tropfens erreicht und so zum Wenzel-Zustand gelangt. Da der Feststoff aufgrund seiner Oberflächenrauheit als absorbierendes Material angesehen werden kann, wird dieses Phänomen der Ausbreitung und Aufnahme als Hemiwicking bezeichnet. Die Kontaktwinkel, unter denen Ausbreitung / Aufnahme auftritt, liegen zwischen 0 und π / 2.[37]
Das Wenzel-Modell ist gültig zwischen θC. und π / 2. Wenn der Kontaktwinkel kleiner als Θ istC.Die Penetrationsfront breitet sich über den Tropfen hinaus aus und es bildet sich ein Flüssigkeitsfilm über der Oberfläche. Fig. 11 zeigt den Übergang vom Wenzel-Zustand zum Oberflächenfilmzustand. Der Film glättet die Oberflächenrauheit und das Wenzel-Modell gilt nicht mehr. In diesem Zustand ergeben die Gleichgewichtsbedingung und die Youngsche Beziehung:
- [36]
Durch Feinabstimmung der Oberflächenrauheit ist es möglich, einen Übergang zwischen sowohl superhydrophoben als auch superhydrophilen Regionen zu erreichen. Im Allgemeinen ist die Oberfläche umso hydrophober, je rauer sie ist.
Dynamik verbreiten[edit]
Wenn ein Tropfen auf eine glatte, horizontale Oberfläche gelegt wird, befindet er sich im Allgemeinen nicht im Gleichgewichtszustand. Daher breitet es sich aus, bis ein Gleichgewichtskontaktradius erreicht ist (teilweise Benetzung). Unter Berücksichtigung von Kapillar-, Gravitations- und viskosen Beiträgen kann der Tropfenradius als Funktion der Zeit ausgedrückt werden als[38]

 und das Anwenden des Sinusgesetzes und des Cosinusgesetzes auf sie erzeugt Beziehungen, die beschreiben, wie die Grenzflächenwinkel von den Verhältnissen der Oberflächenenergien abhängen.[12]
und das Anwenden des Sinusgesetzes und des Cosinusgesetzes auf sie erzeugt Beziehungen, die beschreiben, wie die Grenzflächenwinkel von den Verhältnissen der Oberflächenenergien abhängen.[12]
 zum
zum ![{ displaystyle x in I =[0,L]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d305c8663697c7ab89128c6c19f017d16b9addeb) wo
wo  ist ein freier Parameter. Die zu minimierende freie Energie ist
ist ein freier Parameter. Die zu minimierende freie Energie ist
![{ displaystyle { cal {F}}[y,L]= int _ {0} ^ {L} left ( gamma _ {LG} { sqrt {1 + y '^ {2}}} + ( gamma _ {SL} - gamma _ {SG}) right) dx}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16a5fa77da20dd04965ce70d94455ca3080a11a3)
 was wir schreiben können als
was wir schreiben können als  und festes Volumen
und festes Volumen  .
.

 sind Lagrange-Multiplikatoren. Per Definition der Schwung
sind Lagrange-Multiplikatoren. Per Definition der Schwung  und der Hamiltonianer
und der Hamiltonianer  was berechnet wird, um zu sein:
was berechnet wird, um zu sein:

 Richtung und
Richtung und 
 und
und  Deshalb stellen wir die Young-Gleichung wieder her.
Deshalb stellen wir die Young-Gleichung wieder her.
 auf den sogenannten zurückgehenden Kontaktwinkel,
auf den sogenannten zurückgehenden Kontaktwinkel,  . Der Gleichgewichtskontaktwinkel (
. Der Gleichgewichtskontaktwinkel ( ) kann berechnet werden aus
) kann berechnet werden aus 






 ,
,  und
und  .
.
 , eine geometrische Eigenschaft eines sitzenden Tröpfchens für die Massenthermodynamik, die Energie an der Dreiphasenkontaktgrenze
, eine geometrische Eigenschaft eines sitzenden Tröpfchens für die Massenthermodynamik, die Energie an der Dreiphasenkontaktgrenze  und die Krümmung der Oberfläche
und die Krümmung der Oberfläche  . Für den Sonderfall eines sitzenden Tröpfchens auf einer ebenen Fläche
. Für den Sonderfall eines sitzenden Tröpfchens auf einer ebenen Fläche  ::
::


 Wenn eine Kontaktlinie vorrückt und mehr von der Oberfläche mit Flüssigkeit bedeckt, wird der Kontaktwinkel vergrößert und hängt im Allgemeinen mit der Geschwindigkeit der Kontaktlinie zusammen.[25][26] Wenn die Geschwindigkeit einer Kontaktlinie ungebunden erhöht wird, nimmt der Kontaktwinkel zu, und wenn sie sich 180 ° nähert, wird die Gasphase in einer dünnen Schicht zwischen der Flüssigkeit und dem Feststoff mitgerissen. Dies ist ein kinetischer Nichtgleichgewichtseffekt, der sich daraus ergibt, dass sich die Kontaktlinie mit einer so hohen Geschwindigkeit bewegt, dass keine vollständige Benetzung auftreten kann.
Wenn eine Kontaktlinie vorrückt und mehr von der Oberfläche mit Flüssigkeit bedeckt, wird der Kontaktwinkel vergrößert und hängt im Allgemeinen mit der Geschwindigkeit der Kontaktlinie zusammen.[25][26] Wenn die Geschwindigkeit einer Kontaktlinie ungebunden erhöht wird, nimmt der Kontaktwinkel zu, und wenn sie sich 180 ° nähert, wird die Gasphase in einer dünnen Schicht zwischen der Flüssigkeit und dem Feststoff mitgerissen. Dies ist ein kinetischer Nichtgleichgewichtseffekt, der sich daraus ergibt, dass sich die Kontaktlinie mit einer so hohen Geschwindigkeit bewegt, dass keine vollständige Benetzung auftreten kann.

 ist der scheinbare Kontaktwinkel, der dem stabilen Gleichgewichtszustand entspricht (dh dem minimalen Zustand der freien Energie für das System). Das Rauheitsverhältnis r ist ein Maß dafür, wie sich die Oberflächenrauheit auf eine homogene Oberfläche auswirkt. Das Rauheitsverhältnis ist definiert als das Verhältnis der tatsächlichen Fläche der festen Oberfläche zur scheinbaren Fläche.
ist der scheinbare Kontaktwinkel, der dem stabilen Gleichgewichtszustand entspricht (dh dem minimalen Zustand der freien Energie für das System). Das Rauheitsverhältnis r ist ein Maß dafür, wie sich die Oberflächenrauheit auf eine homogene Oberfläche auswirkt. Das Rauheitsverhältnis ist definiert als das Verhältnis der tatsächlichen Fläche der festen Oberfläche zur scheinbaren Fläche.

 .
.




Recent Comments