Gerüstprotein – Wikipedia
In der Biologie Gerüstproteine sind entscheidende Regulatoren vieler wichtiger Signalwege. Obwohl Gerüste in ihrer Funktion nicht streng definiert sind, ist bekannt, dass sie mit mehreren Mitgliedern eines Signalwegs interagieren und / oder binden und diese zu Komplexen zusammenbinden. In solchen Pfaden regulieren sie die Signalübertragung und helfen bei der Lokalisierung von (in Komplexen organisierten) Signalwegkomponenten in bestimmten Bereichen der Zelle wie der Plasmamembran, dem Zytoplasma, dem Zellkern, dem Golgi, den Endosomen und den Mitochondrien.
Geschichte[edit]
Das erste entdeckte Signalgerüstprotein war das Ste5-Protein aus der Hefe Saccharomyces cerevisiae. Es wurde gezeigt, dass drei verschiedene Domänen von Ste5 mit den Proteinkinasen Ste11, Ste7 und Fus3 assoziieren, um einen Multikinasekomplex zu bilden.[2]
Funktion[edit]
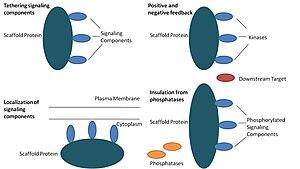
Gerüstproteine wirken auf mindestens vier Arten: Anbinden von Signalkomponenten, Lokalisieren dieser Komponenten in bestimmten Bereichen der Zelle, Regulieren der Signalübertragung durch Koordinieren positiver und negativer Rückkopplungssignale und Isolieren korrekter Signalproteine von konkurrierenden Proteinen.[1]
Anbinden von Signalisierungskomponenten[edit]
Diese spezielle Funktion wird als die grundlegendste Funktion eines Gerüsts angesehen. Gerüste setzen Signalkomponenten einer Kaskade zu Komplexen zusammen. Diese Anordnung kann in der Lage sein, die Signalisierungsspezifität zu verbessern, indem unnötige Wechselwirkungen zwischen Signalproteinen verhindert werden, und die Signaleffizienz zu verbessern, indem die Nähe und die effektive Konzentration von Komponenten im Gerüstkomplex erhöht werden. Ein häufiges Beispiel dafür, wie Gerüste die Spezifität erhöhen, ist ein Gerüst, das eine Proteinkinase und ihr Substrat bindet und dadurch eine spezifische Kinase-Phosphorylierung sicherstellt. Zusätzlich erfordern einige Signalproteine mehrere Interaktionen zur Aktivierung, und das Gerüst-Tethering kann diese Interaktionen möglicherweise in eine Interaktion umwandeln, die zu mehreren Modifikationen führt.[3][4] Gerüste können auch katalytisch sein, da die Wechselwirkung mit Signalproteinen zu allosterischen Veränderungen dieser Signalkomponenten führen kann.[5] Solche Änderungen können möglicherweise die Aktivierung dieser Signalproteine verstärken oder hemmen. Ein Beispiel ist das Ste5-Gerüst im Mitogen-aktivierten Proteinkinase (MAPK) -Pfad. Es wurde vorgeschlagen, dass Ste5 das Paarungssignal durch die Fus3-MAPK lenkt, indem diese spezielle Kinase für die Aktivierung durch die MAPKK Ste7 katalytisch freigeschaltet wird.[6]
Lokalisierung von Signalkomponenten in der Zelle[edit]
Gerüste lokalisieren die Signalreaktion auf einen bestimmten Bereich in der Zelle, ein Prozess, der für die lokale Produktion von Signalzwischenprodukten wichtig sein könnte. Ein besonderes Beispiel für diesen Prozess ist das Gerüst A-Kinase-Ankerproteine (AKAPs), die auf zyklische AMP-abhängige Proteinkinase (PKA) an verschiedenen Stellen in der Zelle abzielen.[7] Diese Lokalisierung kann PKA lokal regulieren und führt zur lokalen Phosphorylierung seiner Substrate durch PKA.
Positives und negatives Feedback koordinieren[edit]
Viele Hypothesen darüber, wie Gerüste positives und negatives Feedback koordinieren, stammen von technischen Gerüsten und mathematischen Modellen. In Drei-Kinase-Signalkaskaden binden Gerüste alle drei Kinasen, erhöhen die Kinase-Spezifität und beschränken die Signalverstärkung, indem sie die Kinase-Phosphorylierung auf nur ein nachgeschaltetes Ziel beschränken.[3][8][9] Diese Fähigkeiten können mit der Stabilität der Wechselwirkung zwischen dem Gerüst und den Kinasen, der basalen Phosphataseaktivität in der Zelle, der Gerüstposition und den Expressionsniveaus der Signalkomponenten zusammenhängen.[3][8]
Isolierung korrekter Signalproteine vor Inaktivierung[edit]
Signalwege werden häufig durch Enzyme inaktiviert, die den Aktivierungszustand umkehren und / oder den Abbau von Signalkomponenten induzieren. Es wurden Gerüste vorgeschlagen, um aktivierte Signalmoleküle vor Inaktivierung und / oder Abbau zu schützen. Die mathematische Modellierung hat gezeigt, dass Kinasen in einer Kaskade ohne Gerüste eine höhere Wahrscheinlichkeit haben, von Phosphatasen dephosphoryliert zu werden, bevor sie überhaupt in der Lage sind, nachgeschaltete Ziele zu phosphorylieren.[8] Darüber hinaus wurde gezeigt, dass Gerüste Kinasen von Substrat- und ATP-kompetitiven Inhibitoren isolieren.[10]
Zusammenfassung des Gerüstproteins[edit]
| Gerüstproteine | Weg | Mögliche Funktionen | Beschreibung |
|---|---|---|---|
| KSR | MAPK | Aufbau und Lokalisierung des RAS-ERK-Pfades | Einer der am besten untersuchten Signalwege in der Biologie ist der RAS-ERK-Weg, bei dem das RAS-G-Protein die MAPKKK-RAF aktiviert, die die MAPKK-MEK1 (MAPK / ERK-Kinase 1) aktiviert, die dann die MAPK-ERK aktiviert. Es wurde festgestellt, dass mehrere Gerüstproteine an diesem Weg und anderen ähnlichen MAPK-Wegen beteiligt sind. Ein solches Gerüstprotein ist KSR, das wahrscheinlichste Äquivalent des gut untersuchten Hefe-MAPK-Gerüstproteins Ste5.[11] Es ist ein positiver Regulator des Weges und bindet viele Proteine im Weg, einschließlich aller drei Kinasen in der Kaskade.[6] Es wurde gezeigt, dass KSR während der Zellaktivierung auf der Plasmamembran lokalisiert ist, wodurch eine Rolle beim Zusammenbau der Komponenten des ERK-Wegs und bei der Lokalisierung von aktiviertem ERK auf der Plasmamembran gespielt wird.[12] |
| MEKK1 | MAPK | Assemblierung und Lokalisierung des Todesrezeptor-Signalosoms | Andere Gerüstproteine umfassen B-Zell-Lymphom 10 (BCL-10) und MEK-Kinase 1 (MEKK1), die eine Rolle im JUN N-terminalen Kinase (JNK) -Pfad spielen. |
| BCL-10 | MAPK | Montage und Spezifität von JNK | |
| AKAP | PKA-Pfade | Koordination der Phosphorylierung durch PKA auf nachgeschaltete Ziele | Diese Familie von Proteinen ist nur strukturell in ihrer Fähigkeit verwandt, die regulatorische Untereinheit von PKA zu binden, kann aber ansonsten einen sehr unterschiedlichen Satz von Enzymen und Substraten binden |
| AHNAK-1 | Kalziumsignalisierung | Aufbau und Lokalisierung von Kalziumkanälen | Die Kalziumsignalisierung ist für die ordnungsgemäße Funktion der Immunzellen von wesentlicher Bedeutung. Jüngste Studien haben gezeigt, dass das Gerüstprotein AHNAK1 für eine effiziente Kalziumsignalisierung und NFAT-Aktivierung in T-Zellen wichtig ist, da es Kalziumkanäle an der Plasmamembran richtig lokalisieren kann [14]. In nicht immunen Zellen wurde auch gezeigt, dass AHNAK1 Calciumkanäle mit Phospholipase Cγ (PLC-γ) und PKC bindet.[1] Kalziumbindende Proteine löschen häufig einen Großteil des eintretenden Kalziums. Daher kann die Verknüpfung dieser Kalziumeffektoren besonders wichtig sein, wenn Signale durch einen schwachen Kalziumeinstrom induziert werden. |
| Homer | Kalziumsignalisierung | Hemmung der NFAT-Aktivierung | Ein weiteres Beispiel für ein Gerüstprotein, das die Kalziumsignale moduliert, sind Proteine der HOMER-Familie. Es wurde gezeigt, dass die HOMER-Proteine mit Calcineurin konkurrieren, um in aktivierten T-Zellen an den N-Terminus von NFAT zu binden.[13] Durch diese Konkurrenz können die HOMER-Proteine die NFAT-Aktivierung reduzieren, was auch die Produktion des IL-2-Zytokins reduziert.[13] Im Gegensatz dazu wurde auch gezeigt, dass HOMER-Proteine die Calcium-Signalübertragung in Neuronen positiv regulieren, indem sie den Glutamatrezeptor mit Triphosphatrezeptoren im endoplasmatischen Retikulum verbinden.[14] |
| Pellino | Angeborene Immunsignalisierung | Zusammenbau des TLR-Signalosoms | Es gibt Hinweise darauf, dass Pellino-Proteine als Gerüstproteine im wichtigen angeborenen Immunsignalweg, dem Toll-like-Rezeptor (TLR) -Pfad, fungieren. Viel Pellino-Funktion ist Spekulation; Pellino-Proteine können jedoch nach IL-1R-Aktivierung mit IRAK1, TRAF6 und TAK1 assoziieren, was darauf hinweist, dass sie möglicherweise Komponenten des TLR-Wegs in der Nähe seines Rezeptors zusammensetzen und lokalisieren.[15][16] |
| NLRP | Angeborene Immunsignalisierung | Zusammenbau des Inflammasoms | Die NLR-Familie ist eine hochkonservierte und große Familie von Rezeptoren, die an der angeborenen Immunität beteiligt sind. Die NLRP-Rezeptorfamilie (NLR-Familie, Pyrindomäne enthaltend) fungiert als Gerüst, indem sie das Inflammasom zusammensetzt, einen Komplex, der zur Sekretion entzündungsfördernder Zytokine wie IL-18 und IL-1β führt.[17] |
| DLG1 | T-Zell-Rezeptor-Signalisierung | Aufbau und Lokalisierung von TCR-Signalmolekülen, Aktivierung von p38 | DLG1 ist in Immunzellen hoch konserviert und wichtig für die T-Zell-Aktivierung in der Peripherie. Es wird für die immunologische Synapse rekrutiert und verbindet die ζ-Kette des T-Zell-Rezeptors (TCR) mit CBL, WASP, p38, LCK, VAV1 und ZAP70.[18][19][20][21] Diese Daten legen nahe, dass DLG1 eine Rolle bei der Verknüpfung der TCR-Signalmaschinerie mit Zytoskelettregulatoren spielt und auch eine Rolle bei der alternativen Aktivierung des p38-Signalwegs. Es ist jedoch unklar, ob DLG1 die T-Zell-Aktivierung positiv oder negativ reguliert. |
| Spinophilin | Signalisierung dendritischer Zellen | Assemblierung von immunologischen DC-Synapsenproteinen | Spinophilin ist an der Funktion dendritischer Zellen beteiligt, insbesondere an der Bildung immunologischer Synapsen. Spinophilin wird nach Kontakt dendritischer Zellen mit einer T-Zelle in die Synapse rekrutiert. Diese Rekrutierung scheint wichtig zu sein, da dendritische Zellen ohne Spinophilin keine T-Zellen aktivieren können in vitro oder in vivo.[22] Wie Spinophilin in diesem Fall die Antigenpräsentation erleichtert, ist noch unbekannt, obwohl es möglich ist, dass Spinophilin die Dauer des Zellkontakts in der Synapse oder das Recycling von co-stimulierenden Molekülen in der Zelle wie MHC-Molekülen reguliert.[1] |
| Pflanzen-FLU-regulatorisches Protein[23] | Koordination der negativen Rückkopplung während der Protochlorophyllid-Biosynthese. | Aufbau und Lokalisierung des Weges, der die Synthese von hochtoxischem Protochlorophyllid, einem Vorläufer von Chlorophyll, ermöglicht. | Die Synthese von Protochlorophyllid muss streng reguliert werden, da seine Umwandlung in Chlorophyll Licht erfordert. Das FLU-regulatorische Protein befindet sich in der Thylakoidmembran und enthält nur mehrere Protein-Protein-Interaktionsstellen ohne katalytische Aktivität. Mutanten, denen dieses Protein fehlt, akkumulieren Protochlorophyllid in der Dunkelheit über. Die Interaktionspartner sind unbekannt. Das Protein wurde während der Evolution vereinfacht. |
Huntingtin-Protein[edit]
Das Huntingtin-Protein lokalisiert sich zusammen mit dem ATM-Reparaturprotein an Stellen mit DNA-Schäden.[24] Huntingtin ist ein Gerüstprotein im oxidativen DNA-Schadensreaktionskomplex von ATM.[24]Patienten mit Huntington-Krankheit mit aberrantem Huntingtin-Protein können oxidative DNA-Schäden nicht reparieren. Oxidative DNA-Schäden scheinen der Pathogenese der Huntington-Krankheit zugrunde zu liegen.[25] Die Huntington-Krankheit wird wahrscheinlich durch die Funktionsstörung des mutierten Huntingtin-Gerüstproteins bei der DNA-Reparatur verursacht, was zu einer erhöhten oxidativen DNA-Schädigung in metabolisch aktiven Zellen führt.[24]
Andere Verwendung des Begriffs Gerüstprotein[edit]
In einigen anderen Fällen in der Biologie (nicht unbedingt in Bezug auf die Signalübertragung von Zellen) wird der Begriff “Gerüstprotein” im weiteren Sinne verwendet, wobei ein Protein für jeden Zweck mehrere Dinge zusammenhält.
- Bei der Chromosomenfaltung
- Chromosomengerüst spielt eine wichtige Rolle, um das Chromatin in einem kompakten Chromosom zu halten. Das Chromosomengerüst besteht aus Proteinen, einschließlich Kondensin, Topoisomerase IIα und Mitglied 4 der Kinesinfamilie (KIF4).[26] Chromosomengerüstbestandteile werden auch als Gerüstprotein bezeichnet.
- In enzymatischer Reaktion
- Große multifunktionelle Enzyme, die eine Reihe oder Kette von Reaktionen auf einem gemeinsamen Weg ausführen, manchmal auch als Gerüstproteine bezeichnet.[27] wie Pyruvatdehydrogenase.
- In Molekülformbildung
- Ein Enzym oder Strukturprotein, das mehrere Moleküle zusammenhält, um sie in der richtigen räumlichen Anordnung zu halten, wie z. B. Eisen-Schwefel-Cluster-Gerüstproteine.[28][29]
- Strukturgerüst
- Im Zytoskelett und in der ECM bilden die Moleküle ein mechanisches Gerüst. Wie Typ 4 Kollagen[30]
Verweise[edit]
- ^ ein b c d Shaw, Andrey S.; Filbert, Erin L. (Januar 2009). “Gerüstproteine und Signalübertragung von Immunzellen”. Nature Reviews Immunology. 9 (1): 47–56. doi:10.1038 / nri2473. PMID 19104498. S2CID 13443447.
- ^ Choi, Kang-Yell; Satterberg, Brett; Lyons, David M.; Elion, Elaine A. (August 1994). “Ste5 bindet mehrere Proteinkinasen in der MAP-Kinasekaskade, die für die Paarung erforderlich ist S. cerevisiae“. Zelle. 78 (3): 499–512. doi:10.1016 / 0092-8674 (94) 90427-8. PMID 8062390. S2CID 20541545.
- ^ ein b c Levchenko, Andre; Bruck, Josua; Sternberg, Paul W. (23. Mai 2000). “Gerüstproteine können die Spiegel der mitogenaktivierten Proteinkinase-Signalübertragung zweiphasig beeinflussen und ihre Schwellenwerteigenschaften verringern.”. Verfahren der Nationalen Akademie der Wissenschaften. 97 (11): 5818–5823. Bibcode:2000PNAS … 97,5818L. doi:10.1073 / pnas.97.11.5818. PMC 18517. PMID 10823939.
- ^ Ferrell, James E. (3. Oktober 2000). “Was machen Gerüstproteine wirklich?” Wissenschaftliche Signalisierung. 2000 (52): pe1. doi:10.1126 / stke.522000pe1. S2CID 219192522.
- ^ Burack, W Richard; Shaw, Andrey S. (April 2000). “Signalübertragung: an einem Gerüst hängen”. Aktuelle Meinung in der Zellbiologie. 12 (2): 211–216. doi:10.1016 / S0955-0674 (99) 00078-2. PMID 10712921.
- ^ ein b Gut, Matthew; Tang, Grace; Singleton, Julie; Reményi, Attila; Lim, Wendell A. (März 2009). “Das Ste5-Gerüst steuert das Paarungssignal durch katalytisches Entsperren der Fus3-MAP-Kinase zur Aktivierung.”. Zelle. 136 (6): 1085–1097. doi:10.1016 / j.cell.2009.01.049. PMC 2777755. PMID 19303851.
- ^ Wong, Wei; Scott, John D. (Dezember 2004). “AKAP-Signalkomplexe: Schwerpunkte in Raum und Zeit”. Nature Reviews Molekulare Zellbiologie. 5 (12): 959–970. doi:10.1038 / nrm1527. PMID 15573134. S2CID 15268680.
- ^ ein b c Locasale, Jason W.; Shaw, Andrey S.; Chakraborty, Arup K. (14. August 2007). “Gerüstproteine verleihen Proteinkinase-Kaskaden verschiedene regulatorische Eigenschaften”. Verfahren der Nationalen Akademie der Wissenschaften. 104 (33): 13307–13312. Bibcode:2007PNAS..10413307L. doi:10.1073 / pnas.0706311104. PMID 17686969. S2CID 8907943.
- ^ Uhlik, Mark T; Abell, Amy N; Cuevas, Bruce D; Nakamura, Kazuhiro; Johnson, Gary L (1. Dezember 2004). “Schaltpläne der MAPK-Regelung durch MEKK1, 2 und 3”. Biochemie und Zellbiologie. 82 (6): 658–663. doi:10.1139 / o04-114. PMID 15674433.
- ^ Greenwald, Eric C.; Redden, John M.; Dodge-Kafka, Kimberly L.; Saucerman, Jeffrey J. (24. Januar 2014). “Scaffold State Switching verstärkt, beschleunigt und isoliert die Proteinkinase C-Signalübertragung”. Journal of Biological Chemistry. 289 (4): 2353–2360. doi:10.1074 / jbc.M113.497941. PMC 3900978. PMID 24302730.
- ^ Clapéron, A.; Therrien, M. (Mai 2007). “KSR und CNK: zwei Gerüste, die die RAS-vermittelte RAF-Aktivierung regulieren”. Onkogen. 26 (22): 3143–3158. doi:10.1038 / sj.onc.1210408. PMID 17496912. S2CID 31061333.
- ^ Müller, Jürgen; Ory, Stéphane; Copeland, Terry; Piwnica-Worms, Helen; Morrison, Deborah K. (November 2001). “C-TAK1 reguliert die Ras-Signalübertragung durch Phosphorylierung des MAPK-Gerüsts, KSR1”. Molekulare Zelle. 8 (5): 983–993. doi:10.1016 / S1097-2765 (01) 00383-5. PMID 11741534.
- ^ ein b Huang, Guo N.; Huso, David L.; Bouyain, Samuel; Tu, Jianchen; McCorkell, Kelly A.; May, Michael J.; Zhu, Yuwen; Lutz, Michael; Collins, Samuel; Dehoff, Marlin; Kang, Shin; Whartenby, Katharine; Powell, Jonathan; Leahy, Daniel; Worley, Paul F. (25. Januar 2008). “NFAT-Bindung und Regulation der T-Zell-Aktivierung durch die zytoplasmatischen Gerüst-Homer-Proteine”. Wissenschaft. 319 (5862): 476–481. Bibcode:2008Sci … 319..476H. doi:10.1126 / science.1151227. PMC 3602998. PMID 18218901.
- ^ Xiao, Bo; Cheng Tu, Jian; Worley, Paul F. (Juni 2000). “Homer: eine Verbindung zwischen neuronaler Aktivität und Glutamatrezeptorfunktion”. Aktuelle Meinung in der Neurobiologie. 10 (3): 370–374. doi:10.1016 / S0959-4388 (00) 00087-8. PMID 10851183. S2CID 8699597.
- ^ Jiang, Zhengfan; Johnson, H. Jan; Nie, Huiqing; Qin, Jinzhong; Bird, Timothy A.; Li, Xiaoxia (28. März 2003). “Pellino 1 ist für die Interleukin-1 (IL-1) -vermittelte Signalübertragung durch seine Wechselwirkung mit dem IL-1-Rezeptor-assoziierten Kinase 4 (IRAK4) -IRAK-Tumor-Nekrose-Faktor-Rezeptor-assoziierten Faktor 6 (TRAF6) -Komplex erforderlich.”. Journal of Biological Chemistry. 278 (13): 10952–10956. doi:10.1074 / jbc.M212112200. PMID 12496252. S2CID 10165785.
- ^ Yu, Kang-Yeol; Kwon, Hyung-Joo; Norman, David AM; Vig, Eva; Goebl, Mark G.; Harrington, Maureen A. (15. Oktober 2002). “Schneide: Maus-Pellino-2 moduliert die IL-1- und Lipopolysaccharid-Signalübertragung”. Das Journal of Immunology. 169 (8): 4075–4078. doi:10.4049 / jimmunol.169.8.4075. PMID 12370331. S2CID 25317655.
- ^ Pétrilli, Virginie; Dostert, Catherine; Muruve, Daniel A; Tschopp, Jürg (Dezember 2007). “Das Inflammasom: ein Gefahrenerkennungskomplex, der die angeborene Immunität auslöst”. Aktuelle Meinung in der Immunologie. 19 (6): 615–622. doi:10.1016 / j.coi.2007.09.002. PMID 17977705.
- ^ Xavier, Ramnik; Rabizadeh, Shahrooz; Ishiguro, Kazuhiro; Andre, Niko; Ortiz, J. Bernabe; Wachtel, Heather; Morris, David G.; Lopez-Ilasaca, Marco; Shaw, Albert C.; Swat, Wojciech; Seed, Brian (19. Juli 2004). “Scheiben große (Dlg1) Komplexe bei der Lymphozytenaktivierung”. Journal of Cell Biology. 166 (2): 173–178. doi:10.1083 / jcb.200309044. PMC 2172307. PMID 15263016.
- ^ Hanada, Toshihiko; Lin, Lunhui; Chandy, K. George; Oh, S. Steven; Chishti, Athar H. (24. Oktober 1997). “Humanes Homolog der Drosophila-Scheiben. Großer Tumorsuppressor bindet an p56 lck Tyrosinkinase und Shaker Typ Kv1.3 Kaliumkanal in T-Lymphozyten.”. Journal of Biological Chemistry. 272 (43): 26899–26904. doi:10.1074 / jbc.272.43.26899. PMID 9341123. S2CID 23446334.
- ^ Runde, Juni L.; Humphries, Lisa A.; Tomassian, Tamar; Mittelstadt, Paul; Zhang, Min; Miceli, M. Carrie (Februar 2007). “Das Gerüstprotein Dlgh1 koordiniert die alternative Aktivierung der p38-Kinase und lenkt die T-Zell-Rezeptorsignale auf NFAT, jedoch nicht auf NF-κB-Transkriptionsfaktoren.” Naturimmunologie. 8 (2): 154–161. doi:10.1038 / ni1422. PMID 17187070. S2CID 11906543.
- ^ Runde, Juni L.; Tomassian, Tamar; Zhang, Min; Patel, Viresh; Schönberger, Stephen P.; Miceli, M. Carrie (7. Februar 2005). “Dlgh1 koordiniert die Aktinpolymerisation, die Aggregation von synaptischen T-Zellrezeptoren und Lipidflößen sowie die Effektorfunktion in T-Zellen.”. Journal of Experimental Medicine. 201 (3): 419–430. doi:10.1084 / jem.20041428. PMC 2213022. PMID 15699074.
- ^ Bloom, Ona; Unternaehrer, Julia J.; Jiang, Aimin; Shin, Jeong-Sook; Delamarre, Lélia; Allen, Patrick; Mellman, Ira (21. April 2008). “Spinophilin ist am Informationstransfer an immunologischen Synapsen beteiligt”. Journal of Cell Biology. 181 (2): 203–211. doi:10.1083 / jcb.200711149. PMID 18411312. S2CID 1717736.
- ^ Meskauskiene, Rasa; Nater, Mena; Gänschen, David; Kessler, Felix; Lager, Roel op den; Apel, Klaus (23. Oktober 2001). “FLU: Ein negativer Regulator der Chlorophyll-Biosynthese in Arabidopsis thaliana”. Verfahren der Nationalen Akademie der Wissenschaften. 98 (22): 12826–12831. Bibcode:2001PNAS … 9812826M. doi:10.1073 / pnas.221252798. PMC 60138. PMID 11606728.
- ^ ein b c Maiuri, Tamara; Mocle, Andrew J.; Hung, Claudia L.; Xia, Jianrun; van Roon-Mom, Willeke MC; Truant, Ray (25. Dezember 2016). “Huntingtin ist ein Gerüstprotein im oxidativen DNA-Schadensreaktionskomplex von ATM.”. Humangenetik. 26 (2): 395–406. doi:10.1093 / hmg / ddw395. PMID 28017939.
- ^ Ayala-Peña, Sylvette (September 2013). “Die Rolle oxidativer DNA-Schäden bei mitochondrialen Dysfunktionen und der Pathogenese der Huntington-Krankheit”. Freie Radikale Biologie und Medizin. 62: 102–110. doi:10.1016 / j.freeradbiomed.2013.04.017. PMC 3722255. PMID 23602907.
- ^ Poonperm, Rawin; Takata, Hideaki; Hamano, Tohru; Matsuda, Atsushi; Uchiyama, Susumu; Hiraoka, Yasushi; Fukui, Kiichi (1. Juli 2015). “Chromosomengerüst ist eine doppelsträngige Anordnung von Gerüstproteinen”. Wissenschaftliche Berichte. 5 (1): 11916. Bibcode:2015NatSR … 511916P. doi:10.1038 / srep11916. PMC 4487240. PMID 26132639.
- ^ molekulare Zellbiologie von Lodish[full citation needed]
- ^ Ayala-Castro, Carla; Saini, Avneesh; Outten, F. Wayne (2008). “Fe-S-Cluster-Assemblierungswege in Bakterien”. Mikrobiologie und Molekularbiologie Bewertungen. 72 (1): 110–125. doi:10.1128 / MMBR.00034-07. PMC 2268281. PMID 18322036.
- ^ Adrover, Miquel; Howes, Barry D.; Iannuzzi, Clara; Smulevich, Giulietta; Pastore, Annalisa (1. Juni 2015). “Anatomie eines Eisen-Schwefel-Cluster-Gerüstproteins: Verständnis der Determinanten von [2Fe–2S] Clusterstabilität auf IscU “. Biochimica et Biophysica Acta (BBA) – Molekulare Zellforschung. 1853 (6): 1448–1456. doi:10.1016 / j.bbamcr.2014.10.023. PMID 25447544.
- ^ Molecular Cell Biology von Lodish et al. Ausgabe 5[page needed]
Recent Comments