Exoelektronen – Wikipedia
Ein Exoelektrogen bezieht sich normalerweise auf einen Mikroorganismus, der die Fähigkeit besitzt, Elektronen extrazellulär zu übertragen. Während Exoelektrogen der vorherrschende Name ist, wurden andere Begriffe verwendet: elektrochemisch aktive Bakterien, Anoden atmende Bakterien und Elektrogene.[1] Auf diese Weise exocytierte Elektronen werden nach der ATP-Produktion unter Verwendung einer Elektronentransportkette (ETC) während der oxidativen Phosphorylierung produziert. Die konventionelle Zellatmung erfordert einen letzten Elektronenakzeptor, um diese Elektronen aufzunehmen. Zellen, die molekularen Sauerstoff (O2) als ihr endgültiger Elektronenakzeptor wird beschrieben, dass sie aerobe Atmung verwendet, während Zellen, die andere lösliche Verbindungen als ihren endgültigen Elektronenakzeptor verwenden, als anaerobe Atmung verwendet werden.[2] Der letzte Elektronenakzeptor eines Exoelektrogens wird jedoch extrazellulär gefunden und kann in wässriger Lösung ein starkes Oxidationsmittel oder ein fester Leiter/Elektronenakzeptor sein. Zwei häufig beobachtete Akzeptoren sind Eisenverbindungen (insbesondere Fe(III)-Oxide) und Manganverbindungen (insbesondere Mn(III/IV)-Oxide).[3][4][5] Da Sauerstoff ein starkes Oxidationsmittel ist, können Zellen dies ausschließlich in Abwesenheit von Sauerstoff tun.[6]
Die Nutzung von Exoelektrogenen wird derzeit bei der Entwicklung von mikrobiellen Brennstoffzellen (MFCs) erforscht, die das Potenzial haben, organisches Material wie Belebtschlamm aus der Abwasserbehandlung in Ethanol, Wasserstoffgas und elektrischen Strom umzuwandeln.[1][7]
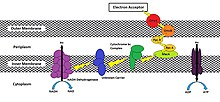
Während der genaue Prozess, bei dem eine Zelle einen extrazellulären Akzeptor reduziert, von Spezies zu Spezies variiert, hat sich gezeigt, dass Verfahren die Verwendung eines Oxidoreduktase-Wegs beinhalten, der Elektronen zu der Zellmembran transportiert, die der äußeren Umgebung ausgesetzt ist.[3] Dieser Weg spaltet sich vom ETC-Weg ab, nachdem der Cytochrom-bc1-Komplex (Komplex III) durch Cytochrome vom c-Typ oxidiert wurde, die Elektronen in Richtung der extrazellulären Seite seiner äußersten Membran statt in Richtung Cytochrom-c-Oxidase (Komplex IV) bewegen sollen. MtrC und OmcA sind Beispiele für solche Cytochrome vom c-Typ, die endogen in der äußeren Membran von gefunden werden Shewanella oneidensis MR-1 ein Gammaproteobakterium, obwohl viele andere Variationen existieren (Abbildung 1).[3][4][5][7][8]
Abgesehen von der Abgabe von Elektronen an einen exogenen endgültigen Elektronenakzeptor kann der externe Elektronentransfer anderen Zwecken dienen. Erstens können Zellen Elektronen direkt aufeinander übertragen, ohne dass eine Zwischensubstanz erforderlich ist. Pelotomaculum thermopropioncum wurde beobachtet im Zusammenhang mit Methanothermobacter thermautotrophicus durch einen Pilus (externe Zellstrukturen, die bei der Konjugation und Adhäsion verwendet werden), der als elektrisch leitfähig bestimmt wurde. Zweitens können extrazelluläre Elektronen eine Rolle bei der Kommunikation als Quorum-Signal in Biofilmen spielen.[1]
Zusätzlich zu S. oneidensis MR-1, wurde bei den folgenden Bakterienstämmen ohne exogenen Mediator eine exoelektrogene Aktivität beobachtet: Shewanella putrefaciens IR-1, Clostridium butyricum, Desulfuromonas acetoxidans, Geobacter metallireducens, Geobacter sulfurreducens, Rhodoferax ferrireducens, Aeromonas-Hydrophilie (A3), Pseudomonas aeruginosa, Desulfobulbus propionicus, Geopsychrobacter elektrodiphilus, Geothrix fermentans, Shewanella oneidensis DSP10, Escherichia coli, Rhodopseudomonas palustris, Ochrobactrum anthropisch YZ-1, Desulfovibrio Desulfuricans, Acidiphilium sp.3.2Sup5, Klebsiella pneumoniae L17, Thermincola sp.Stamm JR, Pichia-Anomalie.[1]

Es wurde gezeigt, dass reduzierte Oxidoreduktase-Enzyme an der extrazellulären Membran die folgenden Methoden verwenden, um ihre Elektronen auf den exogenen Endakzeptor zu übertragen: direkter Kontakt, Pendeln über ausgeschiedene Mediatoren, Eisenchelatbildner,[9] durch einen leitfähigen Biofilm und durch leitfähige Pili (Abbildung 2). Es besteht jedoch die Möglichkeit, dass sich diese Methoden nicht gegenseitig ausschließen,[8] und das verwendete Verfahren kann von den Umgebungsbedingungen abhängen. Bei niedrigen mikrobiellen Populationsdichten kann die Verwendung von Elektronenshuttles und Chelatbildnern, die durch das Exoelektrogen synthetisiert werden, aufgrund unzureichender Konzentrationen solcher Moleküle, die für die Rückgewinnung und Wiederverwendung erforderlich sind, energetisch kostspielig sein.[9] Unter diesen Umständen wäre eine direkte Übertragung bevorzugt; der Energienutzen würde jedoch den Energiebedarf überwiegen, wenn die mikrobielle Gemeinschaft ausreichend groß ist.
Die direkte Reduktion eines exogenen Akzeptors wird durch den Kontakt zwischen den Oxidoreduktasen der Zelle und dem terminalen Elektronenakzeptor (dh einer Elektrode oder einer externen Metallverbindung) erreicht. Während diese Proteine vielfältig sind (sowohl membrangebundene als auch lösliche Formen annehmen), bieten ihre gemeinsamen Positionen in der äußeren Membran oder im Periplasma bei Gram-negativen und Gram-positiven Bakterien einen engen Kontakt für den Elektronentransfer.[10]
Darüber hinaus erhöht die Anwesenheit von Elektronenshuttles die direkte Transferrate dramatisch.[4] Als Beispiel in Shewanella oneidensis MR-1, der Transport ist durch eine Reihe von Redox- und Strukturproteinen charakterisiert[11] erstreckt sich von der zytoplasmatischen Membran bis zur äußeren Zelloberfläche (ähnlich Abbildung 1). Flavine werden sezerniert, von denen angenommen wird, dass sie die „Lücke“ zwischen Zelloberflächenprotein(en) und dem externen Metall überbrücken, was die Notwendigkeit eines sofortigen Kontakts verringern und den Transfer aus der Ferne erleichtern kann.[9] Da Cytochrome im Allgemeinen spezifische Oberflächen auf dem Substratmetall erkennen,[10] lösliche Flavine können als universelle Brücke fungieren, die die Elektronenabgabe an eine Vielzahl unterschiedlicher Metallformen und -größen ermöglicht,[4] die in mikrobiellen Brennstoffzellenanwendungen nützlich sein können. Es wurde auch angenommen, dass Flavine an terminale Elektronentransferproteine als Co-Faktoren binden, um die Oxidationsraten zu erhöhen.[11]
Im Falle des Geobacter sulferducens, der Elektronenträger Riboflavin wird verwendet; Der Elektronenträger ist jedoch nicht vollständig frei löslich und kann lose im Biofilm der Kultur gebunden werden, was zu einem hochleitfähigen Biofilm führt. Außerdem, G. Sulferucens produziert elektrisch leitfähige Pili (Nanodrähte) mit auf seiner Oberfläche eingebetteten OmcS-Oxidoreduktase-Enzymen,[12] Demonstration der Verwendung von mehreren exoelektrogenen Transfermethoden.
Bei der Eisenchelatbildung werden unlösliche Eisenoxidverbindungen in wässrigen Lösungen solubilisiert. Da die Bioverfügbarkeit von Eisen knapp ist, sezernieren viele Mikroben eisenchelatisierende Verbindungen, um Eisen für verschiedene zelluläre Prozesse zu solubilisieren, aufzunehmen und zu sequestrieren. Bestimmte Exoelektrogene haben gezeigt, dass sie solche Verbindungen für den Elektronentransport nutzen können, indem sie Eisen extrazellulär löslich machen.[10] und Abgabe an die Zelloberfläche oder innerhalb der Zelle. Die in jedem Stoffwechselweg verwendeten Komponenten sind phylogenetisch vielfältig,[11] daher können einige Chelatbildner Eisen außerhalb der Zelle reduzieren und als Elektronentransporter wirken, während andere Eisen zur membrangebundenen Reduktion an die Zelle liefern können.[10]
Verweise[edit]
- ^ ein B C D Logan B. (Mai 2009). „Exoelektrogene Bakterien, die mikrobielle Brennstoffzellen antreiben“. Natur Bewertungen Mikrobiologie. 7 (5): 375–383. mach:10.1038/nrmicro2113. PMID 19330018. S2CID 2560062.
- ^ Willey J.; et al. (2011). Prescotts Mikrobiologie. McGraw-Hügel. S. 228–245. ISBN 978-0-07-337526-7.
- ^ ein B C HartshorneR.; et al. (Dezember 2009). “Charakterisierung einer Elektronenleitung zwischen Bakterien und der extrazellulären Umgebung” (PDF). Proceedings of the National Academy of Sciences. 106 (52): 22169–22174. mach:10.1073/pnas.0900086106. PMC 2799772. PMID 20018742.
- ^ ein B C D Baron D. (Oktober 2009). “Elektrochemische Messung der Elektronentransferkinetik durch Shewanella oneidensis MR-1“. Die Zeitschrift für biologische Chemie. 284 (42): 28865–28873. mach:10.1074/jbc.M109.043455. PMC 2781432. PMID 19661057.
- ^ ein B Shi L.; et al. (2006). “Isolierung eines hochaffinen funktionellen Proteinkomplexes zwischen OmcA und MtrC: Zwei Außenmembran-Dekahem C-Typ Cytochrome von Shewanella oneidensis MR-1“. Zeitschrift für Bakteriologie. 188 (13): 4705–4714. mach:10.1128/JB.01966-05. PMC 1483021. PMID 16788180.
- ^ Logan B. (2008). Mikrobielle Brennstoffzellen. John Wiley & Sons Inc. S. 4–6. ISBN 978-0470239483.
- ^ ein B Flynn J.; et al. (2010). „Ermöglichung unausgeglichener Fermentationen durch die Verwendung von technisch hergestellten Bakterien mit Elektrodenschnittstelle“. MBio, Amerikanische Gesellschaft für Mikrobiologie. 1 (5): 1–8. mach:10.1128/mBio.00190-10. PMC 2975363. PMID 21060736.
- ^ ein B Lovley D. (2008). “Die Mikrobe elektrisch: Umwandlung von organischem Material in Elektrizität”. Aktuelle Meinung in der Biotechnologie. 19 (6): 1–8. mach:10.1016/j.copbio.2008.10.005. PMID 19000760.
- ^ ein B C Richter, Katrin; Schicklberger, Marcus; Gescher, Johannes (2012). “Dissimilatorische Reduktion extrazellulärer Elektronenakzeptoren in der anaeroben Atmung”. Angewandte und Umweltmikrobiologie. 78 (4): 913–921. mach:10.1128/AEM.06803-11. PMC 3273014. PMID 22179232.
- ^ ein B C D Gralnick, Jeffrey A.; Newman, Dianne K. (Juli 2007). “Extrazelluläre Atmung”. Molekulare Mikrobiologie. 65 (1): 1–11. mach:10.1111/j.1365-2958.2007.05778.x. PMC 2804852. PMID 17581115.
- ^ ein B C Shi, Liang; Dong, Haiiang; Reguera, Gemma; Beyenal, Haluk; Lu, Anhuai; Liu, Juan; Yu, Han-Qing; Fredrickson, James K. (30. August 2016). „Extrazelluläre Elektronentransfermechanismen zwischen Mikroorganismen und Mineralien“. Natur Bewertungen Mikrobiologie. 14 (10): 651–662. mach:10.1038/nrmicro.2016.93. PMID 27573579. S2CID 20626915.
- ^ Leang C.; et al. (2010). “Ausrichtung der C-Typ Cytochrome OmcS entlang Pili of Geobacter sulfurreducens“. Angewandte und Umweltmikrobiologie. 76 (12): 4080–4084. mach:10.1128/AEM.00023-10. PMC 2893476. PMID 20400557.
Recent Comments