Hämorrhagisches Krim-Kongo-Fieber – Wikipedia
Virusinfektion
Gesundheitszustand
| Hämorrhagisches Krim-Kongo-Fieber | |
|---|---|
 |
|
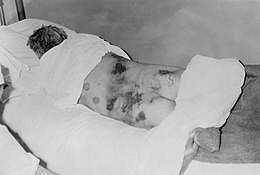
| Mann mit diagnostiziertem hämorrhagischem Krim-Kongo-Fieber, 1969 | |
| Spezialität | Ansteckende Krankheit |
| Symptome | Fieber, Muskelschmerzen, Kopfschmerzen, Erbrechen, Durchfall, Einbluten in die Haut[1] |
| Komplikationen | Leberversagen[1] |
| Üblicher Beginn | Schnell[1] |
| Dauer | Zwei Wochen[1] |
| Diagnosemethode | Nachweis von Antikörpern, der RNA des Virus oder viralen Proteinen (Antigenen).[1] |
| Differenzialdiagnose | Dengue-Fieber, Q-Fieber,[2]Ebola-Virus-Erkrankung[3] |
| Behandlung | Unterstützende Pflege, Ribavirin[1] |
| Prognose | Sterberisiko ~25%[1] |
Hämorrhagisches Krim-Kongo-Fieber (CCHF) ist eine Viruserkrankung.[1] Symptome von CCHF können Fieber, Muskelschmerzen, Kopfschmerzen, Erbrechen, Durchfall und Hautblutungen sein.[1] Die Symptome treten weniger als zwei Wochen nach der Exposition auf.[1] Komplikationen können Leberversagen sein.[1] Bei den Überlebenden erfolgt die Genesung im Allgemeinen etwa zwei Wochen nach Beginn.[1]
Das CCHF-Virus wird typischerweise durch Zeckenstiche oder Kontakt mit Nutztieren übertragen, die die Krankheit tragen.[1] Ansteckungsgefährdete Gruppen sind Landwirte und diejenigen, die in Schlachthöfen arbeiten.[1] Das Virus kann sich auch über Körperflüssigkeiten zwischen Menschen verbreiten.[1] Die Diagnose kann durch den Nachweis von Antikörpern, der RNA des Virus oder viralen Proteinen (Antigenen) gestellt werden.[1] Es ist eine Art virales hämorrhagisches Fieber.[1]
Es gibt keine von der FDA oder der WHO zugelassenen Therapeutika für CCHF. Prävention beinhaltet die Vermeidung von Zeckenstichen, die Anwendung sicherer Praktiken in Fleischverarbeitungsbetrieben und die Einhaltung allgemeiner Gesundheitsvorkehrungen.[1] Ein Impfstoff ist nicht im Handel erhältlich.[1] Die Behandlung erfolgt in der Regel mit unterstützender Pflege.[1] Auch das Medikament Ribavirin kann helfen.[1]
CCHF-Fälle werden in einem weiten geografischen Bereich beobachtet, einschließlich Afrika, Russland, dem Balkan, dem Nahen Osten und Asien.[1] Typischerweise werden kleine Ausbrüche in Gebieten beobachtet, in denen das Virus endemisch ist.[1] Im Jahr 2013 dokumentierten Iran, Russland, die Türkei und Usbekistan mehr als fünfzig Fälle.[2] Die Sterblichkeitsrate liegt in der Regel zwischen 10 und 40 %, obwohl bei einigen Ausbrüchen Todesfälle bis zu 80 % beobachtet wurden.[1] Das Virus wurde erstmals in den 1940er Jahren auf der Krim beobachtet und später als derselbe Erreger des sogenannten Kongo-Hämorrhagischen Fiebers identifiziert.[4]
In den letzten 20 Jahren wurden in Osteuropa, insbesondere in der ehemaligen Sowjetunion, im gesamten Mittelmeerraum, in Nordwestchina, Zentralasien, Südeuropa, Afrika, im Nahen Osten und auf dem indischen Subkontinent CCHF-Ausbrüche gemeldet. CCHF steht auf der Prioritätenliste der WHO für Forschung und Entwicklung und der Prioritätsliste A des National Institute of Allergy and Infectious Diseases (NIH/NIAID) der USA als Krankheit, die das höchste Risiko für die nationale Sicherheit und die öffentliche Gesundheit darstellt.
Anzeichen und Symptome[edit]
Die mit CCHFV assoziierte klinische Erkrankung ist eine schwere Form des hämorrhagischen Fiebers.[5] Nach einer Infektion durch einen Zeckenstich beträgt die Inkubationszeit in der Regel zwei bis drei Tage, kann aber auch bis zu neun Tage dauern, während die Inkubationszeit nach Kontakt mit infiziertem Blut oder Gewebe in der Regel fünf bis sechs Tage mit einem dokumentierten Maximum von 13 Tagen beträgt. Die Symptome, die die prähämorrhagische Phase einleiten, treten plötzlich auf mit Fieber, Myalgie (Muskelschmerzen), Schwindel, Nackenschmerzen und -steifheit, Rückenschmerzen, Kopfschmerzen, brennenden Augen und Photophobie (Lichtempfindlichkeit). Typische Symptome sind Übelkeit, Erbrechen (das zu schweren Blutungen führen kann und ohne Behandlung tödlich sein kann), Durchfall, Bauchschmerzen und Halsschmerzen zu Beginn der akuten Infektionsphase, gefolgt von starken Stimmungsschwankungen, Unruhe und Verwirrtheit. Nach einigen Tagen kann die Erregung durch Schläfrigkeit, Depression und Mattigkeit ersetzt werden, und die Bauchschmerzen können sich auf den oberen rechten Quadranten mit nachweisbarer Lebervergrößerung lokalisieren. Mit Fortschreiten der Erkrankung in die hämorrhagische Phase sind großflächig schwere Blutergüsse, starkes Nasenbluten und unkontrollierte Blutungen an den Injektionsstellen zu erkennen, beginnend etwa am vierten Krankheitstag und etwa zwei Wochen lang. Andere klinische Anzeichen sind Tachykardie (schneller Herzschlag), Lymphadenopathie (vergrößerte Lymphknoten) und Petechien (ein durch Einbluten in die Haut verursachter Hautausschlag) auf inneren Schleimhautoberflächen, wie im Mund und Rachen, und auf der Haut. Die Petechien können größeren Hautausschlägen, sogenannten Ekchymosen, und anderen hämorrhagischen Phänomenen weichen. Es gibt in der Regel Hinweise auf eine Hepatitis, und bei schwerkranken Patienten kann es nach dem fünften Krankheitstag zu einer raschen Verschlechterung der Nieren, Leberversagen oder Lungenversagen kommen.
Bei dokumentierten Ausbrüchen von CCHF lagen die Sterblichkeitsraten bei hospitalisierten Patienten zwischen 9% und sogar 70%, obwohl die WHO einen typischen Bereich von 10-40% feststellt, wobei der Tod oft in der zweiten Krankheitswoche eintrat. Bei Patienten, die sich erholen, beginnt die Besserung in der Regel am neunten oder zehnten Tag nach Krankheitsbeginn. Die Langzeitwirkungen einer CCHF-Infektion wurden bei Überlebenden nicht gut genug untersucht, um festzustellen, ob spezifische Komplikationen vorliegen oder nicht. Die Erholung ist jedoch langsam.
Virologie[edit]
Die Krim-Kongo-Hämorrhagisches Fieber Orthonairovirus (CCHFV) ist ein Mitglied der Gattung Orthonairovirus, Familie Nairoviridae von RNA-Viren.[6]
Die Virionen haben einen Durchmesser von 80–120 Nanometern (nm) und sind pleomorph. Es gibt keine Wirtsribosomen innerhalb des Virions. Jedes Virion enthält drei verschiedene RNA-Sequenzen, die zusammen das virale Genom bilden. Die Hülle ist einschichtig und besteht aus einer 5 nm dicken Lipiddoppelschicht. Es hat keine äußeren Vorsprünge. Die Hüllproteine bilden kleine Vorsprünge von ~5–10 nm Länge. Die Nukleokapside sind filamentös und kreisförmig mit einer Länge von 200–3000 nm.[7]
Es wird angenommen, dass der Viruseintritt durch Clathrin vermittelt wird, wobei das Zelloberflächenprotein Nukleolin eine Rolle spielt.[8]
Molekularbiologie[edit]
Das Genom ist eine zirkuläre Negativ-Sense-RNA in drei Teilen – Small (S), Medium (M) und Large (L). Das L-Segment ist 11–14,4 Kilobasen lang, während die M- und S-Segmente 4,4–6,3 bzw. 1,7–2,1 Kilobasen lang sind. Das L-Segment kodiert die RNA-Polymerase, das M-Segment kodiert die Hüllglycoproteine (Gc und Gn) und das S-Segment kodiert das Nukleokapsidprotein.[7] Die Mutationsraten für die drei Teile des Genoms wurden auf folgende geschätzt: 1,09×10-4, 1,52×10-4 und 0,58×10-4 Substitutionen/Standort/Jahr für die S-, M- und L-Segmente.[9]
Populationsgenetik[edit]
CCHFV ist das genetisch vielfältigste der Arboviren: Seine Nukleotidsequenzen unterscheiden sich häufig zwischen verschiedenen Stämmen und reichen von 20 % Variabilität für das virale S-Segment bis zu 31 % für das M-Segment.[10] Viren mit unterschiedlichen Sequenzen können innerhalb desselben geografischen Gebiets gefunden werden; eng verwandte Viren wurden aus weit voneinander entfernten Regionen isoliert, was darauf hindeutet, dass die Virusausbreitung möglicherweise durch von Zugvögeln getragene Zecken oder durch den internationalen Viehhandel erfolgt ist. Die Neusortierung von Genomsegmenten während der Koinfektion von Zecken oder Wirbeltieren scheint wahrscheinlich eine Rolle bei der Generierung der Diversität in diesem Virus gespielt zu haben.[citation needed]
Basierend auf den Sequenzdaten wurden sieben Genotypen von CCHFV erkannt: Afrika 1 (Senegal), Afrika 2 (Demokratische Republik Kongo und Südafrika), Afrika 3 (Süd- und Westafrika), Europa 1 (Albanien, Bulgarien, Kosovo , Russland und Türkei), Europa 2 (Griechenland), Asien 1 (Naher Osten, Iran und Pakistan) und Asien 2 (China, Kasachstan, Tadschikistan und Usbekistan).[citation needed]
Übertragung[edit]

Zecken sind sowohl “Umweltreservoir” als auch Vektor für das Virus, das es von Wildtieren auf Haustiere und Menschen überträgt. Als mit dem Virus infiziert identifizierte Zeckenarten umfassen Argasreflex, Hyalomma anatolicum, Hyalomma-Detritum, Hyalomma marginatum marginatum und Rhipicephalus sanguineus.[citation needed]
Mindestens 31 verschiedene Zeckenarten der Gattungen Hämaphysalis und Hyalomma im Südosten des Iran wurde festgestellt, dass das Virus infiziert ist.[11]
Wilde Tiere und kleine Säugetiere, insbesondere Feldhasen, mittelafrikanische Igel und multimammate Ratten, sind die „verstärkenden Wirte“ des Virus. Vögel sind im Allgemeinen gegen CCHF resistent, mit Ausnahme von Straußen. Haustiere wie Schafe, Ziegen und Rinder können hohe Virustiter im Blut entwickeln, neigen aber nicht dazu, zu erkranken.[12]
Die “sporadische Infektion” des Menschen wird in der Regel durch a Hyalomma Zeckenbiss. Tiere können das Virus auf den Menschen übertragen, dies geschieht jedoch normalerweise als Teil eines Krankheitsclusters. Wenn Krankheitshäufungen auftreten, geschieht dies in der Regel, nachdem Menschen infiziertes Vieh, insbesondere Wiederkäuer und Strauße, behandelt, geschlachtet oder gegessen haben. Ausbrüche sind in Schlachthöfen und anderen Orten aufgetreten, an denen Arbeiter infiziertem menschlichem oder tierischem Blut und Krankheitserregern ausgesetzt waren[citation needed] Menschen können Menschen infizieren und auch in klinischen Einrichtungen kommt es durch infiziertes Blut und unsaubere medizinische Instrumente zu Ausbrüchen.[13]
Verhütung[edit]
Wo eine Infektion mit Säugetierzecken häufig vorkommt, verlangen die landwirtschaftlichen Vorschriften, dass Nutztiere vor dem Transport oder der Lieferung zur Schlachtung entfernt werden. Persönliche Maßnahmen zur Zeckenvermeidung werden empfohlen, wie die Verwendung von Insektenschutzmitteln, angemessene Kleidung und Körperuntersuchung auf anhaftende Zecken.[citation needed]
Wenn fieberhafte Patienten mit Anzeichen von Blutungen eine Wiederbelebung oder Intensivpflege benötigen, sollten Vorsichtsmaßnahmen zur Isolierung von Körpersubstanzen getroffen werden.[citation needed]
Impfung[edit]
Seit den 1970er Jahren wurden weltweit mehrere Impfstoffstudien gegen CCHF wegen hoher Toxizität abgebrochen.[14]
Stand März 2011[update], war der einzige verfügbare und wahrscheinlich einigermaßen wirksame CCHF-Impfstoff ein inaktiviertes Antigenpräparat, das damals in Bulgarien verwendet wurde.[14] Es existiert keine Veröffentlichung in der wissenschaftlichen Literatur zu diesem Impfstoff, der von einem türkischen Virologen als verdächtig bezeichnet wurde, da zu seiner Herstellung antiquierte Technologie und Mausgehirn verwendet wurden.[15]
Weitere Impfstoffe sind in der Entwicklung, aber die sporadische Natur der Krankheit, selbst in endemischen Ländern, deutet darauf hin, dass große Studien zur Wirksamkeit von Impfstoffen schwierig durchzuführen sein werden. Die Suche nach Freiwilligen kann sich angesichts der zunehmenden Ablehnung der Impfung und des Widerstands der Bevölkerung gegen Impfungen gegen ansteckende Krankheiten als eine Herausforderung erweisen. Die Anzahl der zu impfenden Personen und die Dauer der Überwachung, um den Schutz zu bestätigen, müssten sorgfältig festgelegt werden. Alternativ scheinen viele Wissenschaftler zu glauben, dass die Behandlung von CCHF mit Ribavirin praktischer ist als die Vorbeugung, aber einige kürzlich durchgeführte klinische Studien scheinen die Annahmen der Arzneimittelwirksamkeit zu widerlegen.[14]
Im Jahr 2011 entwickelte ein türkisches Forschungsteam unter der Leitung der Erciyes-Universität erfolgreich den ersten ungiftigen präventiven Impfstoff, der klinische Studien bestanden hat. Ab 2012 stand die Zulassung des Impfstoffs durch die US-amerikanische FDA noch aus.[15]
Seit der Ebola-Epidemie hat die WHO einen „Blueprint for Research and Development Preparedness“ zu neu auftretenden Krankheitserregern mit Seuchenpotenzial gestartet, gegen die es keine medizinischen Behandlungen gibt.[16] CCHF stand auf der ersten Liste vom Dezember 2015 an erster Stelle und steht ab Januar 2017 an zweiter Stelle.[17]
Behandlung[edit]
Die Behandlung ist meist unterstützend. Ribavirin hat in vitro eine gewisse Wirksamkeit gezeigt [18] und wurde bei Ausbrüchen oral eingenommen,[citation needed] Es gibt jedoch unsichere Beweise für seine Verwendung, und dieses Medikament kann schwerwiegende Nebenwirkungen wie hämolytische Anämie und Leberschäden verursachen.[19]
Ab 2011[update] der Einsatz von Immunglobulin-Präparaten blieb unbewiesen und das Antikörper-Engineering, das Hoffnungen auf eine monoklonale Antikörpertherapie weckte, steckte noch in den Kinderschuhen.[14]
Die US-Streitkräfte unterhalten spezielle Vorräte an Ribavirin, um das in Afghanistan und den Irak stationierte Personal vor CCHF zu schützen.[citation needed]
Epidemiologie[edit]

CCHD tritt am häufigsten bei landwirtschaftlichen Arbeitern nach dem Stich einer infizierten Zecke auf und in geringerem Maße bei Schlachthofarbeitern, die Blut und Gewebe infizierter Tiere ausgesetzt waren, sowie bei medizinischem Personal durch Kontakt mit Körperflüssigkeiten infizierter Personen.[10]
Geografische Verteilung[edit]
Ab 2013[update] die nördliche Grenze von CCHF war 50 Grad nördlicher Breite, nördlich davon die Hyalomma Zecken wurden nicht gefunden.[5]
Laut einer WHO-Karte aus dem Jahr 2008 traten Hyalomma-Zecken südlich dieses Breitengrades auf dem gesamten eurasischen Kontinent und Afrika auf, wobei nur die Inseln Sri Lanka, Indonesien und Japan verschont blieben.[20]
Der serologische oder virologische Nachweis von CCHF war in Asien, Osteuropa, dem Nahen Osten (außer Israel, Libanon und Jordanien), Zentralafrika, Westafrika, Südafrika und Madagaskar weit verbreitet.[20]
2008 wurden mehr als 50 Fälle/Jahr aus nur 4 Ländern gemeldet: Türkei, Iran, Russland und Usbekistan. 5-49 Fälle/Jahr gab es in Südafrika, Zentralasien einschließlich Pakistan und Afghanistan (aber ohne Turkmenistan), im Nahen Osten nur in den VAE und den Balkanländern, beschränkt auf Rumänien, Bulgarien, Serbien, Montenegro und Kosovo-Albanien.[20]
In Russland ist die Krankheit auf die Föderationskreise Süd- und Nordkaukasus beschränkt, aber der Klimawandel kann dazu führen, dass sie sich auf nördlichere Gebiete ausbreitet.[21]
Eine Karte der CDC aus dem Jahr 2014 zeigt Endemiegebiete (in Rot) weitgehend unverändert in Afrika und im Nahen Osten, aber anders für den Balkan, einschließlich aller Länder des ehemaligen Jugoslawiens und auch Griechenlands, aber nicht mehr Rumänien. Indiens nordwestliche Regionen Rajastan und Gujarat sahen ihre ersten Fälle.[22]
Ausbrüche[edit]
Von 1995 bis 2013 wurden in der Republik Kosovo 228 Fälle von CCHF gemeldet, mit einer Sterblichkeitsrate von 25,5%.[23]
Zwischen 2002 und 2008 meldete das türkische Gesundheitsministerium 3.128 CCHF-Fälle mit einer Sterberate von 5 %.[citation needed] Im Juli 2005 meldeten die Behörden 41 Fälle von CCHF in der zentraltürkischen Provinz Yozgat mit einem Todesfall.[clarification needed] Mit Stand August 2008 wurden für das bisherige Jahr in verschiedenen Städten der Türkei insgesamt 50 Todesfälle durch CCHF gemeldet.[clarification needed]
Im September 2010 wurde in der pakistanischen Provinz Khyber Pakhtunkhwa ein Ausbruch gemeldet. Eine schlechte Diagnose und schlechte Aufzeichnungen führten dazu, dass das Ausmaß des Ausbruchs ungewiss war, obwohl einige Berichte über 100 Fälle mit einer Sterblichkeitsrate von über 10 % angaben.[citation needed]
Im Januar 2011 wurden die ersten Fälle von CCHF in Indien in Sanand, Gujarat, Indien, mit 4 gemeldeten Todesfällen gemeldet, darunter der Indexpatient, der behandelnde Arzt und die Krankenschwester.[24]
Stand Mai 2012[update], 71 Menschen sollen sich im Iran mit der Krankheit infiziert haben, was zu 8 Todesfällen führte.[citation needed]
Im Oktober 2012 starb im Royal Free Hospital in London ein Brite an der Krankheit. Er war zuvor in das Gartnavel General Hospital in Glasgow eingeliefert worden, nachdem er mit einem Flug aus Kabul in Afghanistan zurückgekehrt war.[25]
Im Juli 2013 starben sieben Personen an CCHF im Dorf Kariyana in Babra Taluka, Distrikt Amreli, Gujarat, Indien.[26][27]
Im August 2013 wurde ein Bauer aus Agago, Uganda, im Kalongo-Krankenhaus wegen einer bestätigten CCHF-Infektion behandelt. Es wurde vermutet, dass der Tod von drei weiteren Personen in der nördlichen Region durch das Virus verursacht wurde.[28] Ein weiterer nicht verwandter CCHF-Patient wurde am selben Tag in das Mulago Hospital eingeliefert. Das Gesundheitsministerium gab am 19. bekannt, dass der Ausbruch unter Kontrolle sei, aber die zweite Patientin, eine 27-jährige Frau aus Nansana, starb am 21. Es wird angenommen, dass sie sich bei ihrem Ehemann mit dem Virus infiziert hat, der nach einer Behandlung mit CCHF in Juba, Südsudan, nach Kampala zurückkehrte.[29]
Im Juni 2014 wurden in Kasachstan Fälle diagnostiziert. Zehn Menschen, darunter eine Rettungswagenbesatzung, wurden mit Verdacht auf CCHF in Südkasachstan in ein Krankenhaus eingeliefert.[citation needed]
Im Juli 2014 wurde im Hayatabad Medical Complex (HMC), Pakistan, eine achte Person mit CCHF infiziert. Die acht Patienten, darunter eine Krankenschwester und sechs afghanische Staatsangehörige, starben zwischen April und Juli 2014.[30]
Ab 2015[update], sporadisch bestätigte Fälle wurden aus Bhuj, Amreli, Sanand, Idar und Vadnagar in Gujarat, Indien, gemeldet. Im November 2014 wurden ein Arzt und ein Arbeiter in Nord-Gujarat positiv auf die Krankheit getestet. In den folgenden Wochen starben drei weitere Menschen an CCHF.[31] Im März 2015 starb in Gujarat eine weitere Person an CCHF.[32]
Ab 2015 wurde CCHF bei Nutztieren in Indien als “weit verbreitet” anerkannt, nur 4 Jahre nachdem der erste menschliche Fall diagnostiziert worden war.[33]
Im August 2016 trat der erste lokale CCHF-Fall in Westeuropa in Westspanien auf. Ein 62-jähriger Mann, der in Spanien von einer Zecke gebissen worden war, starb am 25. August, nachdem er eine Krankenschwester infiziert hatte.[34] Der Zeckenstich ereignete sich in der Provinz Ávila, 300 km von der Provinz Cáceres entfernt, wo im Jahr 2010 virale CCHF-RNA aus Zecken amplifiziert wurde.[35]
Stand Juli 2017[update] Es war unklar, welche spezifische Ökologie zu den spanischen Fällen führte.[36]
Im August 2016 äußerten eine Reihe pakistanischer Nachrichtenquellen Bedenken hinsichtlich der Krankheit.[37][38] Zwischen Januar und Oktober 2016 wurden CCHF-Ausbrüche in Pakistan mit den meisten Fällen und Todesfällen im August 2016 gemeldet, kurz vor dem Fest von Eid-al-Adha (das vom 13. bis 15. September 2016 stattfand). Es wurde die Hypothese aufgestellt, dass das Festival eine wichtige Rolle spielen könnte, da Menschen mit möglicherweise mit dem CCHF-Virus infizierten Haustieren oder importierten Tieren in Kontakt kommen könnten.[39] Die pakistanische NIH zeigte, dass es keine Korrelation gab und dass CCHF-Fälle mit dem Höhepunkt der Zeckenvermehrung während der vorangegangenen 8–10 Jahre zusammenfielen.[40]
Im Jahr 2017 veröffentlichte die Generaldirektion für öffentliche Gesundheit in der Türkei offizielle Aufzeichnungen über Infektionen und Opfer des hämorrhagischen Krim-Kongo-Fiebers, die zwischen 2008 und 2017 aufgetreten sind. Jedes Jahr wurden Hunderte von Fällen beobachtet, wobei der niedrigste 343 im Jahr 2017 und der höchste 1318 im Jahr 2009 betrug, während die Sterblichkeitsrate pro Bevölkerung jedes Jahr kontinuierlich abnahm. [41] Geografisch konzentrieren sich die Fälle auf die zentrale Schwarzmeerregion, hauptsächlich in der Provinz Yozgat und den umliegenden Provinzen, in bergigen Teilen Zentralanatoliens und in den nördlichen Provinzen Ostanatoliens. [42]
Am 5. Februar 2020 ereignete sich in der Zentralregion Malis ein Ausbruch. Die Infizierten stammen aus der Region Douentza und Mopti. Bisher sind 7 Menschen gestorben.[43][needs update]
Geschichte[edit]
In Deutschland, in keltischen Zentren, in altem Blut im Bereich der Oberen Donau: ein Virus des hämorrhagischen Krim-Kongo-Fiebers, CCHF, das früher meist zum Tod führte.[44]
Das Virus kann sich um 1500-1100 v. Chr. entwickelt haben. Es wird angenommen, dass sich das Klima und die landwirtschaftlichen Praktiken zu dieser Zeit ändern könnten, um seine Entwicklung zu unterstützen.[9]
Im 12. Jahrhundert könnte ein Fall einer hämorrhagischen Krankheit aus dem heutigen Tadschikistan der erste bekannte Fall von hämorrhagischem Krim-Kongo-Fieber gewesen sein.[citation needed]
Während des Krimkrieges war die Krankheit als “Krimfieber” bekannt und wurde von vielen, darunter Florence Nightingale, infiziert.[45]
Im Jahr 1944 identifizierten sowjetische Wissenschaftler erstmals die Krankheit, die sie Krim-hämorrhagisches Fieber auf der Krim nannten.[46] Sie stellten seine virale Ätiologie fest, waren aber zu diesem Zeitpunkt nicht in der Lage, den Erreger zu isolieren.
Im Februar 1967 veröffentlichten die Virologen John P. Woodall, David Simpson, Ghislaine Courtois und andere erste Berichte über ein Virus, das sie Kongovirus nannten.[47][48] 1956 wurde das Kongo-Virus erstmals von der Ärztin Ghislaine Courtois, der Leiterin des Provinzialen Medizinischen Labors in Stanleyville im Belgisch-Kongo, isoliert. Der von Courtois isolierte Stamm V3010 wurde an das Rockefeller Foundation Virus Laboratory (RFVL) in New York City geschickt und als identisch mit einem anderen Stamm aus Uganda, aber zu diesem Zeitpunkt mit keinem anderen benannten Virus festgestellt.[citation needed]
Im Juni 1967 registrierte der sowjetische Virologe Mikhail Chumakov ein Isolat aus einem tödlichen Fall, der in Samarkand aufgetreten war, in den Katalog der von Arthropoden übertragenen Viren.[49]
1969 wurde der russische Stamm, den Chumakov an die RFVL geschickt hatte, als identisch mit dem Kongovirus veröffentlicht.[50]
1973 verabschiedete das Internationale Komitee für die Taxonomie von Viren Krim-Kongo-Hämorrhagisches Fieber-Virus als offizieller Name.[51]
Diese Berichte enthalten Aufzeichnungen über das Auftreten des Virus oder von Antikörpern gegen das Virus aus Griechenland, Portugal, Südafrika, Madagaskar (die erste Isolierung von dort), dem Maghreb, Dubai, Saudi-Arabien, Kuwait und dem Irak.[52][53][54]
Verweise[edit]
- ^ ein B C D e F g h ich J k l m n Ö P Q R S T du v w x “Krim-Kongo-hämorrhagisches Fieber”. Weltgesundheitsorganisation. Januar 2013. Archiviert vom Original vom 13. Juli 2017. Abgerufen 18. Juli 2017.
- ^ ein B Berger S (2017). Hämorrhagisches Krim-Kongo-Fieber: Globaler Status: Ausgabe 2017. GIDEON Informatics Inc. p. 7. ISBN 9781498815567. Archiviert vom Original vom 10.09.2017.
- ^ “Ebola-Virus-Infektion – Differentiale | BMJ Best Practice”. bestpractice.bmj.com. Abgerufen 21. Mai 2018.
- ^ Magill AJ (2013). Hunters Tropenmedizin und neu auftretende Infektionskrankheiten, Expertenberatung – Online und Print,9: Hunters Tropenmedizin und neu auftretende Infektionskrankheiten. Elsevier Gesundheitswissenschaften. P. 334. ISBN 978-1416043904. Archiviert vom Original vom 04.08.2017.
- ^ ein B “Hämorrhagisches Krim-Kongo-Fieber, Merkblatt Nr. 208”. WER. Januar 2013. Archiviert vom Original am 2015-05-20. Abgerufen 2015-05-19.
- ^ Virus Taxonomy: 2018 Release, EC 50, Washington, DC, Juli 2018, E-Mail-Ratifizierung Oktober 2018 (MSL #33) https://talk.ictvonline.org/taxonomy/
- ^ ein B Carter SD, Surtees R, Walter CT, Ariza A, Bergeron , Nichol ST, et al. (Oktober 2012). “Struktur, Funktion und Evolution des hämorrhagischen Krim-Kongo-Fiebervirus-Nukleokapsidproteins”. Zeitschrift für Virologie. 86 (20): 10914–23. mach:10.128/JVI.01555-12. PMC 3457148. PMID 22875964.
- ^ Xiao X, Feng Y, Zhu Z, Dimitrov DS (Juli 2011). “Identifizierung eines mutmaßlichen Krim-Kongo-Hämorrhagischen-Fieber-Virus-Eintragsfaktors”. Biochemische und biophysikalische Forschungskommunikation. 411 (2): 253–8. mach:10.1016/j.bbrc.2011.06.109. PMC 3155881. PMID 21723257.
- ^ ein B Carroll SA, Bird BH, Rollin PE, Nichol ST (Juni 2010). „Alte gemeinsame Abstammung des hämorrhagischen Krim-Kongo-Fiebervirus“. Molekulare Phylogenetik und Evolution. 55 (3): 1103–10. mach:10.1016/j.ympev.2010.01.006. PMID 20074652.
- ^ ein B Bente DA, Forrester NL, Watts DM, McAuley AJ, Whitehouse CA, Bray M (Oktober 2013). “Hämorrhagisches Krim-Kongo-Fieber: Geschichte, Epidemiologie, Pathogenese, klinisches Syndrom und genetische Vielfalt”. Antivirale Forschung. 100 (1): 159–89. mach:10.1016/j.antiviral.2013.07.006. PMID 23906741.
- ^ Mehravaran A, Moradi M, Telmadarraiy Z, Mostafavi E, Moradi AR, Khakifirouz S, et al. (Februar 2013). „Molekularer Nachweis des hämorrhagischen Krim-Kongo-Fiebers (CCHF)-Virus in Zecken aus dem Südosten des Iran“. Zecken und durch Zecken übertragene Krankheiten. 4 (1–2): 35–8. mach:10.1016/j.ttbdis.2012.06.006. PMID 23238248.
- ^ Ergönül O, Celikbaş A, Dokuzoguz B, Eren S, Baykam N, Esener H (Juli 2004). „Eigenschaften von Patienten mit hämorrhagischem Krim-Kongo-Fieber bei einem jüngsten Ausbruch in der Türkei und Auswirkungen einer oralen Ribavirin-Therapie“. Klinische Infektionskrankheiten. 39 (2): 284–7. mach:10.1086/422000. PMID 15307042.
- ^ Abteilung für hochkonsequente Krankheitserreger und Pathologie, Abteilung Virale spezielle Krankheitserreger (5. März 2014). “Übertragung des hämorrhagischen Krim-Kongo-Fiebers (CCHF)”. CDC. Archiviert vom Original vom 28.04.2014.
- ^ ein B C D Keshtkar-Jahromi M, Kuhn JH, Christova I, Bradfute SB, Jahrling PB, Bavari S (Mai 2011). “Hämorrhagisches Krim-Kongo-Fieber: aktuelle und zukünftige Perspektiven von Impfstoffen und Therapien”. Antivirale Forschung. 90 (2): 85–92. mach:10.1016/j.antiviral.2011.02.010. PMID 21362441.
- ^ ein B sitesi, milliyet.com.tr Türkiye’nin lider haber. “Keneye aşı müjdesi”. Archiviert vom Original am 19.12.2013.
- ^ Kieny M (20. Mai 2015). „Nach Ebola entsteht eine Blaupause, um Forschung und Entwicklung zu starten“. Scientific American Blog-Netzwerk. Archiviert vom Original vom 20. Dezember 2016. Abgerufen 13. Dezember 2016.
- ^ “F&E Blueprint. Liste der prioritären Krankheiten des Blueprints”. Weltgesundheitsorganisation. Januar 2017. Archiviert vom Original am 10. September 2017. Abgerufen 13. Juli 2017.
- ^ Watts DM, Ussery MA, Nash D, Peters CJ (November 1989). „Hemmung der viralen Infektiosität des hämorrhagischen Krim-Kongo-Fiebers in vitro durch Ribavirin“. Das American Journal of Tropical Medicine and Hygiene. 41 (5): 581–5. mach:10.4269/ajtmh.1989.41.581. PMID 2510529.
- ^ Johnson S, Henschke N., Maayan N., Mills I., Buckley BS, Kakourou A, Marshall R, et al. (Cochrane Infectious Diseases Group) (Juni 2018). “Ribavirin zur Behandlung des hämorrhagischen Krim-Kongo-Fiebers”. Die Cochrane Database of Systematic Reviews. 6: CD012713. mach:10.1002/14651858.CD012713.pub2. PMC 5994605. PMID 29869797.
- ^ ein B C “Geografische Verteilung des hämorrhagischen Krim-Kongo-Fiebers (CCHF)”. WER. 2008. Archiviert vom Original vom 13.05.2016.
- ^ “Крымская-Конго геморрагическая лихорадка”.
- ^ Abteilung für hochkonsequente Krankheitserreger und Pathologie, Abteilung Virale spezielle Krankheitserreger (5. März 2014). “Krim-Kongo-Hämorrhagisches Fieber (CCHF) Verteilungskarte”. CDC. Archiviert vom Original vom 18. Juni 2017.
- ^ Fajs L, Jakupi X, Ahmeti S, Humolli I, Dedushaj I, Avšič-Županc T (2014). “Molekulare Epidemiologie des hämorrhagischen Krim-Kongo-Fiebervirus im Kosovo”. PLOS vernachlässigte Tropenkrankheiten. 8 (1): e2647. mach:10.1371/journal.ptd.0002647. PMC 3886908. PMID 24416468.
- ^ Syed Khalique Ahmed, Tanvir A Siddiqui, Anuradha Mascarenhas, Anuradha Mascarenhas, Tanvir A Siddiqui, Syed Khalique Ahmed : Pune, Ahmedabad Tödliches Virus – tritt zum ersten Mal in Indien auf und tötet drei in Gujarat Archiviert 2011-03-04 auf der Wayback Machine indianexpress.com, 19. Januar 2011
- ^ “Kongofieber: Patient stirbt im Krankenhaus”. BBC News. 6. Oktober 2012. Archiviert vom Original vom 7. Oktober 2012.
- ^ “Kongofieber: Sieben sterben in Amreli in einer Woche Mobile Site”. IndienTv. Indientvnews. 2013-07-15. Archiviert vom Original vom 04.03.2016. Abgerufen 2015-03-28.
- ^ “Kongofieber im Dorf Amreli bestätigt”. Die Zeiten von Indien. Archiviert von das Original am 23.09.2013.
- ^ Biryabarema E (17. August 2013). “Drei sterben in Uganda an Ebola-ähnlichem Fieber: Gesundheitsministerium”. Yahoo Nachrichten. Reuters. Archiviert vom Original vom 20. August 2013. Abgerufen 16. August 2013.
- ^ Otto A. (22.08.2013). „Höchste Alarmbereitschaft wegen Krimfieber“. Der Beobachter. Kampala. Archiviert vom Original vom 14. Juli 2014. Abgerufen 26. August 2013.
- ^ Khan H (2014-07-11). “Ausbrüche eindämmen: Achter Patient stirbt an hämorrhagischem Kongo-Fieber bei HMC”. Archiviert vom Original am 13. Juli 2014. Abgerufen 13. Juli 2014.
- ^ “Gesundheitsbeamte bestätigen Tod des Jaisalmer-Mannes im Kongofieber”. The Times of India Mobile Site. 26. Januar 2015. Archiviert vom Original vom 2. April 2015. Abgerufen 30. März 2015.
- ^ “Kutch-Bewohner stirbt an Konfo-Fieber”. Der indische Express. 29. März 2015. Archiviert aus dem Original vom 3. April 2015. Abgerufen 29. März, 2015.
- ^ „Hämorrhagisches Krim-Kongo-Fieber breitet sich in ganz Indien aus – Outbreak News Today“. 9. Oktober 2015. Archiviert vom Original vom 20.12.2015.
- ^ „Erster lokaler Fall einer durch Zecken übertragenen Krankheit tötet einen Menschen in Spanien“. Wissenschaftler amerikanisch. nd Archiviert vom Original am 02.09.2016. Abgerufen 2016-09-03.
- ^ Negredo A, de la Calle-Prieto F, Palencia-Herrejón E, Mora-Rillo M, Astray-Mochales J, Sánchez-Seco MP, et al. (Juli 2017). “Autochthones hämorrhagisches Krim-Kongo-Fieber in Spanien”. Das New England Journal of Medicine. 377 (2): 154–161. mach:10.1056/NEJMoa1615162. PMID 28700843.
- ^ Spengler JR, Bente DA (Juli 2017). “Hämorrhagisches Krim-Kongo-Fieber in Spanien – Neuankömmling oder stiller Einwohner?”. Das New England Journal of Medicine. 377 (2): 106–108. mach:10.1056/NEJMp1707436. PMC 5922251. PMID 28700846.
- ^ „Kongovirus: Ärzte warnen vor Krankheitsausbruch“. Die Express-Tribüne. 17. August 2016. Archiviert vom Original vom 6. September 2016.
- ^ “Karachi: Kongo-Virus fordert ein weiteres Leben – Pakistan – Dunya News”. Archiviert vom Original vom 04.09.2016.
- ^ Karim AM, Hussain I, Lee JH, Park KS, Lee SH (April 2017). “Überwachung des hämorrhagischen Krim-Kongo-Fiebers in Pakistan”. Die Lanzette. Infektionskrankheiten. 17 (4): 367–368. mach:10.1016/S1473-3099(17)30119-6. PMID 28346174.
- ^ Alam MM, Khurshid A, Rana MS, Aamir UB, Salman M, Ahmad M (August 2017). “Überwachung des hämorrhagischen Krim-Kongo-Fiebers in Pakistan”. Die Lanzette. Infektionskrankheiten. 17 (8): 806. doi:10.1016/S1473-3099(17)30403-6. PMID 28741546.
- ^ https://hsgm.saglik.gov.tr/tr/zoonotikvektorel-kkka/zoonotikvektorel-kkka-istatistik
- ^ https://hsgm.saglik.gov.tr/depo/birimler/zoonotik-vektorel-hastaliklar-db/zoonotik-hastaliklar/1-KKKA/3-istatistik/KKKA_Haritalar_2017_Dahil.pdf
- ^ “7 Tote bei Ausbruch des Kongofiebers in Mali”. medicalxpress.com. Abgerufen 8. Februar 2020.
- ^ Garry Shaw (2016), “Menschliches Blut, Organe und ein überraschender Virus in alter Keramik entdeckt”, Wissenschaft (auf Deutsch), doi:10.1126/science.aal0490
Conner J. Wiktorowicz et al.: Hämorrhagisches Fiebervirus, menschliches Blut und Gewebe in Leichengefäßen der Eisenzeit. In: Zeitschrift für Archäologische Wissenschaft. Band 78, 2017, S. 29–39, doi:10.1016/j.jas.2016.11.009 (Online-Vorabveröffentlichung vom Dezember 2016) - ^ Cromwell, Judith Lissauer, Florence Nightingale, Feministin, McFarland, 2013, S.149
- ^ “Природная очаговость зоонозных инфекций в Крыму”. ир Животных. Archiviert vom Original vom 23.09.2016.
- ^ Simpson DI, Knight EM, Courtois G, Williams MC, Weinbren MP, Kibukamusoke JW (Februar 1967). „Kongovirus: ein bisher unbeschriebenes Virus, das in Afrika vorkommt. I. Menschliche Isolierungen – klinische Anmerkungen“. Ostafrikanisches medizinisches Journal. 44 (2): 86–92. PMID 6040759.
- ^ Woodall JP, Williams MC, Simpson DI (Februar 1967). „Kongovirus: ein bisher unbeschriebenes Virus, das in Afrika vorkommt. II. Identifizierungsstudien“. Ostafrikanisches medizinisches Journal. 44 (2): 93–8. PMID 6068614.
- ^ Chumakov MP, Butenko AM, Shalunova NV, Mart’ianova LI, Smirnova SE, Baschkirtsev Iu, et al. (Mai–Juni 1968). “[New data on the viral agent of Crimean hemorrhagic fever]”. Voprosie Virusologii (auf Russisch). 13 (3): 377. PMID 4235803.
- ^ Casals J (Mai 1969). „Antigene Ähnlichkeit zwischen dem Virus, das das hämorrhagische Krim-Fieber verursacht, und dem Kongo-Virus“. Tagungsband der Gesellschaft für Experimentelle Biologie und Medizin. 131 (1): 233–6. mach:10.3181/00379727-131-33847. PMID 5770109. S2CID 30654789.
- ^ Ergönül O, Whitehouse CA (2007). „Persönliche Reflexionen, Jack Woodall“. Hämorrhagisches Kongo-Fieber: Eine globale Perspektive. Niederlande: Springer. P. 23. ISBN 978-1-4020-6105-9.
- ^ Crowcroft NS, Morgan D, Brown D (März 2002). „Virales hämorrhagisches Fieber in Europa – eine wirksame Bekämpfung erfordert eine koordinierte Reaktion“. Euro-Überwachung. 7 (3): 31–2. mach:10.2807/esm.07.03.00343-de. PMID 12631941.
- ^ Al-Tikriti SK, Al-Ani F, Jurji FJ, Tantawi H, Al-Moslih M, Al-Janabi N, et al. (1981). “Hämorrhagisches Fieber Kongo/Krim im Irak”. Bulletin der Weltgesundheitsorganisation. 59 (1): 85–90. PMC 2396030. PMID 6790183.
- ^ Okorie TG (März 1991). „Vergleichende Studien zur Vektorkapazität der verschiedenen Stadien von Amblyomma variegatum Fabricius und Hyalomma rufipes Koch für das Kongovirus nach intrazölomischer Inokulation“. Veterinär-Parasitologie. 38 (2–3): 215–23. mach:10.1016/0304-4017(91)90131-e. PMID 1907050.
Externe Links[edit]
Recent Comments