組織化 – ウィキペディア、無料百科事典
いわゆる ARCOROLANTANIDO ランタネート元素と炭素原子の間のリンクを含む化合物へ。 [ 初め ] Organoactínidsは、炭素原子とウランなどのアクチニド金属の原子との間のリンクを持つ化合物と同じ方法で定義できます。
ランタニード元素の電気陰性度が低いため、化合物の特性 ARCOROLANTANID それらは、メインフォーミュラグループの元素の有機ethal化合物のそれよりもよく似ています 3 o ml 2 、「d」ブロックの要素の対応物よりも。特に、の構造と化学反応性 ARCOROLANTANID それは、メイングループの元素の有機化合物で発生するように、静電的および立体的相互作用によって根本的に支配されています。これは、ブロックの要素の有機金属化合物の化学反応性と構造を支配する金属リガンド相互作用ではなく、金属リガンド相互作用によってではありません。 d 。
炭素原子の顕著な炭酸作動性の特性がランタニードの元素とこれらのオクソフィリック特性に統合されているため、化合物 ARCOROLANTANID それらは空気と水分に非常に敏感です。さらに、式lnの化合物(c 5 h 5 )) 3 の 5 h 5 )) 2 の(c 5 h 5 )。この反応性は、遷移要素の有機金属化合物では観察されません。
継続するセクションでは、これらすべての特性の原因と、最も代表的な化合物の反応性について詳しく説明します。
1.はじめに。
フェロセンの発見[信仰(η 5 -C 5 h 5 )) 2 ] (初め) 1952年には、化学の非常に重要な進歩を意味し、ブロックの類似の化合物を達成することに関心が高まっています f 。 1956年には、ブロックの最初の明確な有機金属化合物を合成することができました f 、[u(η 5 -C 5 h 5 )) 3 Cl]。ただし、この化合物は、3つのシクロペンタディエニルフラグメント(CP)と塩化物を含むことによって構成されていますが、本質的には「本質的に」と見なすことはできませんでした。 サンドイッチコンパウンド 」だからこそ、1968年までフェロセンに類似した真の調査を続けました。 8 -C 8 h 8 )) 2 ] (2) 。それ以来、両方のグループの有機金属化学の違いが明らかです。
ランタニドイオン(およびアクチニド)は硬いルイス酸であるため、通常はFのような硬いルイスベースを調整します – y h 2 また。
これらのイオン+3の間の最も一般的な負荷であるため、これらは眼窩電子が軌道に位置するため、貴重なガスとして機能します4 f 、リガンドの軌道と相互作用するために非常に内部的なものです。したがって、ランタニード複合体は静電相互作用に基づいています( イオンリンク )。
アクチニドの場合、軌道5 f 、それらはリガンドの軌道によりアクセスしやすく、より共有結合を達成しますが、この特性は原子数が増加すると減少します。
ランタニドの原子半径は非常に大きいため、イオンの負荷は非常に効果的に分布していますが、それでも最も一般的な酸化状態は+3であるため、これらのイオンは高い電子密度を持っています。ブロックで前進することにより、原子半径が減少し、大きな原子金属に著しくイオン特性を付与します。
ブロック調整化学 f 18電子の規則に要約することはできません。これは、その場合は32になりますが、ほとんどの場合、リガンドが配位分野で引き起こす立体効果によって決定されます。同様に、このような構造に関与する多数の電子は、通常、典型的な計算とその形状の決定を可能にする分光分析を複雑にします。
ブロックの有機金属化合物 f 、それらは、酸素と水に対する安定性の観点から、ブロック内の最も近いグループの金属の点で似ています d 。
2.β誘発とアガスティックな相互作用。
アルキー・ランタニドは通常、立体効果のために化学量論を決定します。 [ 2 ]
lantanidsはπドーナーとの強力なリンクを形成しないため、β除去の一般的な中間体(η 2 -alqueno)は、水素化物に迅速に分離して分解することはほとんど不可能であり、後で分解します。
反応が実行される要件を覚えておいてください:
i)主原子(m)に関して、β位置にHの存在。
ii)M -Cリンク a –C b –h b 彼らはコプラナレスでなければなりません。
iii)mには、hとリンクするために適切な空のエネルギーとガイダンス軌道が必要です b 。
したがって、ブロックの要素を考慮して f 、それらはさまざまなアドレスに利用できる多数の軌道を持っていますが、アルカイルとアルキードはβ誘発に非常に影響を受けやすいと予想されます。空の軌道の配置が減少するため、原子数を増やすことで減少する感受性。

β除去とα誘発があまりもっともらしいものではない、協調数が低い化合物では、誤った相互作用を通じて配位数を増やすことができます。
C -H結合は金属の傾向があるため、効果によって安定化された分子内水素橋を形成し、また金属中心を協調的に飽和させます。
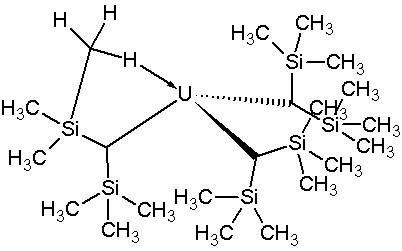
図は、u(chtms)化合物のγアドディック相互作用を教えました 3 。
3.シクロペンタディエニル – ラントラヌス。
遷移金属と同様に、反応性レベルでの多用途性と分解に対する安定性が高いことを考えると、シクロペンタディエン型リガンドを含む化合物は非常に一般的です。
これらのリガンドの真の恵みは、前述の反応的汎用性を考えると、異なるサイズの多数のグループを導入する可能性があり、異なるレベルの立体保護を金属中心に付与する可能性があるということです。
3.1。単純なシクロペンタディエニル。
一般的な「ln」記号でランタニデスを表します。
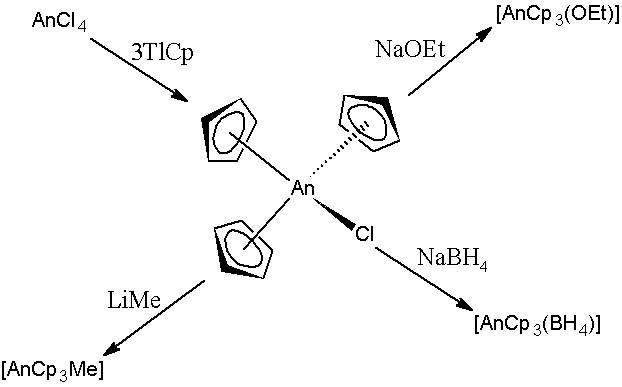
シクロペンタディエニルLN化合物には3つのタイプがあります:[lncp n バツ 3-n ] {1≤n≤3}。
それらを合成する方法は、無水ランタニドのハルロスをナトリウムサイクルと反応させることです。最も使用される溶媒はエーテルですが、これらのイオンの性質を考えると、最初のセクションでコメントしたことを考えると、ln -or(r)リンクは非常に強力であるため、それらを壊すことが難しい場合があります。
想定できるように、関連するリンクのイオン性を考えると、LNCP反応 3 con fecl 2 フェロセンの (初め) 。ただし、LNCP化合物 2 CLはそれほど簡単に反応しず、二量体の形で見られるか、それらを含むエーテルの分子に重く関連していることができます。

画像では、左側にLNCP型化合物のダイモリック構造が表示されます 2 x x = haluroでx。ハルロ橋は特に安定しています。 p それらは方向です。
右側では、エーテル溶液(THF)のモノマーは、エーテル酸素と強く調整します。
LNCP 3 sublimanは、溶媒との調整を破る効果的な方法であるボイドで熱くなるとすぐに。
前述の立体要件を考えると、近くのLN(アトミック数が少ないため、優れた原子無線)がLNCP構造を持つことができます n 固体状態に非常に大きな調整番号があります:

CPリガンドを持つOrganactínidsは、対応するOrganolandansに非常に似ています。 ANCPタイプ化合物 3 (「一般的なアクチネート」であること)はよく知られていますが、ANCPCLタイプのものは詳細に研究できませんでした 2 、このようにして、非常に反応性の高いアクティブ中心は非常に保護されていないため、CPリングにかさばるリガンドの導入により解決される事実です。
驚いたことに、ほとんどのANCP化合物 n と m 、LNCP化合物に相同性化された四重系化合物に基づいています n バツ 3-n 、しかし、これらはFECLと反応しません 2 AN -CPリンクはより共有特性を持っているため、フェロセンを与えるために(最初のセクションで説明したように)。
ANCP化合物 3 x、このxは、次のスキームで教えられているようにすばやく削除できます。
3.2。サイクリングを交換しました。
以前のセクションで進んだように、CPリガンドを別の含有置換基(CP ’)に置き換えると、立体効果の特定のセンターの安定性と特性に影響を与える可能性があります。
広く使用されているリガンドは、ペンタメチルシクロペンタディエニロです(c 5 (ch 3 )) 5 [cp*])、それは非常にかさばることで、化合物の合成を妨げる[lncp* 3 ]、しかし[lncp*のそれ 2 x] y [ancp* 2 バツ 2 ]、トリオの四重系化合物は直径であり、NMRによって分析できるため、トリウムでは大きな関心が高まっています。
次のスキームでは、水素化物の合成経路が示されています (3) それは、11番目のポケットリングとα-アルケノスの水素化におけるカタリンジャーとしてです。

画像では、水素化物 (3) 極性リンク(CO)の挿入に苦しみ、酸化します。 COはηに縮小されます 2 -前者。
三価の化合物[lncp* 2 x]は非常に反応的であり、x = me、hなどの小さくて適切な置換基を備えています。それらは、C -Hリンクを交換できる数少ないシステムの1つです。 ENCHESのメタセシス 。

化合物は、アルカン(赤)を破壊する強力なベースとして機能します。
ヘテロアトモス電子ドナーを使用した機能化チェーンの添加は、通常、タイプ化合物を安定させます[LNCP 2 r] r =短いアルキル、調整により。
4. CARBANILOSおよび関連。
遷移金属のカルボニル化合物は非常に一般的です。これは、COのホモ軌道と金属のルモの間の重複するσの大きな効率を考えると、COの軌道内腔とレトロドー酸中の金属のホモの間のオーバーラップπのようにローストされます。この相乗作用は、ブロック金属で達成することが困難です f 、バレンシアの電子は非常に内部軌道であるため、CoのHOMOおよび/またはLUMOとの相互作用を妨げます。

それでも、40 K未満の温度でのランタニデスとCO(G)の凝縮により、化合物LN(CO)が生じます n {1≤n≤6}、cosが端子であるというIRの分光分析に感謝します。これらの化合物は、温度が上昇するとすぐに分解します。
低原子数では、電子はよりびまんでいるため、共有結合を形成することができます。そのため、保護リガンドが標準的な実験室条件で合成できるため、ウランやシクロペンタディエニロなどの金属では、化合物などの単純なカルボニル化合物で合成できます。 (4) 。したがって、イオン性のランタニドは、これまでの相同化合物を形成することができませんでした。

この挙動は、[MCPの化合物で行われる分光研究によって強化されています 3 (CN -ET)]、CN -Rはcoに隔離されているため。 m = ln、eetcnに対応する複合体よりも優れている複合体は、それとは反対に、m = an、ν(cn)がettn freeのそれよりも小さいことを示唆しています。
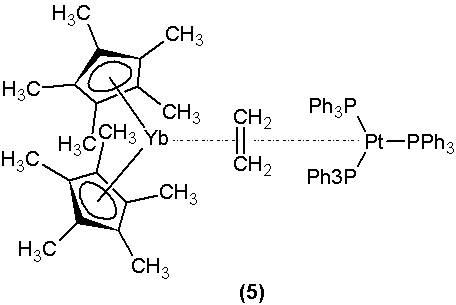
別のアイソレクトロニクスリガンドはnです 2 、しかし、遷移金属と希土類の両方の場合(ブロック金属 f )、これはお粗末なリガンドであり、たとえば低状態の金属中心への通常の追加によって達成できます。アルケンとアルキノのリガンドを含む複合体は、希土類の合成が困難です。複合体 (5) これは、2番目のPTメタリックセンターの存在に対する安定性を負っている独特の例です。 0 ( d 十 )電子が豊富な場合、レトロドーテーションの優れた能力があり、オレフィンに電子密度を与え、したがって、よりマークされたルイスベースの特性を付与すること

5.アレノランタニド錯体。
Areno(AR-R)錯体は、COSに反してπドーナー、σacceptorsであるため、ランタナイドセンターに対するより妥当な挙動が予想されます。
ただし、軌道Δのオーバーラップは、πサンドシステムのこれらの軌道と金属の軌道との間に大きなエネルギーの違いがあるため、達成が困難であるため、リトロード化はありそうにありません。
これが、アレノランタニド複合体が非常に豊富で、通常、低酸化状態で金属を形成している理由です。したがって、ブロック金属のバレンシア軌道以来 f それらは非常に内部であり、最も一般的な酸化状態は+3および+4であると、これらのリガンドは通常、そのような中心には適していません。
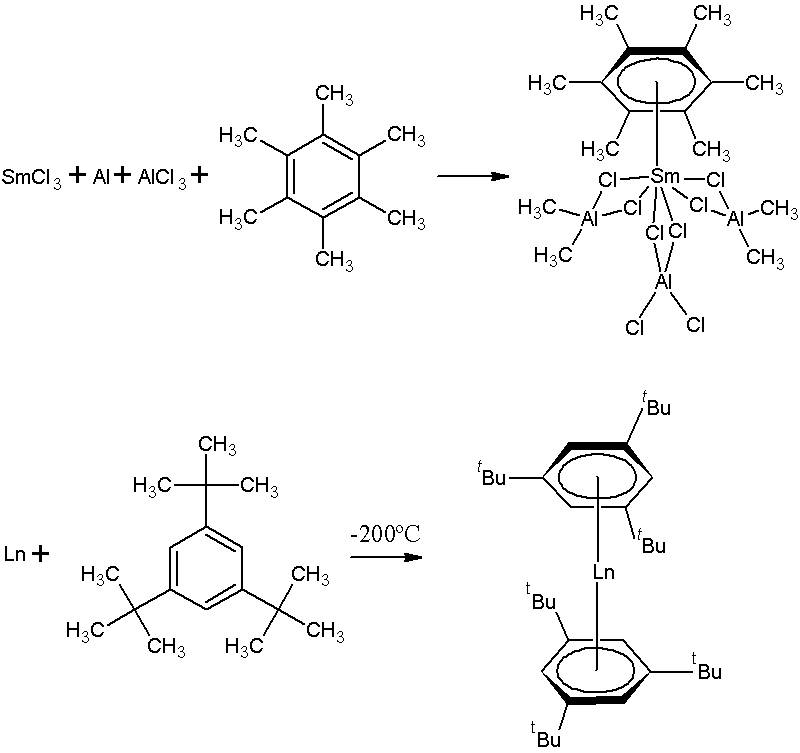
先行する最後の図の下部で教えられた合成では、ランタニド金属の冷たい蒸気凝縮は[η 6 -1,3,5-( t これ) 3 c 6 h 3 ]、アレニックリガンドのまろやかな複雑さが金属中心を運動的に保護する複合体をもたらすため、一部の人は100°Cで分解せずに真空を昇華させることさえできます。
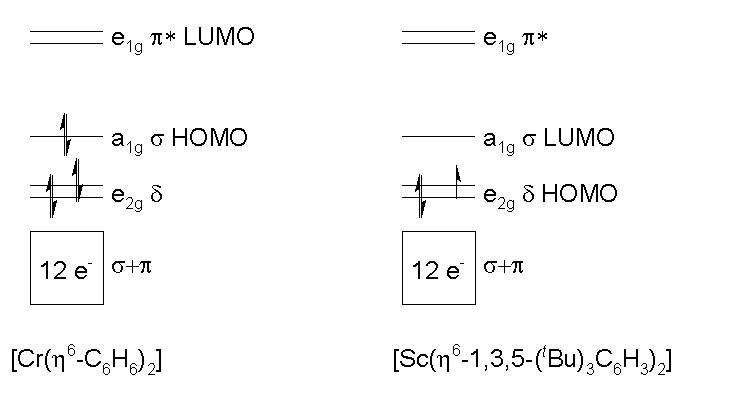
[cr(ηなどのゼロベルトアレニック錯体の安定性 6 -C 6 h 6 )) 2 ]( d 6 )レベルσとπの両方が満たされ(リガンドからの電子)、レベルとレベルも満たされている単純化されたOOMMスキームの分析によって理解できます。 2g (d)y a 1g (σ)。
現在、ランタニデスには化学があります。遷移金属に類似している場合、SCのそれと比較できるため、スカンジオの相同化合物を検討します。 [sc {η 6 -1,3,5-( t これ) 3 c 6 h 3 } 2 ]( d 3 )。リガンドの電子はレベルσとπを12個の電子で満たしますが、今では3個の金属電子しかありません。レベルEを不完全に埋めるためだけのものです。 2g 。この状況は分子に不安定性をもたらし、実際、この化合物はパロフォリックです。
ランタニデスの畑に移動する、一般的な電子構成[xe] 4 f n 5 d 0 6 s 2 {1≤n≤14}、これらの電子 f 、すでに述べたように、それらは内部が多すぎるため、Maceがないので、ArenicシステムのΔ軌道と相互作用することはできません。しかし、電子の促進に必要なエネルギーを考慮すると f 軌道へ d :[car] 4 f n 5 d 0 6 s 2 [車] 4 f n-1 5 d 初め 6 s 2 、GDでは最小限であることがわかります( f 8 ) そしてその ( f 初め )、このプロモーションはセミレナ層とケープによる安定性の増加を引き起こすため d 軌道に電子を与えながら、それぞれ充填します d 、それはより拡散しているため、効果的なオーバーラップを理解しています。相互にこのエネルギーは、EUと同じ理由で最大です。
LN-アレノボンドエネルギーはこのプロモーションエネルギーを補償するため、アレノランタニドシステムが可能です。
6.シクルオクタテラン – ランタニド錯体。
Cyclooctateraen(COT)のニーズ 8 。それはかさばっていて、CP*と同じ立体効果を付与します。
6.1。ウラノセノ。
[u(the 8 – コット) 2 ]および誘導体は、メタセシスによって類似のフェロカーで合成できます。
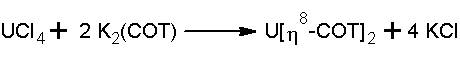
分子は、COTリングと中央にウラン金属中心を含む2つの平行平面に基づいており、対称性を与えます d 8時間 。
最も顕著な相互作用は、OMδの相互作用です(E 2g )OOAA 6のコット d uとomδのuとそれの(e 2と2 )COTとOOAA 5 f uのタイプが化合物[m(η)を理解することにつながる 8 – コット) 2 ] Mがタイプの原子軌道を持っている場合、より安定しています f 。
6.2。ランタニドのベッドコンプレックス。
Cerioは、COTとニュートラルなサンドイッチ錯体を形成できる唯一のランタニドであり、化合物でそうします[CE(η 8 – コット) 2 ]、しばらくの間、イオンの強く酸化されている性質にもかかわらず信じられていた +4 、それは構成されましたが、最近の研究は、それが実際に三価で構成されていることを示しています( f 初め )COTにリンク -1.5 。
この化合物は、ナトリウムやカリウムなどの還元剤と反応し、他の方法で調製できる三価CEの化合物に還元されます。これらのリンクの性質は、それが既に想定されている方法、イオンです。 UCLと反応します 4 ウランチャネンを与える。 [ 3 ]
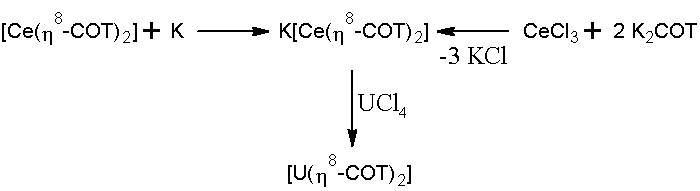
参照してください [ 編集します ]
残りの原子との化学炭素リンク [ 編集します ]
| 基本的な有機化学。 | 化学の多くの使用。 |
| 学術研究、 しかし、広く使用されていません。 |
不明なリンク / 未評価。 |
参照 [ 編集します ]


![{displaystyle mathrm {LnCl_{3} +n NaCp {xrightarrow[{-NaCl}]{}} LnCp_{n}Cl_{3-n}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e71a5c9f5946bcf6a7e64bca267760d51b5daa0)
Recent Comments