変性(生化学) – ウィキペディア

変性 タンパク質(タンパク質)やデオキシリボ核酸(DNS)などの生体分子の構造変化を示します。これは、ほとんどの場合、この分子の生物学的機能の喪失に関連していますが、その主要な構造は変化しませんが。変性は、物理的または化学的影響によるものです。

外部の影響は、最小の衝動の原理に従って、タンパク質や核酸などの生体高分子の構造的変化を引き起こす可能性があります。タンパク質を変性させると、二次構造と三次構造(したがって、おそらく四級構造)をアミノ酸の順序を変更せずに変化させると、その主要な構造が変化します。しかし、タンパク質は元の折り畳みの形態を失います。 ネイティブ ポリペプチド鎖の構成または構成。折り畳みが失われると、本質的に非構造化されたタンパク質を除き、タンパク質の機能も失われます。 [初め] 変性のプロセスは、ネイティブ形式がエネルギーが最も安い状態を表すかどうかに応じて、不可逆(不可逆)または可逆的(可逆的)になります。変性の反転プロセスも意味します レネタレーション 。 [2] 多くのタンパク質を3Atedし、その機能を復元できるため、 [3] ネイティブ形態は通常、エネルギー的に最も安価な状態(Einnsen Dogma)を表すため、タンパク質生合成のタンパク質折りたたみが起こると仮定されました。 [4]
分子構造のこのような可逆的な変化は、たとえば、DNAが加熱された場合、たとえば、ポリメラーゼ連鎖反応(PCR)の例で加熱することにより個々の鎖に分解され、再び冷却する場合です。二重鎖DNAとRNAは、水素橋の結合による塩基対の間に一緒に保持されます。これは、変性が発生した場合に可逆的に解決されます。対照的に、分子構造の不可逆的な変化の後、分子の元の空間構造を復元することはできません。たとえば、このような変更は、調理中に朝食の卵を学び、 [5] それは、「硬い卵」になると、また調理によっても、冷却によって先見の明に移すことはできません。タンパク質の変性は通常、分子が不活性化されていることを意味します。つまり、生物学的機能をほとんどまたはほとんど満たすことができないことを意味します。したがって、変性は保存と消毒にも使用されます。
すべての変性プロセスには、共有結合が分割されていないこと(タンパク質のジスルフィドブリッジを除く)が共通しているため、一次構造が保存されています。 [6] 一次構造としてのチェーン構造、したがってビルディングブロックのシーケンスは保存されます。しかし、個々のビルディングブロック、ヌクレオチド、アミノ酸または分子鎖全体が非常に非常に振動するため、他の結合力(イオン、極性、van-der-waals相互作用、疎水性効果)が分子鎖の異なる領域の間で除去され、そのような結合が除去されます。タンパク質のジスルフィドブリッジは、サルフヒドリレンを減少させることにより、ほとんど分割されています。 [7] タンパク質の場合、変性の場合には溶解度の低下がしばしば観察されます。 [3] タンパク質凝集体の形成を部分的に伴う。変性が発生した場合、プロテアーゼによる故障に対する感度も増加します。 [3]
バイオポリマーの立体構造の変化は、FTIR、デュアル偏光インターメトリー、循環性、QCM-D、NMR分光法、およびマルチパラメトリック表面プラスモン共鳴分光法で測定できます。
物理的な影響下で最も一般的な変性は、加熱と放射線思考です。物理的には、変性は、高圧、強い攪拌、揺れ、超音波の影響、および表面吸収によって引き起こされる可能性があります。 [8]
暖房 [ 編集 | ソーステキストを編集します ]


熱または 暖房 は、温度を上げることで分子構造の変化がもたらされる変性の一種です。通常、熱への曝露 いいえ 共有共有化学結合が破損または形成されるため、一次構造は変わらないままです。代わりに、水素橋は破損または再形成されます。これは通常、鎖切片間の結合であり、酵素や他のタンパク質の三次構造を変更するためにしばしば発生します。これは通常、生物活性の喪失と溶解度の低下をもたらします。後者は、「フレークアップ」または「凝固」として顕著になります。疎水性効果もタンパク質の折り畳みに役割を果たすため、変性は温度の上昇に伴う疎水性効果の低下から生成されます。加熱された帰化は(他の変性と同様に)、構造の変化がまだあまりにも深刻ではない場合、可逆的である可能性がありますが、しばしば不可逆的です(不可逆的)。ただし、遠心分離機と尿素の添加の助けを借りて、実験室条件下では逆転が可能です。たとえば、発生するせん断パワーは、部分的に「抽出」することができます。 [9] タンパク質が始まる温度は、構造と生物に応じてまったく異なります。ハイパー – セルモフィリックアルケの酵素は、80°Cをはるかに超える温度に耐えなければなりません。加熱による変性は、わずかに酸性の溶液で補強されます。 [十] タンパク質の熱変性は通常、比較的狭い温度範囲で実行されます。そのため、変性中の協同組合の発達が疑われています。 H.開発はさらに有利です。 [7]
自動病原体は、重要なバイオポリマーを変性させることにより、オブジェクトに不活性化されます。オートクレーブでは、安全に滅菌するために、特定の時間にわたって圧力が増加して100°Cをはるかに超える温度を観察する必要があります。オートクレーブは医療機器の生産と洗浄に使用されますが、熱や湿気に敏感な材料には適していないため、多くの場合、コバルト60からの電離放射線で処理されます。 [11]
核酸は、「融点」とも呼ばれるかなり狭い温度間隔内で変性します。これは通常80°Cを超えています。変性は可逆的です。核酸を冷却することにより、個々の鎖が一緒に戻ってきます。このプロセスは、in vitroで生物から特定の遺伝子を再現するためにPCRの実装において分子生物学で使用されます。抽出されたDNAは、反応容器(変性)で約95°Cの高温で溶けます。次に、温度を特定の温度まで再び下げます。このアニーリング温度はプライマーに依存し、通常はそれぞれの融点(通常は50〜65°C)の下に2〜3°Cです。溶液に含まれるプライマーは、DNA個々の鎖(アニーリングまたは一次ハイブリダイゼーションと呼ばれる)に配置されます。これで、68〜72°Cの温度でTAQポリメラーゼの助けを借りて、鎖が再び完成しました(伸長)。変性、アニーリング、伸びのサイクルが再び始まります。約25〜50サイクルが実行されます。したがって、DNAの可逆的な変性は、生物の検索を再現するために最大50回を利用します。変性が発生した場合、DNAの絶滅は260 nmの波長で約40%増加します。 [12番目]
圧力による変性 [ 編集 | ソーステキストを編集します ]
タンパク質をフィッティングすると反応容積は非常に少ないため、タンパク質を発達させるには通常、数枚の1000 barの圧力を費やす必要があります。それにもかかわらず、実際には食物の高い圧力治療 [13] ますます重要になっています。この目的のために、ほとんどがホイルで詰め込まれた食品は、次のような印刷媒体にあります。 B.与えられた水とこの媒体に圧力がかかります。この「非熱プロセス」、高圧低温殺菌、望ましくない微生物、および酵素は不活性化され、食物は耐久性があります。熱の使用と同様に、品質の喪失は回避されます。
一般に、タンパク質の三次および第四紀構造は圧力の影響を受けますが、二次構造はほとんど変更できません。
放射線による変性 [ 編集 | ソーステキストを編集します ]
波長の電磁放射 大きい 目に見える光として(したがって、光子あたりのエネルギー 小さい 目に見える光として) それ自体が 変性を引き起こさないでください。これは、赤外線、マイクロ波、電波に適用されます。ただし、温度を上げることにより、加熱(上記参照)が発生する可能性があります。この原則に従ってマイクロ波ストーブが機能します。人々は – ほとんどの高い生き物と同じように – 暖かさを知覚できるので、それはしばしば長い波放射によって引き起こされる可能性のある損害を避けるためだけです。
イオン化放射線では異なります。紫外線(制限付き)、ガンマ、X線も共有結合になる可能性があります。 B.核酸から壊れているため、鎖切断(解重合)などのDNA損傷を引き起こします。さらに、結合分裂の結果として、新しい共有結合(核酸の二量体化など)も作成できます。特定のしきい値エネルギーからの単一の光量は、化学結合を破壊したり、イオン化を引き起こすことができるため、個々の光子はすでにかなりの損傷を引き起こす可能性があります。イオン化のため、いくつかの分子でさえ連続してカスケードがあります。必要な放射線量は熱変性よりも低く、AIDSのない人はこの放射線を知覚できないため、取り返しのつかない損傷がすでに発生している場合にのみ影響が認められます(日焼け、放射線疾患の最悪の場合の放射線紅斑)。 Sievertガンマ放射線は、照射腫瘤のキログラムあたりのジュールエネルギーに対応しており、放射線疾患の急性症状にはすでに十分です。ケルビンを加熱するために一キログラムを加熱するために カルフール 必要。 (比熱容量)。 4キロシーバートの同等の用量は、すべての既知の高級動物にとって致命的であり、Deinococcus radiodurans(非常にラジオトールサントン微生物)の胞子の形にしかありません。一方、これは、放射線で生殖する食物を作るために使用できます。微生物は確実に殺されますが、化学的防腐剤の添加なしに多くのビタミンと栄養素が残っていないか、ほとんどないかほとんどありません。
タンパク質化の原因は、たとえば、いくつかの酸、塩基、塩(グアニディナム塩など)、決定または尿素などの化学物質です。 [14] イオンはアミノ酸残基と複雑な構造を形成し、したがってタンパク質の生物学的に活性な構造を変化させるため、タンパク質構造は重金属の影響を受ける可能性があります。
酸と灰汁の生き物 [ 編集 | ソーステキストを編集します ]
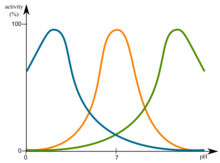
タンパク質の自然環境のpH値に応じて、タンパク質にはpHが最適です。この最適は、リソソームタンパク質などの酸性pH領域にある可能性があります。ただし、他のケースでは、これも基本的なものになる可能性があります。 pH最適の領域では、タンパク質が最も安定しているため、変性しません。
たとえば、40%(v/v)酢酸を含む酸性の帰化、 [15] 分子間の電荷につながり、最終的にはそれぞれの条件下で最も安価なエネルギー中のタンパク質の範囲につながります。酸は陽子を与えます(h + )したがって、水素結合が部分的に破壊され、同じ正電荷が互いに反発するように、タンパク質構造の負荷変化を引き起こし、引き起こします。さらに、酸は陽子を与えます(h + )ダイカルボキシラトグラッペ(COO – )アミノ酸はアスパラギン酸塩とグルタミン酸塩を、カルボキシ群 – COOHとその以前の負電荷が消えます。その結果、これは、カルボキシ群とタンパク質の正の負荷との間のイオン相互作用が不可能であることを意味します。
対応する可能性のある灰汁は、pH値にわたってイオンの組成も変化させますが、リジンまたはアルギニンのアミノ基は脱採取されています。さらに、カルボン酸基はカルボン酸塩に脱プロトン化されます。つまり、水素結合を破壊することができ、互いに反発するタンパク質でより多くの負電荷が発生します。
酸または葉の場合、タンパク質の加水分解が同時に発生する可能性があります。
pH値に関しては、タンパク質の等電点(PI)も重要です。この時点で、正味電荷内のタンパク質が荷降ろしされているため、溶液からすぐに失敗します。したがって、PIのタンパク質は非常に敏感です。 [16]
カオトロープによる変性 [ 編集 | ソーステキストを編集します ]

塩やその他のカオトロープも疎水性効果に影響を及ぼし、したがって変性を引き起こす可能性があります。それにより、生地に依存することで、影響は再飽和の方向にもなります。その後、降水量に関して、「塩」と「参照」についても話します。アニオンとカチオンの塩の相対的な影響は、「ホフマイスターシリーズ」によって説明されています。
DNAは、ホルムアミド(70%v/v)によって行われます。 [17] ジメチルホルムアミッド、 [18] GuanidiniumSalze(6 m)、 [19] サリチル酸ナトリウム、 [18] スルホキシド、 [18] ジメチルスルホキシド(DMSO、60%v/v)、 [20] 水酸化ナトリウム(1 m)、 [20] さまざまなアルコール、 [18] プロピレングリコールと尿素(6 m) [19] 主に暖かさと組み合わせて変性しました。二重鎖DNAの場合、融解温度が下がります。
決定による変性 [ 編集 | ソーステキストを編集します ]

一部の界面活性剤は変性につながります。これは、あなたが互いに至る所に互いに取り付けて、それによってそれを線形化するからです。 Ionianは最も強いと判断します。 B.ラウリル硫酸ナトリウム(SDS)からの1パーセント溶液。ほとんどのタンパク質はすでに室温で変性しています。さらに、界面活性剤からミセルを形成し、特定の濃度から膜を形成することにより、膜脂質も細胞膜から緩められます。 SDSクリーチャーはzです。 B. SDSページのサンプル準備で使用。
エタノールによる変性 [ 編集 | ソーステキストを編集します ]
酸性の性質によれば、エタノールまたは他の水溶性によれば、有機溶媒は、極性有機溶媒として干渉することにより、構造と疎水性相互作用を維持するために、生体高分子に必要な水素橋を乱す可能性があります。 50〜70%のエタノールがほとんどのタンパク質を変性させています。膜脂質の除去と膜タンパク質も機能を失い、関連する細胞の泡が破裂しているため、関連する細胞をより高いパーセンテージアルコール(例:エタノール、イソプロパノールなど)で消毒することができます。ドッキングタンパク質が配置されているタンパク質を変性させるために、脂質シェルを燃やしました。
純粋な水による変性 [ 編集 | ソーステキストを編集します ]
自然環境では、他のタンパク質、溶存塩、補因子、または代謝物の存在下でタンパク質が利用可能であり、自然のタンパク質構造を多少複雑な方法で安定させます。塩やその他の小さな分子を除去すると、寒さの中では、寒さの中でタンパク質溶液を透析することで除去すると、特にこれらの条件下で沈殿している大きなタンパク質から選択的(および可逆的)変性を頻繁に達成できます(沈殿)。
変更とネットワーキングによる変性 [ 編集 | ソーステキストを編集します ]
分子マーキング、固定溶液とタンニン、共有ネットワーク因子(例:ホルムアルデヒド、パラホルムアルデヒドまたはグルタルアルデヒド)および安定した複合体を形成する重金属イオンの溶液の使用は、一部の機能がもはや満たされないような方法で時々変更されます。タンパク質は展開されていません(熱、カオトロピック、またはpH依存性の変性のように)が、非ネイティブの立体構造と機能を失うことで変更または固定することができます。タンパク質の必要な機能が固定の影響を受けないままである場合、ネットワーキングのために生物学的な半減期などの他の特性も変更できます。反推測の排出の過程で、固定の影響を取り消す試みがなされます。

タンパク質は、膜輸送をシャペロンの前に細胞で部分的に発達し、折り返します。 DNAの塩基対は、たとえば複製や転写など、さまざまなDNA結合タンパク質によって切片で持ち上げられます。変性の場所は、変性バブルと呼ばれます [21] ポーランドシェラガモデルで説明されています。 [22] ただし、DNA配列、剛性、ねじれは含まれていません。 [23] 変性バブルの寿命は、マイクロ秒から1ミリ秒の間です。 [24]
タンパク質混合物からの精製中にタンパク質(例えば酵素)の変性後、生物活性を測定するためにタンパク質からネイティブ形態への戻りが必要です。ただし、これはタンパク質でのみ可能であり、天然の立体構造は等張条件下でエネルギー的に最も安価な状態を表しますが、メタスト可能なタンパク質ではありません。化学的変性による再生は、補助剤と等張性環境の回復を伴う変性剤のゆっくりとした希釈によって達成できます。場合によっては、さらなる添加物が使用されます。 [25] その後、再構成を行うことができます。核酸の熱変性により、これらは温度を下げると再びハイブリダイズします。 [26] 核酸のベースペアリングの再生速度は、正しい塩基対の割合とともに増加します。 [十]
タンパク質によって伝えられる構造変化は、変性と呼ばれません。
- 合成、変換、または採掘された分子、活性化および非活性化反応を介して。たとえば、乳タンパク質は実験酵素によって凝固しています
- シャペロンまたはプリオンによる立体構造の変化。
非常に高い温度では、共有結合、したがって鎖の破損(解重合)も分割できます。一次構造のこのような変化は、変性の間ではカウントされません。同様に、アルカリなどの酸は、高濃度と反応温度で共有結合の分割につながる可能性があります。その後、一次構造は加水分解によって変化します。一次構造のこのような変化は通常の化学反応であり、変性にはカウントされません。
境界線のケースは、2つのタンパク質鎖間のジスルフィドブリッジの分割です。共有化学結合は解決されますが、すべての単一鎖のアミノ酸配列が保存されています。そのため、原則的に可逆的であるジスルフィドのこのような還元的分裂は、変性の1つです。 [27]
動物には、胃の中にタンパク質の変性があります。 [28]
変性は、とりわけ、タンパク質を含む食品の生産に使用されます。 B.調理時およびパンールまたは豆腐の生産時。調理時の変性により消化が容易になります [3] さらに、食物中の微生物が殺され、ウイルスが不活性化されます。異なる消毒方法 [3] また、部分的には(加熱または乾燥の場合)、不要な微生物のタンパク質の変性を使用して、殺されます。永久波を作成するとき、髪は変性してその形状を変えます。 [29]
生化学では、変性がタンパク質の発達に使用されます。 B. SDSページの化学またはタンパク質シーケンス。分子がタンパク質にバインドされると、タンパク質の熱実験性が増加する可能性があります。タンパク質の変性温度の変化は、別の分子を結合するときに熱シフトアッセイで測定できるため、結合を実証できます。さらに、変性は、DNA抽出またはRNA抽出における不活性酵素に使用されます。核酸では、PCR、DNAシーケンス、南部および北部ブロット、in-situハイブリダイゼーションが熱変性でTGGEを使用し、DGGEと尿素またはホルムアミドポリアクリルアミドゲル電気泳動は化学変性とともに使用されます。
- ↑ ジェーン・H・ダイソン、ピーター・E・ライト: 本質的に構造化されていないタンパク質とその機能 の: 自然は分子細胞生物学をレビューします。 (2005)、第6巻、第3号、pp。197–208。 doi:10.1038/nrm1589 。
- ↑ Hans-Dieter Jakubke、Hans Jeschkeit: アミノ酸、ペプチド、タンパク質 、Verlag Chemie、Weinheim、402、1982、ISBN 3-527-25892-2。
- ↑ a b c d そうです フィリップ・クリステン、ロルフ・ジャウシ、ロジャー・ブノワ: 生化学と分子生物学。 Sprinter-Publict、2015、ISBN 978-3-662-46430-4-4-4、P.、電話、36。
- ↑ C. B.アンフィンセン: タンパク質鎖の折りたたみを支配する原理。 の: 化学。 バンド181、ナンバー4096、1973年7月、S。223–230、 PMID 4124164 。
- ↑ Yoshinori Mine, Tatsushi Noutomi, Noriyuki Haga: 卵白タンパク質の熱誘導変化。 の: Journal of Agricultural and Food Chemistry。 38、1990、S。2122、2: 10.1021/JF00102A004 。
- ↑ チャールズ・タンフォード: タンパク質の変性。 の: タンパク質化学の進歩。 バンド23、1968、S。121–282、 PMID 4882248 。
- ↑ a b H.ロバート・ホートンら: 生化学。 Pearson Deutschland GmbH、2008、ISBN 978-3-8273-7312-0、pp。144–146。
- ↑ Hans-Dieter Jakubke、Hans Jeschkeit: アミノ酸、ペプチド、タンパク質 、Verlag Chemie、Weinheim、403、1982、ISBN 3-527-25892-2。
- ↑ Yuan et al。: 凝集体と包摂体からのタンパク質のせん断ストレス媒介の繰り返し。 の: Chembiochem。 いいえ。 16、2015、pp。393–396。
- ↑ a b ピーター・カールソン: カールソンの生化学と病理生化学。 Georg Thieme Publishe、2005、ISBN 978-3-13-3578815-8、S。35。
- ↑ https://www.branchpower.com/isotopes-and-cedical-novation/cobalt-60-isotopes/
- ↑ Gerhard Richter: 実用的な生化学。 Georg Thieme Publisher、2003、ISBN 978-3-1323,331-1、S。144、19.5。
- ↑ E. Palou、A。Lopet-Malo、G。V。Barbosa-Canovas und B. G. Swanson: 食品保存における高圧治療 、マルセル・デッカー、ニューヨーク、1999年。
- ↑ Hans-Dieter Jakubke、Hans Jeschkeit: アミノ酸、ペプチド、タンパク質 、Verlag Chemie、Weinheim、403–404、1982、ISBN 3-527-25892-2。
- ↑ J. P.López-Alonso、M。Bruix、J。Font、M。Ribó、M。Vilanova、M。A。Jiménez、J。Santoro、C。González、D。V。Laurents: NMR分光法は、RNase Aが主に40%酢酸で変性していることを明らかにしています。3Dドメインスワッピングによるオリゴマー形成への影響。 の: Journal of the American Chemical Society。 バンド132、ナンバー5、2010年2月、pp。1621–1630、doi: 10.1021/JA9081638 、 PMID 20085318 。
- ↑ ポポバ、E。: 位相は、水溶液からのタンパク質の故障における重みに等しくなります。 2007、 2019年11月20日にアクセス 。
- ↑ J.マーマー、P。O。Ts’o: ホルムアミドによるデオキシリボヌクレ酸の変性。 の: 生化学と生物物理学が行われました。 バンド51、1961年7月、S。32–36、 PMID 13767022 。
- ↑ a b c d アカデミックプレス: PROG核酸RESおよび分子バイオ。 Academic Press、1963、ISBN 978-08-086289-7、S。267。
- ↑ a b hyone-myong eun: 組換えDNA技術の酵素学プライマー。 Elsevier、1996、ISBN 978-08-053113-7、S。67。
- ↑ a b X. Wang、H。J。Lim、A。Son: DNAハイブリダイゼーションのためのDNAの変性と再飽和度の特性評価。 の: 環境の健康と毒物学。 バンド29、2014、S。E2014007、doi: 10.5620 EHT.2014.29.2014007 、 PMID 25234413 、 PMC 4168728 (無料の全文)。
- ↑ フランソワ・シカード、ニコラス・ド・オ・オステンビル、マン・モンゴス: DNA変性気泡:フリーエネルギーの風景と核形成/閉鎖率 。の: 化学物理学のジャーナル 。 142年、 いいえ。 3 、2015年1月21日、 S. 034903 、doi: 10.1063/1,4905668 、arxiv: 1405.3867 。
- ↑ サイモン場所: ポーランド・シェラガモデル。 マサチューセッツ工科大学(with)、2015年5月14日、1〜5ページ。 Web.mit.eduで( PDF ; 522.7 KB、英語)、2022年2月25日にアクセス。
- ↑ C.リチャード、A。J。Guttmann: ポーランド – シェリガモデルとDNA変性遷移。 の: 統計物理学のジャーナル。 バンド115、2004、S。925、2: 10.1023/b:joss.0000022370.48118.8b 。
- ↑ Greame Otan-Bonnet、Alrbere Libchanber、Olgant Handske: 二本鎖DNAのバブルダイナミクス 。の: 物理的なレビューレター 。 90年、 いいえ。 13 、1。2003年4月、2: 10.1103/physrevlett.90.138101 。
- ↑ ウィンフリードストーハス: バイオプロセス開発。 John Wiley&Sons、2013、ISBN 978-3-527-67385-8、S。621。
- ↑ ロルフクリッパーズ: 分子遺伝学。 Georg Thieme Publisher、2015、ISBN 978-3-13-168330-4。
- ↑ ブロックハウスABC化学 、Veb F. A. Brockhaus Verlag Leipzig 1965、p。274。
- ↑ ロバート・エバーマン: 教科書の食品化学と栄養。 Sprinner Pleile、2011、2018 978-37091-021211-4、P。57。
- ↑ ピーター・W・アトキンス: 物理化学。 John Wiley&Sons、2006、ISBN 978-3-527-31546-8、S。754。
Recent Comments