Nucleus subthalamicus – Wikipedia
Kleiner linsenförmiger Kern im Gehirn
Das Nucleus subthalamicus ist ein kleiner linsenförmiger Kern im Gehirn, der aus funktioneller Sicht Teil des Basalgangliensystems ist. In Bezug auf die Anatomie ist es der Hauptteil des Subthalamus. Wie der Name schon sagt, befindet sich der Nucleus subthalamicus ventral zum Thalamus. Es ist auch dorsal zur Substantia nigra und medial zur inneren Kapsel. Es wurde erstmals 1865 von Jules Bernard Luys beschrieben.[1] und der Begriff Korpus Luysi oder Luys ‘Körper wird immer noch manchmal verwendet.
Anatomie[edit]
Struktur[edit]
Der im Nucleus subthalamicus vorkommende Haupttyp von Neuronen weist ziemlich lange, spärlich stachelige Dendriten auf.[2][3] In den zentral gelegenen Neuronen haben die dendritischen Dorne eine ellipsoidale Form.[4] Die Abmessungen dieser Dorne (1200 μm, 600 μm und 300 μm) sind bei vielen Arten – einschließlich Ratte, Katze, Affe und Mensch – ähnlich, was ungewöhnlich ist. Die Anzahl der Neuronen nimmt jedoch mit der Gehirngröße sowie den äußeren Dimensionen des Kerns zu. Die Hauptneuronen sind glutamatergisch, was ihnen eine besondere funktionelle Position im Basalgangliensystem verleiht. Beim Menschen gibt es auch eine kleine Anzahl (etwa 7,5%) von GABAergen Interneuronen, die an den lokalen Schaltkreisen beteiligt sind; Die dendritischen Dorne subthalamischer Neuronen scheuen jedoch die Grenze und interagieren hauptsächlich miteinander.[5]
Afferente Axone[edit]
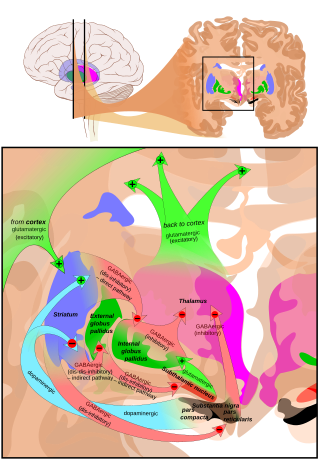
Der Nucleus subthalamicus erhält seinen Haupteingang vom externen Globus pallidus (GPe).[6] nicht so sehr durch die ansa lenticularis wie oft gesagt, sondern durch strahlende Fasern, die zuerst das mediale Pallidum und die innere Kapsel kreuzen (siehe Abbildung). Diese Afferenzen sind GABAerge und hemmen Neuronen im Nucleus subthalamicus. Exzitatorische, glutamaterge Eingaben kommen von der Großhirnrinde (insbesondere der motorischen Kortikalis) und von der Pars parafascicularis des Zentralkomplexes. Der Nucleus subthalamicus erhält auch neuromodulatorische Eingaben, insbesondere dopaminerge Axone aus der Substantia nigra pars compacta.[7]
Es empfängt auch Eingaben vom pedunculopontinen Kern.
Efferente Ziele[edit]
Die Axone der subthalamischen Kernneuronen verlassen den Kern dorsal. Die efferenten Axone sind glutamatergisch (exzitatorisch). Mit Ausnahme der Verbindung zum Striatum (17,3% bei Makaken) sind die meisten subthalamischen Hauptneuronen Multitargets und auf die anderen Elemente des Kerns der Basalganglien gerichtet.[8] Einige senden Axone medial an die Substantia nigra und lateral an die medialen und lateralen Kerne des Pallidums (3-Target, 21,3%). Einige sind 2-Target mit dem lateralen Pallidum und der Substantia Nigra (2,7%) oder dem lateralen Pallidum und dem medialen (48%). Weniger sind Einzelziele für das laterale Pallidum. Im Pallidum enden die subthalamischen Terminals in Bändern parallel zur pallidalen Grenze.[8][9] Wenn alle Axone hinzugefügt werden, die dieses Ziel erreichen, ist die Haupteffizienz des Nucleus subthalamicus in 82,7% der Fälle eindeutig der interne Globus pallidus (GPi).
Einige Forscher haben interne Axon-Kollateralen gemeldet.[10] Es gibt jedoch wenig funktionale Beweise dafür.
Physiologie[edit]
Nucleus subthalamicus[edit]
Die ersten intrazellulären elektrischen Aufzeichnungen von subthalamischen Neuronen wurden unter Verwendung scharfer Elektroden in einer Rattenschnittpräparation durchgeführt.[citation needed] In diesen Aufzeichnungen wurden drei wichtige Beobachtungen gemacht, von denen alle drei nachfolgende Berichte über subthalamische Brändeigenschaften dominierten. Die erste Beobachtung war, dass in Abwesenheit einer Strominjektion oder einer synaptischen Stimulation die Mehrheit der Zellen spontan feuerte. Die zweite Beobachtung ist, dass diese Zellen in der Lage sind, vorübergehend bei sehr hohen Frequenzen zu feuern. Die dritte Beobachtung betrifft nichtlineare Verhaltensweisen, wenn Zellen nach einer Hyperpolarisation unter –65 mV vorübergehend depolarisiert werden. Sie sind dann in der Lage, spannungsgesteuerte Calcium- und Natriumströme zu aktivieren, um Aktionspotentialausbrüche auszulösen.
Mehrere neuere Studien haben sich auf die autonome Schrittmacherfähigkeit von subthalamischen Neuronen konzentriert. Diese Zellen werden oft als “schnell spitzende Schrittmacher” bezeichnet.[11] da sie bei Primaten spontane Aktionspotentiale mit Raten von 80 bis 90 Hz erzeugen können.
Oszillatorische und synchrone Aktivität[12][13] ist wahrscheinlich ein typisches Entladungsmuster in subthalamischen Neuronen, das von Patienten und Tiermodellen aufgezeichnet wurde und durch den Verlust dopaminerger Zellen in der Substantia nigra pars compacta gekennzeichnet ist, der Hauptpathologie, die der Parkinson-Krankheit zugrunde liegt.
Lateropallido-subthalamisches System[edit]
Starke wechselseitige Verbindungen verbinden den Nucleus subthalamicus und das äußere Segment des Globus pallidus. Beide sind schnelle Herzschrittmacher. Zusammen sollen sie den “zentralen Schrittmacher der Basalganglien” bilden.[14] mit synchronen Bursts.
Die Verbindung des lateralen Pallidums mit dem Nucleus subthalamicus ist auch die im Basalgangliensystem, wo die Reduktion zwischen Emitter / Empfangselementen wahrscheinlich am stärksten ist. Beim Menschen misst das laterale Pallidum beim Volumen 808 mm³, der Nucleus subthalamicus nur 158 mm³.[15] Dies bedeutet eine starke Komprimierung mit Verlust der Kartengenauigkeit.
Einige Axone aus dem lateralen Pallidum gehen in das Striatum.[16] Die Aktivität des medialen Pallidums wird durch Afferenzen des lateralen Pallidums und des Nucleus subthalamicus beeinflusst.[17] Gleiches gilt für die Substantia nigra pars reticulata.[9] Der Nucleus subthalamicus sendet Axone an einen anderen Regulator: den Pedunculo-Pontine-Komplex (id).
Es wird angenommen, dass das Lateropallido-Subthalamus-System eine Schlüsselrolle bei der Erzeugung der Aktivitätsmuster spielt, die bei der Parkinson-Krankheit beobachtet werden.[18]
Pathophysiologie[edit]
Die chronische Stimulation des STN, die als Deep Brain Stimulation (DBS) bezeichnet wird, wird zur Behandlung von Patienten mit Parkinson-Krankheit eingesetzt. Die ersten, die stimuliert werden, sind die terminalen Arborisierungen afferenter Axone, die die Aktivität von subthalamischen Neuronen modifizieren. Es wurde jedoch in Thalamusschnitten von Mäusen gezeigt,[19] dass der Reiz auch dazu führt, dass nahe gelegene Astrozyten Adenosintriphosphat (ATP) freisetzen, einen Vorläufer von Adenosin (durch einen katabolen Prozess). Die Aktivierung des Adenosin-A1-Rezeptors drückt wiederum die exzitatorische Übertragung im Thalamus und ahmt so die Ablation des Nucleus subthalamicus nach.
Eine einseitige Zerstörung oder Störung des Nucleus subthalamicus – die bei Patienten mit Diabetes, Bluthochdruck oder einer Vorgeschichte des Rauchens häufig über einen kleinen Gefäßschlag auftreten kann – führt zu Hemiballismus.
Da eine der vermuteten Funktionen des STN in der Impulskontrolle liegt, wurde eine Funktionsstörung in dieser Region mit einer Zwangsstörung in Verbindung gebracht.[20] Die künstliche Stimulation des STN hat sich als vielversprechend bei der Korrektur von schwerem Impulsverhalten erwiesen und kann später als alternative Behandlung für die Störung eingesetzt werden.[21]
Funktion[edit]
Die Funktion des STN ist unbekannt, aber aktuelle Theorien stellen es als Bestandteil des Basalganglien-Kontrollsystems dar, das eine Aktionsauswahl durchführen kann. Es wird angenommen, dass der sogenannte “hyperdirekte Weg” der Motorsteuerung implementiert wird, im Gegensatz zu den direkten und indirekten Pfaden, die an anderer Stelle in den Basalganglien implementiert sind. Es wurde auch gezeigt, dass eine STN-Dysfunktion die Impulsivität bei Personen erhöht, denen zwei gleich lohnende Reize präsentiert werden.[22]
Untersuchungen haben gezeigt, dass der Subthalamus ein extrapyramidales Zentrum ist. Es hält die Muskelreaktionen in Schach und Schäden können zu Hemiballismus führen (ein heftiges Schleudern von Arm und Bein auf einer Körperseite).[23]
Zusätzliche Bilder[edit]
-

Koronaler Abschnitt des Gehirns unmittelbar vor Pons. Subthalamuskern markiert als “Nucleus of Luys”.
Siehe auch[edit]
Verweise[edit]
- ^ Luys, Jules Bernard (1865). Recherches sur le système cérébro-spinal, sa Struktur, ses Funktionen und ses Krankheiten (auf Französisch). Paris: Baillière.
- ^ Afsharpour, S. (1985). “Lichtmikroskopische Analyse von Golgi-imprägnierten subthalamischen Neuronen der Ratte”. Zeitschrift für Vergleichende Neurologie. 236 (1): 1–13. doi:10.1002 / cne.902360102. PMID 4056088.
- ^ Rafols, JA; Fox, CA (1976). “Die Neuronen im subthalamischen Kern von Primaten: eine Golgi- und elektronenmikroskopische Untersuchung”. Zeitschrift für Vergleichende Neurologie. 168 (1): 75–111. doi:10.1002 / cne.901680105. PMID 819471.
- ^ Yelnik, J.; Percheron, G. (1979). “Subthalamusneuronen bei Primaten: eine quantitative und vergleichende Anatomie”. Neurowissenschaften. 4 (11): 1717–1743. doi:10.1016 / 0306-4522 (79) 90030-7. PMID 117397.
- ^ Levesque JC; Elternteil A. (2005). “GABAerge Interneurone im menschlichen Nucleus subthalamicus”. Bewegungsstörungen. 20 (5): 574–584. doi:10.1002 / mds.20374. PMID 15645534.
- ^ Canteras NS, Shammah-Lagnado SJ, Silva BA, Ricardo JA (April 1990). “Afferente Verbindungen des Nucleus subthalamicus: eine kombinierte retrograde und anterograde Meerrettichperoxidase-Studie an der Ratte”. Brain Res. 513 (1): 43–59. doi:10.1016 / 0006-8993 (90) 91087-W. PMID 2350684.
- ^ Cragg SJ; Baufreton J.; Xue Y.; Bolam JP & Bevan MD (2004). “Synaptische Freisetzung von Dopamin im Nucleus subthalamicus”. Europäisches Journal für Neurowissenschaften. 20 (7): 1788–1802. doi:10.1111 / j.1460-9568.2004.03629.x. PMID 15380000.
- ^ ein b Nauta HJ, Cole M (Juli 1978). “Efferente Projektionen des Nucleus subthalamicus: eine autoradiographische Studie an Affen und Katzen”. J. Comp. Neurol. 180 (1): 1–16. doi:10.1002 / cne.901800102. PMID 418083.
- ^ ein b Smith, Y.; Hazrati, LN.; Parent, A. (1990). “Efferente Projektionen des Nucleus subthalamicus im Totenkopfäffchen, wie mit der anterograden PHA-L-Tracing-Methode untersucht”. Zeitschrift für Vergleichende Neurologie. 294 (2): 306–323. doi:10.1002 / cne.902940213. PMID 2332533.
- ^ Kita, H.; Chang, HT & amp; Kitai, ST (1983). “Die Morphologie intrazellulär markierter subthalamischer Neuronen der Ratte: Eine lichtmikroskopische Analyse”. Neurowissenschaften. 215 (3): 245–257. doi:10.1002 / cne.902150302. PMID 6304154.
- ^ Surmeier DJ; Mercer JN & Chan CS (2005). “Autonome Herzschrittmacher in den Basalganglien: Wer braucht schon anregende Synapsen?” Aktuelle Meinung in der Neurobiologie. 15 (3): 312–318. doi:10.1016 / j.conb.2005.05.007. PMID 15916893.
- ^ Levy R.; Hutchison WD; Lozano AM & Dostrovsky JO (2000). “Hochfrequenzsynchronisation der neuronalen Aktivität im subthalamischen Kern von Parkinson-Patienten mit Extremitäten-Tremor”. Das Journal of Neuroscience. 20 (20): 7766–7775. doi:10.1523 / JNEUROSCI.20-20-07766.2000. PMC 6772896. PMID 11027240.
- ^ Lintas A.; Silkis IG; Albéri L.; Villa AEP (2012). “Dopaminmangel erhöht die synchronisierte Aktivität im subthalamischen Kern der Ratte” (PDF). Gehirnforschung. 1434 (3): 142–151. doi:10.1016 / j.brainres.2011.09.005. PMID 21959175.
- ^ Plenz, D. & Kitai, ST (1999). “Ein Basalganglien-Schrittmacher, der vom Nucleus subthalamicus und vom äußeren Globus pallidus gebildet wird”. Natur. 400 (6745): 677–682. doi:10.1038 / 23281. PMID 10458164.
- ^ Yelnik, J. (2002). “Funktionelle Anatomie der Basalganglien”. Bewegungsstörungen. 17 (Suppl. 3): S15 – S21. doi:10.1002 / mds.10138. PMID 11948751.
- ^ Sato, F.; Lavallée, P.; Levesque, M. & Parent, A. (2000). “Single-Axon-Tracing-Studie von Neuronen des äußeren Segments des Globus Pallidus bei Primaten”. Zeitschrift für Vergleichende Neurologie. 417 (1): 17–31. doi:10.1002 / (SICI) 1096-9861 (20000131) 417: 1<17::AID-CNE2>3.0.CO; 2-I. PMID 10660885.
- ^ Smith, Y.; T. Wichmann & MR DeLong (1994). “Synaptische Innervation von Neuronen im inneren pallidalen Segment durch den Nucleus subthalamicus und das äußere Pallidum bei Affen”. Zeitschrift für Vergleichende Neurologie. 343 (2): 297–318. doi:10.1002 / cne.903430209. PMID 8027445.
- ^ Bevan MD; Magill PJ; Terman D.; Bolam JP & Wilson CJ. (2002). “Bewegen Sie sich zum Rhythmus: Schwingungen im subthalamischen Kern-externen Globus Pallidus-Netzwerk”. Trends in den Neurowissenschaften. 25 (10): 525–531. doi:10.1016 / S0166-2236 (02) 02235-X. PMID 12220881.
- ^ Bekar L.; Libionka W.; Tian G.; Xu Q.; Torres A.; Wang X.; Lovatt D.; Williams E.; Takano T.; Schnermann J.; Bakos R.; Nedergaard M. (2008). “Adenosin ist entscheidend für die durch tiefe Hirnstimulation vermittelte Abschwächung des Tremors”. Naturmedizin. 14 (1): 75–80. doi:10.1038 / nm1693. PMID 18157140.
- ^ Carter, Rita. Das Buch des menschlichen Gehirns. S. 58, 233.
- ^ L, Mallet; Polosan M., Jaafari N., Baup N., Welter ML, Fontaine D .; et al. (2008). “Subthalamuskernstimulation bei schwerer Zwangsstörung”. New England Journal of Medicine. 359 (20): 2121–34. doi:10.1056 / NEJMoa0708514. PMID 19005196.CS1-Wartung: mehrere Namen: Autorenliste (Link)
- ^ Frank, M.; Samanta, J.; Moustafa, A.; Sherman, S. (2007). “Halten Sie Ihre Pferde: Impulsivität, Tiefenhirnstimulation und Medikamente bei Parkinson”. Wissenschaft. 318 (5854): 1309–12. doi:10.1126 / science.1146157. PMID 17962524.
- ^ Bruce H. Robinson (2007). Biomedizin – Ein Lehrbuch für Praktiker der Akupunktur und Orientalischen Medizin. Blaue Mohnpresse. p. 126. ISBN 978-1-891845-38-3. LCCN 2006940894.
Recent Comments