Azodicarbony酸ジエチルエステル-Wikipedia
Azodicarbony Acid Hyte Yester 、主に 死 ( d 私 そうです ティル a このような d icarboxylat)省略は、仲間のトゥノブ反応のための重要な試薬ですが、さまざまな方法で使用できます。
生産は、適切な手段によって脱水されるヒドラジンの誘導体を介して行われます。 1つの可能性は、喫煙硝酸を使用した酸化です。 [3] この反応は、塩素を酸化剤として使用しても成功します。 [4]
死者は毒性があり、ショックと光に敏感で、熱的に不安定です。この接続は、スプレンシング法の意味での爆発の観点から危険であり、そこのファブリックグループAに割り当てられます。 [5] スチールスリーブテストでは、物質は境界直径20 mmで非常に激しく反応します。 [6] 感度はわずか4年です。 [6] リードブロックテストでは、33 ml/10 gの延長が観察されます。 [6] 100°Cを超えると、分解熱が-1466 kj・kgの強く発熱性分解が見つかります -1 または-255 kj・mol -1 それ以外の。 [6] したがって、それはほとんどが溶解した形で、たとえばトルオールで市販されています。死者は、アメリカの純粋な物質として送られてはなりません。これらのセキュリティリスクのため、死亡の使用が減少したため、通常、より安定したジイソプロピラゾディカルボン酸(DIAD)に置き換えられます。
蒸留時に死者は爆発する可能性があります。適切な安全上の注意事項をとる必要があります。直接光源を保護する必要があります。 [4]
Mitsunobu-Reaktion [ 編集 | ソーステキストを編集します ]
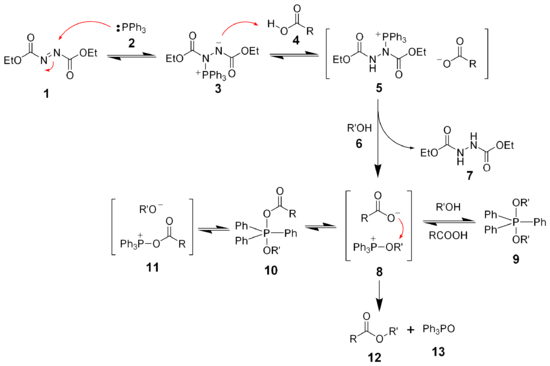
死からのアプリケーションの古典的な領域は、アルコールからのエステルン、イーサルン、アミン、チオエーテルの合成に役立つミツノブ反応です。
エノフィル [ 編集 | ソーステキストを編集します ]
死からの別のアプリケーション領域は、たとえばEN反応においてエノフィリックとして使用されます。 [7]

ジエノフィル [ 編集 | ソーステキストを編集します ]
悪フィルとしての使用は、文献にも記載されています。たとえば、シクロペンタディエンからのビシクロ[2.1.0]五角形の合成が成功しました。 [8]
マイケルアクセプター [ 編集 | ソーステキストを編集します ]
DeadのAZグループもMichael Acceptorです。銅触媒の存在下で、死んだのは、対応する油圧の多用にβ-ケトエステルに追加されます。 [9]
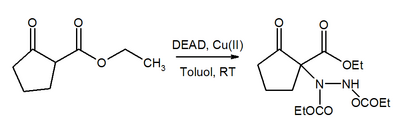
同様に、Cu(II)は、ほぼ定量的収率でのボロン酸エステルの置換も触媒します。 [十]

ピラゾリン誘導体の合成 [ 編集 | ソーステキストを編集します ]
死者は、ヘテロサイクルの合成にも使用できます。このようにして、ピラゾールディンダーは、α、βに飢えたケトンへの凝縮を通じて保存できます。 [11] :

- クレイデン、グリーブス、ウォーレン&ウォザス: 有機化学。 オックスフォード大学出版局、2004年8月、ISBN 0-19-850346-6
- O. Mitsunobu, M. Wada, T. Sano: 立体特異的および立体選択的反応。 I.アルコールからのアミンの調製 J. Amで。化学。 Soc。 94(1972)679–680、doi: 10.1021/JA00757A085 。
- R. F. C.ブラウン、W。R。ジャクソン、T。D。マッカーシー: フラバン-3-OLSへの潜在的なルート、パート2:パラオキシゲン化ベンジルアルコールのミツノブ反応 Tetrahedron 50(1994)5469–5488、doi: 10.1016/s0040-4020(01)80702-x 。 (メソッド開発)
- O. Mitsunobu: 天然産物の合成と変換におけるアゾディカルボン酸ジチル酸ジエチルとトリヘニルホスフィンの使用 合成1981、1–28、doi: 10.1055/S-1981-29317 。 (概要)
- ↑ a b へのエントリ diazendicarbony酸ジエチルエステル 。の: オンラインでrömpp。 Georg Thieme Verlag、2014年12月28日にアクセス。
- ↑ a b c d そうです データシート ジエチルアゾディカルボン酸、97% 2019年12月26日にアクセスしたAlfaaesarで( PDF )) (JavaScriptが必要) 。
- ↑ ノーマンラブジョン: エチルアゾディカルボン酸 の: 有機合成 。 28、1948、S。58、2: 10.15227/orgsyn.028.0058 ; coll。 Vol。 3、1955、S。375( PDF )。
- ↑ a b J. C.カウアー: エチルアゾディカルボン酸。 の: 有機合成 、coll。 Vol。 4(1963)、S。411、doi: 10.1002/0471264180.OS900.12 ( PDF )。
- ↑ 1987年以来§2Sprenggに従って新たに行われた調査結果の発表 – 2001年2月16日の決定402 pdf-link 。
- ↑ a b c d バーガー、A。; Wehrstedt、K.D。: Azodicarboxylates:爆発的な特性とDSC測定 J.損失前。 Proc。 Ind。23(2010)734–739、doi: 10.1016/j.jlp.2010.06.019 。
- ↑ リーマン、ノイマン:en反応Uni Hannover ( 記念 2007年6月11日から インターネットアーカイブ ))
- ↑ P. G.ガスマンとK. T.マンスフィールド、 有機合成 coll Vol。5 1973年 、96。
- ↑ コメレス、j。; Moreno-Mañas、m。ペレス、e。 Roglans、a。; Sebastián、R.M。; Vallribera、A。: マイケルの追加のためのイオンおよび共有銅(II)ベースの触媒。メカニズム J. org。化学。 69(2004)6834–6842、doi: 10.1021/JO049373Z 。
- ↑ Uemura, T.; Chatani, N.: 銅塩がアゾディカルボン酸塩にアリールボロン酸を触媒しました J. org。化学。 70(2005)8631–8634、doi: 10.1021/JO051387X 。
- ↑ vijay and n。;スミス、C.M。; AkkattuとT.B。; Eringathodi、s。: 「Huisgen Zwitherion」とカルコンおよびジエノンの新しい反応:ピラゾリンとピラゾロピリダジン誘導体の合成のための効率的な戦略 Angewで。化学。 int。編46(2007)2070–2073、doi: 10.1002 / 5月.2006040252525252525 。
Recent Comments