Chomatina -Speedylook Encyclopedia
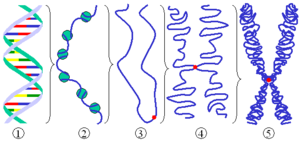
クロマチン これは、細胞核にDNAが提示される方法です。また、真核生物染色体の塩基物質であり、真核細胞の界面核にあり、これらの細胞のゲノムを構成するDNA、RNA、タンパク質関連に対応しています。タンパク質には、ヒストンと非歴史タンパク質の2つのタイプがあります。
クロマチンの基本単位はヌクレオソームです。これらは、約146ペアの長さの塩基(数は生物に依存します)によって形成され、8つのヌクレオソームヒストン(ヒストンオクタメーター)の特定の複合体に関連しています。各粒子には、直径11 nmのディスク形式があり、4つのH3、H4、H2A、およびH2Bヒストンのそれぞれの2つのコピーが含まれています。このオクターマーはタンパク質コアを形成し、その周りにDNAプロペラ(約1.8ラップ)が登録されています。各DNAとヒストンの関連性の間には、クロマチン繊維への柔軟性を保証する0〜80ヌクレオチドペアの間のさまざまな長さのスペーサーDNAと呼ばれる遊離DNAがあります。このタイプの組織は、遺伝物質の圧縮の最初のステップを可能にし、「パールネックレス」に似た構造をもたらします。
その後、第2レベルの高次組織は、ヒストンH1の作用のおかげで定期的な規定を採用している相互にパッケージ化されたヌクレオソームのグループで構成される「30 nmの繊維」です。
最後に、DNAパッケージの増加は、中期で観察される染色体が得られるまで続きます。これは、最高レベルのDNA凝縮です。
クロマチンは1880年にウォルサーフレミングによって発見されました。 [ 初め ]
ヒストンは、1884年にAlbrecht Kosselによってまもなく発見されました。クロマチン繊維の最初の観察が電子顕微鏡で作られる1970年代までクロマチンの構造を決定し、1997年にX線結晶によって最終的に分解されたクロマチンの基本ユニットであるヌクレオソームの存在を明らかにすることはほとんど行われませんでした。 [ 2 ]
クロマチンの種類 [ 編集します ]
クロマチンは、ヘテロクロマチンとエウクロマチンの2つの方法で見つけることができます。
ユクロマチン [ 編集します ]
それはわずかに圧縮されたクロマチンの一種であり、大量の遺伝子を示すものです。 アクティブフォーム 。これは、H2A、H2B、H3、およびH4ヒストンのホモダミストの周りに刻印されたDNAセグメントであるヌクレオソームの繊維に対応する直径の繊維によって形成されます。非アクティブなユークロマチンでは、この繊維はH1ヒストンのおかげでソレノイドを形成するおかげでそれ自体に巻き込まれます。他の非ヒストンタンパク質(トポイソメラーゼII、足場タンパク質、ラミニンなど)との相互作用は、より大きな程度の組織を引き起こします。ヘテロクロマチンに関しては、それを構成する繊維はより凝縮され、しばしば凝集体によって形成されます。その形成には、HP1タンパク質(ヘテロクロマチンタンパク質1またはヘテロクロマチンタンパク質1)を含む多数の追加タンパク質が必要です。
ヘテロクラマティナ [ 編集します ]
aです 非アクティブな形 特に核の周辺に位置する凝縮。これは、色とともに強く染色されています。 1928年、組織学的観察に基づいたエミル・ハイツは、ヘテロクロマチンを界面核で非常に凝縮して暗く見える染色体セグメントとして定義されました。実際、クロマチンは、直径が細胞周期中に変化するだけでなく、観察された染色体領域にも依存する繊維のもつれから形成されます。
ヘテロクラマティナ それは2つの異なるタイプである可能性があります。衛星DNAの富は、ヘテロクロマチンの永久的または可逆的な性質、およびその多型と染色特性の両方を決定します。
-
- 構成的 、生物内のすべての細胞と同一であり、遺伝的情報が欠けているため、DNAを発現しない染色体のテロメアとセントロメアが含まれます。構成的ヘテロクロマチンには、衛星DNAと呼ばれる特定のタイプのDNAが含まれており、タンデムで多数の繰り返される短いシーケンスによって形成されます。このDNAの主なタイプは、アルファ衛星DNA、および衛星DNA I、IIおよびIIIです。これらの衛星DNA配列は、それ自体に折りたたむことができ、構成的ヘテロクロマチンの非常にコンパクトな構造の形成に重要な役割を果たす可能性があります。構成的ヘテロクロマチンは安定しており、発達のすべての段階およびすべての組織でそのヘテロクロマティック特性を保持しています。構成的ヘテロクロマチンは、おそらく衛星DNAの不安定性が原因で、非常に多型です。この多型は、そのサイズだけでなく、ヘテロクロマチンの位置にも影響を与える可能性があり、明らかに表現型効果はありません。構成的なヘテロクロマチンは、変性後の衛星DNAの非常に急速な再飽和度の結果であるCand Bands Technikeに強く染色されています。
- オプション 、異なる細胞タイプが異なり、発現していない、またはある時点で発現できるすべての遺伝子に関する情報が含まれています。衛星DNAとBarr’s Corpuscleが含まれます。オプションのヘテロクロマチンは、繰り返されるラインタイプシーケンスの存在によって特徴付けられます。ゲノム全体に散在するこれらの配列は、凝縮クロマチン構造の広がりを促進する可能性があります。オプションのヘテロクロマチンは可逆的であり、そのヘテロクロマティック状態は発達と細胞型の段階に依存します。このタイプのヘテロクロマチンの2つの例は、男性の体細胞の不活性X染色体(近隣体)と、男性の減数分裂の貧困段階での非アクティブな性的胆嚢です。オプションのヘテロクロマチンには特に衛星DNAが豊富ではないため、多型ではありません。オプションのヘテロクロマチンは、バンドテクニックCで染色されることはありません。
ヘテロクロマチンの形成では、干渉RNAの現象が頻繁に関与することがわかりました。たとえばで Schizosaccharomyces Pombe 、ヘテロクロマチンは、セントロメア、テロメア、および遺伝子座で形成されます 交配タイプ 。 [ 3 ] セントロメアにおけるヘテロクロマチンの形成は、干渉RNAメカニズム(RNAI)に依存します。二重相補鎖RNAは、セントロメアにある反復配列から生成され、リジン9ヒストン3とSWI6リンクのメチル化(哺乳類のHP1と相同のヘテロクロマチンの構造タンパク質)を誘導します。 [ 4 ]
ヘテロクロマチン特性 [ 編集します ]
上記の違いにもかかわらず、構成的ヘテロクロマチンとオプションのヘテロクロマチンは非常に類似した特性を持っています。
1.ヘテロクロマチンは凝縮されています。
実際、これはヘテロクロマチンを定義するものであり、したがって、構成的およびオプションのヘテロクロマチンの両方に適用できます。この高い凝縮は、DNASA I、および一般的に他の制限酵素にとって強く色素和なものになり、アクセスできません。
2.ヘテロクロマチンDNAは後で複製されます。
いくつかのヌクレオチド類似体の取り込みは、両方のタイプのヘテロクロマチンのDNAが遅れて複製されることを示しています。これは、一方で高度な凝縮の結果であり、複製機械がDNAに容易にアクセスするのを防ぎ、一方では、活性元素の貧しい末梢核ドメインの位置です。
3.ヘテロクロマチンDNAはメチル化されています。
- 構成的ヘテロクロマチンDNAは、シトシンで高度にメチル化されています。したがって、抗5-メチル抗体は、このタイプのヘテロクロマチンのすべての領域を強くマークします。
- オプションのヘテロクロマチンに関しては、そのDNAのメチル化は低くなりますが、制限感受性制限酵素による分析により、遺伝子の発現を制御する領域に特に位置するCPG島の重要なメチル化が明らかになります。
4.ヘテロクロマチンでは、ヒストンは低アセチラです。
ヒストナスは、クロマチンの遺伝的活性に影響を与える可能性のあるN末端極端に一連の翻訳後修飾に苦しむ可能性があります。
- 主にリシンでのヒストンN末端尾の著しいものは、不活性クロマチンと関連しています。それどころか、高カチオンのヒストンは活性クロマチンの特徴です。
- ヒストヌスのアセチル化/ディスケーリーは、遺伝子発現の制御のための絶対に不可欠なメカニズムです。ヒストン(HAT、ヒストンアセチル移動)またはヒストンディスケーシリー(HDACまたはヒストンデアセチルゼ)のアセチルトランスフェラーゼ活性を持つ多くの転写因子があります。
5.ヘテロクロマチンのヒストナスは、リジン9でメチル化されています。
ヒストナH3(H3-K9)のリジン9のメチル化は、構成的およびオプションのヘテロクロマチンの形成において、ゲノムのヘテロクロマチン化プロセスと密接に関連しているようです。
6.ヘテロクロマチンは転写的に不活性です。
- ショウジョウバエで起こることとは異なり、ヒトの構成的ヘテロクロマチンには遺伝子が含まれておらず、細胞作物への砕いたウリジンの取り込みは、このレベルでどのタイプのマークを産生しません。
- オプションのヘテロクロマチンは遺伝子が比較的貧弱であり、これらは一般にヘテロクロマチンの状態では転写されていません。
7.ヘテロクロマチンは遺伝的再結合に関与しません。
- 一般に、構成的ヘテロクロマチンは遺伝的再結合に関与していないことが認められています。相同ヘテロクロマチン領域の予備ペアリングの非存在は、それを困難にするこれらの領域の特徴的な多型による可能性がありますが、それは不可能になりません。構成的ヘテロクロマチンは、隣接するエウクロマチン領域での組換えを抑制することによって作用します。
ヘテロクロマチンの機能 [ 編集します ]
長い間、ヘテロクロマチンの具体的な役割は謎でしたが、その多型は機能的または表現型効果を持っていないようです。
- 。核ドメインの組織におけるヘテロクロマチンの役割。
- ヘテロクロマチンとエウクロマチンは異なる核ドメインを占めています。ヘテロクロマチンは一般に、核エンベロープに固定された核の周辺に位置しています。それどころか、活性クロマチンは中央の位置にあります。
- 核包装に対するヘテロクロマチンの優先位置は、HP1タンパク質とBラミネートの受容体との相互作用、核シートの成分、その内面によって核エンベロープに隣接するタンパク質構造によるものである可能性があります。 •ヘテロクロマチンの末梢位置は、核の中央部分に活性要素を濃縮し、活性エウクロマチンが最大効率で複製して転写できるようにします。
- 。セントロメアの機能におけるヘテロクロマチンの役割。
ほとんどの真核生物では、セントロメアはかなりの質量のヘテロクロマチンに囲まれています。姉妹染色分体の凝集には、模学的ヘテロクロマチンが必要であり、それが有糸分裂染色体の正常な分離を可能にすることが示唆されています。
- Schizosaccharomyces Pombe酵母では、HP1タンパク質のSWI6の対応物は、細胞分裂中の姉妹染色分体の効率的な凝集に絶対に不可欠です。
- 衛星のDNAが実施された実験は、このタイプのDNAの繰り返しの大きな領域が、セントロメアの正しい機能に不可欠であることを示しています。
中心性ヘテロクロマチンは、ヒストンのセントロメリコ変異体の局所濃度を増加させ、複製中にヒストンH3の代わりにCENP-Aの組み込みを促進することにより、事実上、コンパートメントを作成できると想定されています。
- 。遺伝子抑制におけるヘテロクロマチンの役割(エピジェネティックな調節)
遺伝子発現は、2つのレベルで制御できます。
- まず、局所レベルまたは転写制御で、局所転写複合体の形成のおかげで。このレベルには、遺伝子にリンクされた比較的小さなDNA配列が含まれます。
- 最もグローバルなレベルでは、その場合、転写性の制御があると言われています。この制御には、アクティブまたは非アクティブな優れたクロマチンドメインを表す長いシーケンスが含まれます。この場合、関与しているように見えるのはヘテロクロマチンです。したがって、一般的にエウクロマチンで見られる遺伝子は、ヘテロクロマチンの領域に近いときに沈黙させることができます。
CISの不活性化メカニズム:
染色体の再編成により、ユークロマティック領域が異染性領域に並置される可能性があります。再配置がエウクロマチンを保護する特定の障壁を排除する瞬間、ヘテロクロマティック構造は、その中にある遺伝子を不活性化する隣接するユークロマチンにCIで拡散することができます。これは、ショウジョウバエにおける位置(PEV)およびマウスの特定のトランスジェンの不活性化によって観察されるメカニズムです。
トランスの不活性化メカニズム:
細胞分化中、特定の活性遺伝子は異系核核ドメインに移行し、それらを不活性化する可能性があります。このメカニズムは、コントロールをコントロールする模倣ヘテロクロマチンを含むイカロスタンパク質リンパ球中心の共局在化の説明として提案されているメカニズムです。
- ユクロマチン 、それは核の残りの部分(凝縮の低下)によって散乱され、色とともに弱く染色されます(その最大の染色は有糸分裂で発生し、光顕微鏡では見えません)。を表します アクティブフォーム mRNA分子に対するDNA分子の遺伝的物質が転写されているクロマチンのため、ほとんどの活性遺伝子が位置する場所にあります。
遺伝的発現におけるクロマチンの役割 [ 編集します ]
クロマチンは、DNAの複製、転写、修復のプロセスを最適化するためにその圧縮と包装状態を適応させる動的な構造であり、遺伝子発現において基本的な調節の役割を果たします。さまざまな圧縮状態は、それらの領域で発見された遺伝子が示す転写の程度に(一意ではありませんが)関連することができます。クロマチンは、原則として、DNAと異なるタンパク質との関連が異なるポリメラーゼRNAの行列を妨げるため、転写のために強く抑圧的です。したがって、さまざまな量のクロマチンリモデリング機とヒストン修飾子があります。
現在、「ヒストンコード」として知られているものがあります。異なるヒストンは、一般にリジンまたはアルギニン廃棄物で与えられるメチル化、アセチル化、リン酸化など、翻訳後修飾に苦しむ可能性があります。アセチル化は転写活性化に関連しています。これは、リシナがアセチラである場合、ヒストンの全体的な正の負荷を減少させるため、DNAに対する親和性が低い(負に負荷がかかる)ためです。その結果、DNAはそれほど強く統合されていないため、転写機械へのアクセスが可能になります。それどころか、メチル化は転写抑制とより強いDNAヒストン結合に関連しています(ただし、これは常に真実ではありません)。
たとえば、酵母で S.ポンベ 、アミノ酸のメチル化( 残基 9)Histona H3 Lysinaのものは関連付けられています 表現 ヘテロクロマチンの転写の、一方、リジンの(残基4)のメチル化は遺伝子発現を促進します。 [ 4 ]
ヒストンの修飾の機能を実行する酵素は、ヒストンのアセチルと分解、およびヒストンのメチラーゼと分析であり、ヒストンの長い尾の特定の残基を修正するメンバーがメンバーを形成します。
ヒストンの修飾に加えて、ヌクレオソームを移動したり、回転させたり、部分的に老化させたり、ヌクレオソームの構成要素ヒストンの一部を除去してから戻すことによって、ヌクレオソームを再配置する原因となるサガなど、クロマチンのリモデリング機構もあります。一般に、ポリメラーゼのアクセスと加工性を可能にするため、クロマチンリモデリング機構は真核生物の転写プロセスに不可欠です。
「非アクティブ」としての別の形態のクロマチンマーキングは、CPGジヌクレオチドに属するシトシンで、DNAメチル化のレベルで発生する可能性があります。一般に、DNAとクロマチンのメチル化は相乗的プロセスです。たとえば、DNAがメチル化されると、メチル化シトシンを認識できるメチル化ヒストン酵素があり、メチルは密接なヒストンです。同様に、DNAをメチル化する酵素はメチル化されたヒストンを認識し、したがってDNAレベルでメチル化を続けます。
これらの修正はすべて、エピジェネティックな修正の家族の一部です。
クロマチンと突然変異 [ 編集します ]
突然変異の負担は、クロマチンを抑制した領域と、複製が遅れている地域でより大きく、ヒトがんでも観察されています。
染色体を捕獲する方法 [ 編集します ]
染色体の立体構造(3Cテクノロジーとも呼ばれる)の捕獲方法は、細胞内のクロマチンの空間的組織を決定するために分子生物学で使用される方法です。これらの方法は、3D構造に近いがヌクレオチド配列からはほど遠い場合があるゲノム遺伝子座相互作用の数を定量化します。これらのゲノム接触を研究する多くの方法が開発されており、すべて初期ステップを共有しています。 [ 5 ]
1.ホルムアルデヒドとのDNAクロスラウンジ。
2.エンドヌクレアーゼによるゲノムカット
3.ランダムDNAフラグメントの光。十字線の断片の結紮は、交差断片が近接しているため、ゆるい断片に直面して好まれます。
4.その後、異なるPCR技術によって得られたフラグメントが分析されます。
DIP-C : [ 6 ] クロマチン構造の研究方法クロマチン、Hi-Cの立体構造の修正に基づく方法と、ゲノム全体の増幅を伴う全体のゲノムの増幅と組み合わせて、複数の増幅を増幅することにより高い被覆を伴う エンドタグ ゴールと呼ばれます。具体的には、Hi-Cメソッドのビオチン結紮ステップが変更されます。このタイプの手法では、その後のバイオインフォマティクス分析が必要です。 DIP-Cでは、近隣の仮説に基づくアルゴリズムが確立されています。これは、2つの相同ハルートゥイプが異なる接触パターンを持っている必要があり、したがって、染色体の未知のハプロタイプが近くの染色体領域または隣接で接触しなければならないと仮定しています。著者らは、近隣を0.5の指数と10 MB半径10 mbの超高能として定義しています。
この方法は、以前の方法(3C、4C、5C、およびHi-C)とは異なり、単一のヌクレオチドまたはSNPの多型に基づいて二倍体細胞のクロマチンの構造を分析できます。このようにして、各染色体接触にどの細胞ハプロタイプが関与しているかを確立することが可能です。この方法を用いた研究は、染色体と誤検知の数が少ない間のより多くの接触を検出することを確認しています。
参照してください [ 編集します ]
参照 [ 編集します ]
- ↑ Olins D.E.、Olins A.L.(2003)。 «クロマチンの歴史:橋からの私たちの見解。»。 ナット。 Rev. Mol。 Cell Biol。 4 (10):809-814。 PMID 14570061 。 doi: 10.1038/nrm1225 。 (サブスクリプションが必要です) 。
- ↑ Karolin Luger、Armin W.Mäder、Robin K. Richmond、David R. Sargento、Timothy J. Richmond、(1997)。 «2.8 A分解能でのヌクレオソームコア粒子の結晶構造»、»。 自然 389 (6648):251-260。 PMID 9305837 。 doi: 10.1038/38444 。 (サブスクリプションが必要です) 。
- ↑ Lippman Z. Y Martianssen R.(2004)。 自然 431:364-370
- ↑ a b Volpe、T。、および共同研究者。 化学 297:1833-1837
- ↑ Dekker、Job(2006)。 «染色体立体構造の3つの「C」は、コントロール、コントロール、コントロール»。 自然方法 3 (1):17-21。 doi: 10.1038/nmeth823 。
- ↑ Tan、longzhi; xing、dong; chang、chi-ha; li、heng; xie、x。Sunney(2018)。«単一二倍体ヒト細胞の3次元ゲノム構造»。 化学 361 :924-928。 doi: 10.1126/science.aat5641 。
書誌 [ 編集します ]
- アルバーツ、ブルース et al (1996)。 細胞の分子生物学 。バルセロナ:オメガエディション。 ISBN 84-282-1011-X 。
- (フランス語で) Karolin Luger、Armin W.Mäder、Robin K. Richmond、David R. Sargent et Timothy J. Richmond、«2.8 a Resolationでのヌクレオソームコア粒子の結晶構造»、Nature、vol。 389、N.O 6648、Septieembre de 1997、pp。 251-260( PMID 9305837 、doi 10.1038/38444)。
- (英語で) Attilanémethet gernotlängst、«クロマチン高次構造:転写のためにクロマチンを開く»、概要。機能します。ゲノムプロテオーム、Vol。 2、N.º4、2004、pp。334-343( PMID 15292447 )。 https://academic.up.com/bfg/article/2/4/334/224945
- (英語で) ドナルド・E・オリンズ・エ・エイダ・L・オリンズ、«クロマチンの歴史:橋からの私たちの見解»、nat。 Rev. Mol。 Cell Biol。、vol。 4、N.º10、2003、pp。809-814( PMID 14570061 、doi 10.1038/nrm1225)
外部リンク [ 編集します ]

Recent Comments