ProteinBiosense -Wikipedia

Proteinbiosinese (PBS)は、細胞内のタンパク質の新しい形成です。このプロセスでは、すべての生物について、アミノ酸からのタンパク質が遺伝情報に従って構築されています。
ビルディングブロックからのタンパク質の合成であるタンパク質原性アミノ酸は、リボソーム上の遺伝子発現の一部として起こります。リボソームタンパク質合成は、メッセンジャーRNA(mRNA)の塩基配列がペプチドのアミノ酸の配列に変換されるため、翻訳とも呼ばれます。これは、mRNAのすべてのコドンとその個別に輸送されたアミノ酸のすべてのコドンに、トランスファーRNA(TRNA)の対応する抗コドンを連続的に割り当てることによって行われ、特徴的なアミノ酸配列を持つ鎖が作成されるように隣接する(ペプチド結合)に結合します。周囲の培地では、このポリペプチドは3次元の形の構造構造に組み込むことができます。 ネイティブタンパク質 。多くの場合、それは後で分割、コンバージョン、および拡張機能によって変更され、ポスト翻訳が変更されました。
環状DNAは原核生物のサイトゾル(プロセス)で自由に利用可能であり、リボソームタンパク質合成は通常、作成されたmRNAで直接かつ迅速に行われますが、ユーカリオテの条件はより複雑です。いくつかの染色体に分布したゲノムの場合、細胞核(核)が独自のコンパートメントを作成しました。主に描かれたRNAコピー(hnRNA)は、最初にKernexportのために安定化、改訂、準備されます。それは、mRNAとしてコアポアを通過し、リボソームのサブユニットを含む細胞質に入ります。したがって、この空間分割とマルチステッププロセスパスは、転写後に(HN)RNAを変更し、遺伝子発現を調節したり、タンパク質生合成から特定のRNAテンプレートを除外したりする追加の方法を可能にします(遺伝子除去)。
一部の種類の細菌、Archaee、およびマッシュルームは、多酵素複合体(NRP)として非トリビソームペプチド合成を可能にするリボソームタンパク質合成を介して特別なタンパク質を構築できます。 [初め] [2]
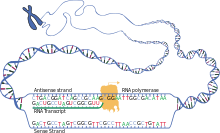
細胞内のタンパク質生合成の最初のステップでは、遺伝子の切片が二本鎖DNAで訪問され、一本鎖RNA分子で読み取り、書き直されます。このプロセスでは、DNAのヌクレイン塩基の現在の配列(アデニン、グアニン、シトシン、チミン)は、RNAモジュールの核塩基(ウラシル、シトシン、グアニン、アデニン)によって補完されます。その後、RNA転写産物では鎖にリンクされている場合、チミンの代わりにデオキシリボースとウラシルの代わりにリボーシスが発生します。遺伝情報は塩基配列に含まれ、DNA上のコドゲンはメッセンジャーまたはメッセンジャーリボ核酸のコドンに転写され、略してmRNAが転写されます。
遺伝子の転写には、他のいくつかの因子に加えて、RNAポリメラーゼが酵素として必要であり、DNAテンプレートに応じてRNAポリマーの連続構造を触媒します。テンプレートに割り当てられたリボヌクレオシド三リン酸(UTP、CTP、GTP、ATP)は、RNAのポリヌクレオチドにリンクされています。 mRNAを使用してタンパク質をコード化した遺伝子の転写や、たとえばrRNAまたはTRNAの形成など、他の遺伝子の異なるタイプのRNAポリメラーゼがあります。
転写は、真核生物の細胞核で起こります。したがって、mRNAは、翻訳がそこに実行されるため、コアからサイトゾルにエクスポートする必要があります。一方、プロトリオットにはコアコンパートメントがありません。細胞血漿の翻訳に加えて、転写がここで行われます。
- スプライス
- 真核生物の場合、結果として得られるpre-mRNAに含まれる非コードイントロンは、必要なエクソンのみが残るように、純粋な転写から切り取る必要があります。このプロセスはスプライスと呼ばれます。コンセンサスシーケンスは、イントロンを認識するのに役立ちます。吐き出すとき、イントロンとエクソン・イントロンの遷移の領域で異なるSNRNPが結合します。スプライスオソームの形成により、これらは最もリンダジーの結合の分割につながり、したがってイントロンを切断します。同時に、エクソンが結紮されます。スプラインはrRNAとtRNAでも発生します。
- キャッピング
- それまでの間、RNAの安定性が増加するSOコールされたキャッピングも起こります。いわゆる5 ‘キャップ構造が取り付けられています。これにより、合成中の前mRNAの5’端が「CAP」と呼ばれる構造に変換され、5’-エキソヌクレアスとホスファターゼによる消化からmRNAを保護します。
- ポリアジル化
- ポリジル化では、ポリ(a)尾は、RNAの新しい3 ‘末端(長さ250ヌクレオチド)に付着しています。このポリ(a)尾は、mRNAの細胞質への輸出を促進し、酵素破壊から3’ENDを保護します。
- RNAエディション
- RNAエディションでは、RNA分子の個々またはいくつかの核塩基が変更(変更)、挿入(挿入)、または切り取られます(削除)。たとえば、編集により、前者の上流にあるmRNA上の新しいストップコドンが生じる可能性があります。その後、翻訳はここで壊れ、タンパク質のより短いアイソフォームが形成されます。 RNA編集は、一部の生物、細胞、または細胞オルガネラでのみ発生し、多くの場合、特別なヌクレオチド配列に限定されます。

翻訳とは、mRNAの塩基配列のリボソームに起こるタンパク質のアミノ酸配列への翻訳を意味します。
mRNAでは、3つの連続した塩基、ベーストリプレットが、オープンリーダーフレーム内にコドンを形成し、アミノ酸をコードします(遺伝コードも参照)。リボソームでは、コドンはその配列に応じてアミノ酸に翻訳され、それらを連続してポリペプチドにリンクします。
2つのアミノ酸間でペプチド結合を形成するには、空間的に近接して互いに持ち込まれなければなりません。この目的のために、大きな超分子構造の表面が必要です。リボソームは、このタスクを実行します。このタスクは、小さなサブユニットで構成され、2つの側面側の結合部位を形成します。
コドンと関連するアミノ酸の間に構造的な関係がないため、中間体が必要であり、一方ではアミノ酸に結合し、他方ではmRNA上の関連コドンを認識します。この媒介機能は、認識領域を持つアミノ酸が「バン」を「バン」するように、さまざまなトラーであるトランスファーリボ核酸分子を引き継ぎます。彼らは、アミノ酸結合機関とアンチコドンの2つの露出した結合部位を持っています。トラチェンのアミノ酸結合部位には、アミノアシル-TRNAシンテターゼによって適切なアミノ酸が特異的にロードされています。アンチコドンを使用すると、tRNAはmRNA上の相補的なコドンを認識し、特にそれに結合します。
翻訳プロセスは、3つのフェーズに分けることができます。初期段階、伸び段階、最後に終了します。
- 初期
- 以前に合成されたmRNAがリボソームに到達した場合、リボソームの小さなサブユニットは、8月の開始コドンに遭遇するまでmRNAに沿ってさまよいます。アンチコドンUACと一致するメチオニンTRNAをコドン(開始複合体)に固定します。
- 伸長点
- GTPの分割により、リボソームの大きなサブユニットも保存され、伸びが始まります。
- メチオニン-TRNAは、開始フェーズのP結合部位に位置するため、次のtRNAをA結合部位に取り付けることができます。ペプチジルトランスフェラーゼは、最初のtRNAのメチオニンをその後のtRNAのアミノ酸に関連付けました。このジペプチドの形成は、結合部位で行われます。結局のところ、リボソームユニットはベーストリプレットの周りでハイキングを続けています。
- ジペプチドを備えたtRNAは現在、P結合部位にあり、そこから最初の、現在不人気なtRNAを置き換えており、自由A結合部位は再びmRNA鎖のベーストリプレットに適合する次のtRNAを再び付着させることができます。
- 終了
- mRNAに沿って移動するリボソームが3つのストップコドンの1つを満たしている場合、アミノ酸にコードされる適切なtRNA分子がないため、翻訳が最初に立っています(抑制)。 [3] SO -CALLED 終了 – また 放出係数 (RFS)は、a-positionに結合し、ペプチジルトランスフェラーゼの基質特異性を変化させて、AA-TRNAの代わりに水分子を活性化します。 [3] ペプチド鎖とtRNAの間の結合に対する求核攻撃により、合成されたタンパク質が最終的に放出され、mRNAがリボソームから分離されます。 [3]
いくつかのタンパク質のポリペプチド鎖は、翻訳中に特別な酵素によって変化します(共逆系)が変更されますが、ほとんどの場合、タンパク質は翻訳後(翻訳後)にのみ修飾されます。シャペロンは、タンパク質継体にも依存しているタンパク質フィッティングの形態に影響を与えますが、細胞にはタンパク質の構造を特に変換し、この方法で異なるタンパク質種を作成し、修飾を通じてプロテオームを拡大するさまざまな方法もあります。
これらの修飾には、個々の末端アミノ酸のスピンオフまたはコース前タンパク質用の長いペプチド配列、追加の結合の導入が含まれます。 B.システイン残基の間のジスルフィドブリッジ、またはヒドロキシル化アミノ酸(プロリンから4-ヒドロキシプロリン、プロリル-4-ヒドロキシラーゼ、リジン、リジンからヒドロキシリーシン、リシルヒドロキシラーゼを介してヒドロキシリーシン)などの官能基の間の架橋)、酸化剤を使用して、炭化物を使用して、炭化物を使用します。 Ylationsとその他多く。たとえば、グリコシル化糖タンパク質は、アシル化とプレニル化によりリポタンパク質を生成します。
修飾の個々のステップはそれぞれ特別な酵素によって触媒され、その発生はしばしば特定のオルガネラ、細胞、または組織に限定されます。さらに、細胞環境、開発段階、または環境条件に応じて、変更ステップまたはその時間経過のシーケンスを変化させることができます。たとえば、コラーゲン分子は、多くの翻訳後修飾を経験します。その一部は細胞外室でのみ行われます。
目的地としての多くのタンパク質なので( 英語 目標 )サイトゾルではなく、細胞外空間、細胞膜、葉緑体、ミトコンドリア、ペルオキシソーム、細胞核または小胞体などのオルガネラは、そこにタンパク質を使用するさまざまなメカニズムを持っています。これらのタンパク質は通常、nまたはnを含んでいます c – ターゲットメカニズムに応じて非常に異なる方法で構築できる末端信号配列。場合によっては、末端配列はありませんが、タンパク質の宛先を決定するペプチド鎖からの内部信号があります。
- 小胞体(ER)が特定のものを持つ目標があるタンパク質 n – タンパク質RNA複合体の末端配列、 信号認識粒子 (SRP)、認識されます。次に、SRPペプチドリボソーム複合体が小胞体に補充され、そこで認識され、結合されます。翻訳は膜によって継続されます。取り付けられたリボソームは、「粗い人」の印象を生み出します。 共逆系タンパク質輸送を参照してください 。小胞体では、新しく合成されたタンパク質の品質制御が起こります。
- 葉緑体に費やす必要があるタンパク質には1つあります n – 通常、早期にリン酸化される末端信号配列。タンパク質HSP70、14-3-3、およびTOC64は、タンパク質前駆体との相互作用を通じて認識と転送に役割を果たすことができます。タンパク質プレキューサー複合体は、外部葉緑体のトランスコン装置の受容体構造の葉緑体の表面に到着した後に認識されます(外葉緑体膜、TOCのトランスコン)。 GTP加水分解下では、タンパク質は膜間空間にインポートされるか、内葉形成膜のトランスコン装置(TIC)を介して間質に直接インポートされます。チラコイドの膜または内腔への輸入のために、少なくとも4つの方法がとして使用されます sec依存 、 SRP依存 、 デルタpH/tat依存 また 自発 指定されています。
- これまでのところ、ミトコンドリウムの酵母と動物細胞については、3つの異なる輸入経路が説明されています。
- シーケンス前のインポートパス、そのタンパク質 n – ターミナルは両親媒性アルファヘリックスを着用します。これらのタンパク質は、主にマトリックス、内膜、または膜間室を対象としています。
- 内部信号が異なる内膜のタンパク質のキャリアタンパク質輸入経路。
- タンパク質をベータバレルモチーフと統合するために使用される外側エンベロープ膜のタンパク質の輸入経路。ここでも、シーケンスの内部信号があります。
- 3つの輸入経路はすべて、異なる受容体を持つ外膜(TOM)のミトコンドリアトランスコン装置から始まります。したがって、受容体Tom20とTom22はこれを認識しています n – 末端信号と前駆体タンパク質を孔Tom40に転送します。受容体Tom70は、外膜を対象としたタンパク質の内部信号を認識します。
- 膜間部屋にインポートした後、パスは分離します。外膜を対象としたベータバレルモチーフを持つタンパク質は、SAM複合体(並べ替えとアセンブリ)によって膜に統合されます。他の2つの輸入経路のタンパク質はさまざまなTIM複合体に伝達されます。プレシーケンスを持つタンパク質はTIM23複合体によって認識され、TIM22複合体の内膜のタンパク質が認識されます。
- プレシーケンスは酵素MPPによって行われます( 英語 ミトコンドリア処理ペプチダーゼ )削除。
上記のシグナル配列に加えて、グリコシル化により、細胞膜への設置またはエキソサイトーシスのターゲティングが可能になります。両方の経路は通常、ゴルジの小胞の上を導きます。
- ↑ マティアス・ストリーカー、アラン・タノビッチ、モハメド・A・マラハヒエル: 非リボソームペプチドシンテターゼ:構造とダイナミクス。 の: 構造生物学における現在の意見。 バンド20、ナンバー2、2010年4月、P。234-240、doi: 10.1016/j.sbi.2010.01.009 、 PMID 20153164 。
- ↑ ギャビンJ.ウィリアムズ: エンジニアリングポリケチドシンターゼおよび非リボソームペプチドシンテターゼ。 の: 構造生物学における現在の意見。 第23巻、番号4、2013年8月、pp。603–612、doi: 10.1016/j.sbi.2013.06.012 、 PMID 23838175 。
- ↑ a b c 翻訳 。 ( Spektrum.de [2018年6月15日にアクセス])。
Recent Comments