Mitotische Rekombination – Wikipedia
Mitotische Rekombination ist eine Art genetischer Rekombination, die in somatischen Zellen während ihrer Vorbereitung auf die Mitose sowohl bei sexuellen als auch bei asexuellen Organismen auftreten kann. Bei asexuellen Organismen ist die Untersuchung der mitotischen Rekombination eine Möglichkeit, die genetische Verknüpfung zu verstehen, da sie die einzige Quelle für die Rekombination innerhalb eines Individuums ist.[1] Zusätzlich kann eine mitotische Rekombination zur Expression rezessiver Gene in einem ansonsten heterozygoten Individuum führen. Diese Expression hat wichtige Implikationen für die Untersuchung der Tumorentstehung und der letalen rezessiven Gene.[1][2]
Mitotische homologe Rekombination tritt hauptsächlich zwischen Schwesterchromatiden nach der Replikation (jedoch vor der Zellteilung) auf. Die homologe Rekombination zwischen Schwestern ist normalerweise genetisch stumm. Während der Mitose beträgt die Häufigkeit der Rekombination zwischen homologen Nichtschwesterchromatiden nur etwa 1% derjenigen zwischen Schwesterchromatiden.[3]
Entdeckung[edit]
Die Entdeckung der mitotischen Rekombination ergab sich aus der Beobachtung der Zwillingsfleckenbildung Drosophila melanogaster. Diese Doppelfleckung oder Mosaikfleckung wurde in beobachtet D. Melanogaster Bereits 1925, aber erst 1936 erklärte Curt Stern dies als Ergebnis einer mitotischen Rekombination. Vor Sterns Arbeit wurde die Hypothese aufgestellt, dass Zwillingsflecken auftraten, weil bestimmte Gene das Chromosom, auf dem sie sich befanden, eliminieren konnten.[4] Spätere Experimente deckten auf, wann mitotische Rekombination im Zellzyklus auftritt und welche Mechanismen hinter der Rekombination stehen.
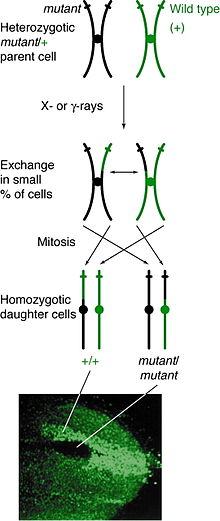
Auftreten[edit]
Mitotische Rekombination kann an jedem Ort auftreten, ist jedoch bei Personen zu beobachten, die an einem bestimmten Ort heterozygot sind. Wenn ein Crossover-Ereignis zwischen Nicht-Schwester-Chromatiden diesen Ort beeinflusst, haben beide homologen Chromosomen ein Chromatid, das jeden Genotyp enthält. Der resultierende Phänotyp der Tochterzellen hängt davon ab, wie sich die Chromosomen auf der Metaphasenplatte ausrichten. Wenn sich die Chromatiden, die verschiedene Allele enthalten, auf derselben Seite der Platte befinden, erscheinen die resultierenden Tochterzellen heterozygot und sind trotz des Crossover-Ereignisses nicht nachweisbar. Wenn jedoch Chromatiden, die dieselben Allele enthalten, auf derselben Seite aufgereiht sind, sind die Tochterzellen an diesem Ort homozygot. Das führt zu Twin Spottingwobei eine Zelle den homozygoten rezessiven Phänotyp aufweist und die andere Zelle den homozygoten Wildtyp-Phänotyp aufweist. Wenn sich diese Tochterzellen weiter replizieren und teilen, wachsen die Zwillingsflecken weiter und spiegeln den unterschiedlichen Phänotyp wider.
Die mitotische Rekombination findet während der Interphase statt. Es wurde vorgeschlagen, dass die Rekombination während G1 stattfindet, wenn sich die DNA in ihrer 2-Strang-Phase befindet, und während der DNA-Synthese repliziert wird.[5] Es ist auch möglich, dass der DNA-Bruch, der zu einer mitotischen Rekombination führt, während G1 auftritt, die Reparatur jedoch nach der Replikation erfolgt.[6][7]
Reaktion auf DNA-Schäden[edit]
In der aufkeimenden Hefe Saccharomyces cerevisiaeMutationen in mehreren Genen, die für die mitotische (und meiotische) Rekombination benötigt werden, verursachen eine erhöhte Empfindlichkeit gegenüber Inaktivierung durch Strahlung und / oder genotoxische Chemikalien.[8] Zum Beispiel Gen. rad52 ist für die mitotische Rekombination erforderlich[9] sowie meiotische Rekombination.[10]Rad52 mutierte Hefezellen haben eine erhöhte Empfindlichkeit gegenüber dem Abtöten durch Röntgenstrahlen, Methylmethansulfonat und das DNA-Vernetzungsmittel 8-Methoxypsoralen plus UV-Licht, was darauf hindeutet, dass eine mitotische Rekombinationsreparatur erforderlich ist, um die verschiedenen DNA-Schäden zu entfernen, die durch diese Mittel verursacht werden.
Mechanismen[edit]
Die Mechanismen hinter der mitotischen Rekombination ähneln denen hinter der meiotischen Rekombination. Dazu gehören der Austausch von Schwesterchromatiden und Mechanismen im Zusammenhang mit der Reparatur von DNA-Doppelstrangbrüchen durch homologe Rekombination wie Einzelstrang-Annealing, synthetiseabhängiges Strang-Annealing (SDSA) und Genumwandlung durch ein Doppel-Holliday-Junction-Intermediat oder SDSA. Darüber hinaus ist eine nicht homologe mitotische Rekombination eine Möglichkeit und kann häufig auf eine nicht homologe Endverbindung zurückgeführt werden.[6][7][11][12]
Es gibt verschiedene Theorien darüber, wie mitotische Überkreuzungen auftreten. Im einfachen Crossover-Modell überlappen sich die beiden homologen Chromosomen an oder in der Nähe einer gemeinsamen chromosomalen fragilen Stelle (CFS). Dies führt zu einem Doppelstrangbruch,[13] die dann mit einem der beiden Stränge repariert wird. Dies kann dazu führen, dass die beiden Chromatiden die Plätze wechseln. In einem anderen Modell bilden zwei überlappende Schwesterchromatiden an einer gemeinsamen Wiederholungsstelle einen doppelten Holliday-Übergang und werden später so geschert, dass sie die Plätze wechseln. In beiden Modellen ist nicht garantiert, dass die Chromosomen gleichmäßig handeln oder sich sogar auf gegenüberliegenden Seiten wieder verbinden, so dass die meisten Spaltungsmuster zu keinem Crossover-Ereignis führen. Ungleichmäßiger Handel führt viele der schädlichen Auswirkungen von mitotischem Crossover ein.
Alternativ kann während der DNA-Reparatur eine Überkreuzung auftreten[14] wenn aufgrund einer ausgedehnten Schädigung das homologe Chromosom als Matrize über dem Schwesterchromatid gewählt wird. Dies führt zur Gensynthese, da eine Kopie des Allels gegenüber dem homologen Chromosom kopiert und dann in die Verletzung auf dem beschädigten Chromosom synthetisiert wird. Der Nettoeffekt davon wäre ein heterozygotes Chromosom und ein homozygotes Chromosom.
Vorteile und Nachteile[edit]
Es ist bekannt, dass mitotische Überkreuzungen in auftreten D. MelanogasterEinige asexuell reproduzierende Pilze und normale menschliche Zellen, bei denen das Ereignis die Expression von normalerweise rezessiven krebserregenden Genen ermöglichen und somit die Zelle, in der sie auftreten, für die Entwicklung von Krebs prädisponieren kann. Alternativ kann eine Zelle eine homozygote Mutante für ein tumorsuppressives Gen werden, was zu demselben Ergebnis führt.[2] Zum Beispiel wird das Bloom-Syndrom durch eine Mutation in der RecQ-Helikase verursacht, die eine Rolle bei der DNA-Replikation und -Reparatur spielt. Diese Mutation führt bei Mäusen zu hohen Raten der mitotischen Rekombination, und diese Rekombinationsrate ist wiederum dafür verantwortlich, dass diese Mäuse eine Tumoranfälligkeit verursachen.[15] Gleichzeitig kann die mitotische Rekombination von Vorteil sein: Sie kann eine wichtige Rolle bei der Reparatur doppelsträngiger Brüche spielen und für den Organismus von Vorteil sein, wenn homozygote dominante Allele funktioneller sind als der heterozygote Zustand.[2] Zur Verwendung beim Experimentieren mit Genomen in Modellorganismen wie z Drosophila melanogasterDie mitotische Rekombination kann über Röntgenstrahlen und das FLP-FRT-Rekombinationssystem induziert werden.[16]
Verweise[edit]
- ^ ein b Hartl, Daniel L. und Maryellen Ruvolo (2012). Genetik: Analyse von Genetik und Genomen. Burlington: Jones & Bartlett.
- ^ ein b c Tischfield, Jay A. (November 1997). “Verlust der Heterozygotie oder: Wie ich gelernt habe, mich nicht mehr zu sorgen und die mitotische Rekombination zu lieben”. American Journal of Human Genetics. 61 (5): 995–999. doi:10.1086 / 301617. PMC 1716040. PMID 9345110.
- ^ Moynahan ME, Jasin M (2010). “Mitotische homologe Rekombination erhält die genomische Stabilität aufrecht und unterdrückt die Tumorentstehung”. Nat. Rev. Mol. Cell Biol. 11 (3): 196–207. doi:10.1038 / nrm2851. PMC 3261768. PMID 20177395.
- ^ Stern, Curt (1936). “Somatische Überkreuzung und Segregation in Drosophila Melanogaster”. Genetik. 21 (6): 625–730. PMC 1208727. PMID 17246815.
- ^ Esposito, Michael S. (September 1978). “Beweis, dass eine spontane mitotische Rekombination im Zwei-Strang-Stadium auftritt”. Verfahren der National Academy of Sciences der USA. 75 (9): 4436–4440. doi:10.1073 / pnas.75.9.4436. PMC 336130. PMID 360220.
- ^ ein b Lee, Phoebe S.; Greenwell, Patricia W.; Dominska, Margaret; Gawel, Malgorzata; Hamilton, Monica; Petes, Thomas D. (2009). “Eine Feinstrukturkarte spontaner mitotischer Überkreuzungen in der Hefe Saccharomyces cerevisiae”. PLOS Genet. 5 (3): e1000410. doi:10.1371 / journal.pgen.1000410. PMC 2646836. PMID 19282969.
- ^ ein b LaFave, MC; J Sekelsky (2009). “Mitotische Rekombination: Warum? Wann? Wie? Wo?”. PLOS Genet. 5 (3): e1000411. doi:10.1371 / journal.pgen.1000411. PMC 2648873. PMID 19282976.
- ^ Haynes, RH & amp; Kunz, BA (1981). DNA-Reparatur und Mutagenese in Hefe. In: Strathern, J; Jones, E; Broach J. Herausgeber. Die Molekularbiologie der Hefesaccharomyces. Lebenszyklus und Vererbung. Cold Spring Harbor, NY, Laboratorium von Cold Spring Harbor, 371-414.
- ^ Malone RE, Esposito RE (1980). “Das RAD5Das 2-Gen ist für die homothallische Umwandlung von Paarungstypen und die spontane mitotische Rekombination in Hefe erforderlich. “. Proc. Natl. Acad. Sci. Vereinigte Staaten von Amerika. 77 (1): 503–7. doi:10.1073 / pnas.77.1.503. PMC 348300. PMID 6987653.
- ^ Spiel JC, Zamb TJ, Braun RJ, Resnick M, Roth RM (1980). “Die Rolle von Strahlengenen bei der meiotischen Rekombination in Hefe”. Genetik. 94 (1): 51–68. PMC 1214137. PMID 17248996.
- ^ Helleday, Thomas (2003). “Wege zur mitotischen homologen Rekombination in Säugetierzellen”. Mutationsforschung. 532 (1–2): 103–115. doi:10.1016 / j.mrfmmm.2003.08.013. PMID 14643432.
- ^ Pâques, Frédéric; James E. Haber (1999). Mehrere durch Doppelstrang-Einbrüche induzierte Rekombinationswege Saccharomyces cerevisiae“”. Mikrobiologie und Molekularbiologie Bewertungen. 63 (2): 349–404. doi:10.1128 / MMBR.63.2.349-404.1999. PMC 98970. PMID 10357855.
- ^ Helleday, T. “Reparatur von Doppelstrangbrüchen über Double Holliday Junctions (Modell Szostak)”. Animation. MIT.
- ^ Helleday, Thomas (27. November 2003). “Wege zur mitotischen homologen Rekombination in Säugetierzellen” (PDF). Mutationsforschung. 532 (1–2): 103–115. doi:10.1016 / j.mrfmmm.2003.08.013. PMID 14643432. Archiviert von das Original (PDF) am 24. Mai 2014. Abgerufen 2012-12-26.
- ^ Luo, Guangbin; et al. (2000). “Krebsveranlagung durch erhöhte mitotische Rekombination bei Bloom-Mäusen”. Naturgenetik. 26 (4): 424–429. doi:10.1038 / 82548. PMID 11101838. S2CID 21218975.
- ^ Xu, T; GM Rubin (April 1993). “Analyse genetischer Mosaike in sich entwickelnden und adulten Drosophila-Geweben”. Entwicklung. 117 (4): 1223–12237. PMID 8404527.
Recent Comments