Organokatalyse – Wikipedia

In der organischen Chemie der Begriff Organokatalyse (ein Portmanteau der Begriffe “organisch” und “Katalysator”) bezieht sich auf eine Form der Katalyse, bei der die Geschwindigkeit einer chemischen Reaktion durch einen organischen Katalysator erhöht wird, der als “Organokatalysator” bezeichnet wird und aus Kohlenstoff, Wasserstoff, Schwefel und anderen besteht Nichtmetallelemente in organischen Verbindungen.[3][4][5][6][7][8] Aufgrund ihrer Ähnlichkeit in Zusammensetzung und Beschreibung werden sie aufgrund ihrer vergleichbaren Auswirkungen auf Reaktionsgeschwindigkeiten und Katalyseformen häufig als Fehlbezeichnung für Enzyme verwechselt.
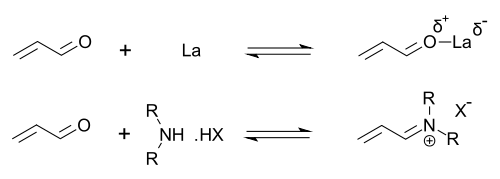
Organokatalysatoren, die eine sekundäre Aminfunktionalität aufweisen, können so beschrieben werden, dass sie entweder eine Enaminkatalyse (durch Bildung katalytischer Mengen eines aktiven Enaminnukleophils) oder eine Iminiumkatalyse (durch Bildung katalytischer Mengen eines aktivierten Iminiumelektrophils) durchführen. Dieser Mechanismus ist typisch für die kovalente Organokatalyse. Die kovalente Bindung des Substrats erfordert normalerweise eine hohe Katalysatorbeladung (für die Prolinkatalyse typischerweise 20 bis 30 Mol-%). Nichtkovalente Wechselwirkungen wie Wasserstoffbrücken ermöglichen niedrige Katalysatorbeladungen (bis zu 0,001 Mol-%).
Die Organokatalyse bietet mehrere Vorteile. Eine Katalyse auf Metallbasis ist nicht erforderlich, was einen Beitrag zur grünen Chemie leistet. In diesem Zusammenhang wurden einfache organische Säuren als Katalysator für die Modifizierung von Cellulose in Wasser im Mehrtonnenmaßstab verwendet.[9] Wenn der Organokatalysator chiral ist, eröffnet sich ein Weg zur asymmetrischen Katalyse. Beispielsweise ist die Verwendung von Prolin in Aldolreaktionen ein Beispiel für Chiralität und grüne Chemie.[10]
Einführung[edit]
Regelmäßige achirale Organokatalysatoren basieren auf Stickstoff wie Piperidin, das bei der Knoevenagel-Kondensation verwendet wird.[11]DMAP wird bei Veresterungen verwendet[12] und DABCO, das in der Baylis-Hillman-Reaktion verwendet wurde.[13]Thiazoliumsalze werden in der Stetter-Reaktion eingesetzt. Diese Katalysatoren und Reaktionen haben eine lange Geschichte, aber das derzeitige Interesse an der Organokatalyse konzentriert sich auf die asymmetrische Katalyse mit chiralen Katalysatoren asymmetrische Organokatalyse oder enantioselektive Organokatalyse. Eine in den 1970er Jahren entwickelte Pionierreaktion heißt Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion. Zwischen 1968 und 1997 gab es nur wenige Berichte über die Verwendung kleiner organischer Moleküle als Katalysatoren für asymmetrische Reaktionen (die Hajos-Parrish-Reaktion ist wahrscheinlich die bekannteste), aber diese chemischen Studien wurden eher als einzigartige chemische Reaktionen als als integrale angesehen Teile eines größeren, miteinander verbundenen Feldes.[14]
Bei dieser Reaktion ist natürlich vorkommendes chirales Prolin der chirale Katalysator in einer Aldol-Reaktion. Das Ausgangsmaterial ist ein achirales Triketon und es benötigt nur 3% Prolin, um das Reaktionsprodukt zu erhalten, ein Ketol in 93% Enantiomerenüberschuss. Dies ist das erste Beispiel einer Aminosäure-katalysierten asymmetrischen Aldolreaktion.[15][16]
Die asymmetrische Synthese des Wieland-Miescher-Ketons (1985) basiert ebenfalls auf Prolin, und eine weitere frühe Anwendung war eine der Transformationen in der Totalsynthese von Erythromycin durch Robert B. Woodward (1981).[17] Ein Mini-Review-Digest-Artikel konzentriert sich auf ausgewählte aktuelle Beispiele der Totalsynthese von natürlichen und pharmazeutischen Produkten unter Verwendung organokatalytischer Reaktionen.[18]
Viele chirale Organokatalysatoren sind eine Anpassung chiraler Liganden (die zusammen mit einem Metallzentrum auch asymmetrische Reaktionen katalysieren), und beide Konzepte überschneiden sich bis zu einem gewissen Grad.
Organokatalysatorklassen[edit]
Organokatalysatoren für die asymmetrische Synthese können in mehrere Klassen eingeteilt werden:
Beispiele für asymmetrische Reaktionen mit Organokatalysatoren sind:
Proline[edit]
Die Prolinkatalyse wurde überprüft.[20][21]
Imidazolidinon-Organokatalyse[edit]
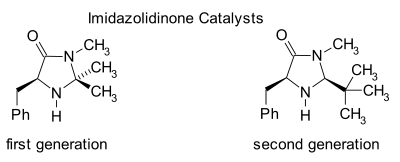
Imidazolidinone sind Katalysatoren für viele Transformationen wie asymmetrische Diels-Alder-Reaktionen und Michael-Additionen. Chirale Katalysatoren induzieren asymmetrische Reaktionen, oft mit hohen Enantioselektivitäten. Dieser Katalysator bildet ein Iminiumion mit Carbonylgruppen von α, β-ungesättigten Aldehyden (Enalen) und Enonen in einem schnellen chemischen Gleichgewicht. Diese Iminiumaktivierung ähnelt der Aktivierung von Carbonylgruppen durch eine Lewis-Säure und beide Katalysatoren senken das LUMO des Substrats:[22][23]
Das transiente Iminium-Intermediat ist chiral, das durch chirale Induktion auf das Reaktionsprodukt übertragen wird. Die Katalysatoren wurden in Diels-Alder-Reaktionen, Michael-Additionen, Friedel-Crafts-Alkylierungen, Transferhydrierungen und Epoxidierungen verwendet.
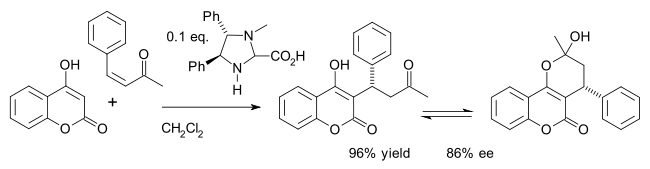
Ein Beispiel ist die asymmetrische Synthese des Wirkstoffs Warfarin (im Gleichgewicht mit dem Hemiketal) in einer Michael-Addition von 4-Hydroxycumarin und Benzylidenaceton:[24]
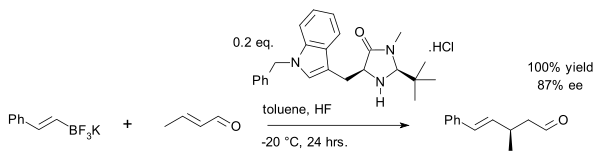
Ein neuer Exploit ist die Vinylalkylierung von Crotonaldehyd mit einem Organotrifluorboratsalz:[25]
Für andere Beispiele seiner Verwendung: siehe organokatalytische Transferhydrierung und asymmetrische Diels-Alder-Reaktionen.
Thioharnstoff-Organokatalyse[edit]
Eine große Gruppe von Organokatalysatoren enthält die Harnstoff- oder Thioharnstoffeinheit. Diese katalytisch wirksamen (Thio) Harnstoff-Derivate, die als (Thio) Harnstoff-Organokatalysatoren bezeichnet werden, bieten explizite doppelte Wasserstoffbrückenbindungen, um Substrate zu koordinieren und zu aktivieren, die H-Bindungen akzeptieren.[26]
Verweise[edit]
- ^ Justus von Liebig, Justus (1860). “Über die Bildung des Oxamids aus Cyan”. Annalen der Chemie und Pharmacie. 113 (2): 246–247. doi:10.1002 / jlac.18601130213.
- ^ W. Langenbeck (1929). “Über organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden”. Liebigs Ann. 469: 16-25. doi:10.1002 / jlac.19294690103.
- ^ Berkessel, A., Groeger, H. (2005). Asymmetrische Organokatalyse. Weinheim: Wiley-VCH. ISBN 978-3-527-30517-9.CS1-Wartung: mehrere Namen: Autorenliste (Link)
- ^ Sonderausgabe: List, Benjamin (2007). “Organokatalyse”. Chem. Rev.. 107 (12): 5413–5883. doi:10.1021 / cr078412e.
- ^ Peter I. Dalko; Lionel Moisan (2004). “Im goldenen Zeitalter der Organokatalyse”. Angew. Chem. Int. Ed. 43 (39): 5138–5175. doi:10.1002 / anie.200400650. PMID 15455437.
- ^ Matthew J. Gaunt; Carin CC Johansson; Andy McNally; Ngoc T. Vo (2007). “Enantioselektive Organokatalyse”. Drug Discovery Today. 12 (1/2): 8–27. doi:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ Dieter Enders; Christoph Grondal; Matthias RM Hüttl (2007). “Asymmetrische organokatalytische Dominoreaktionen”. Angew. Chem. Int. Ed. 46 (10): 1570–1581. doi:10.1002 / anie.200603129. PMID 17225236.
- ^ Peter I. Dalko; Lionel Moisan (2001). “Enantioselektive Organokatalyse”. Angew. Chem. Int. Ed. 40 (20): 3726–3748. doi:10.1002 / 1521-3773 (20011015) 40:20<3726::AID-ANIE3726>3.0.CO; 2-D.
- ^ Internationales Patent WO 2006068611 A1 20060629 “Direkte homogene und heterogene organische Säure und Aminosäure-katalysierte Modifikation von Aminen und Alkoholen” Erfinder: Armando Córdova, Stockholm, Schweden; Jonas Hafrén, Stockholm, Schweden.
- ^ Beispiel 4 im US-Patent 3,975,440 vom 17. August 1976, eingereicht am 9. Dezember 1970, Zoltan G. Hajos und David R. Parrish.
- ^ List, B. (2010). “Emil Knoevenagel und die Wurzeln der Aminokatalyse”. Angewandte Chemie International Edition in englischer Sprache. 49 (10): 1730–1734. doi:10.1002 / anie.200906900. PMID 20175175.
- ^ Neises, Bernhard; Steglich, Wolfgang (Juli 1978). “Einfache Methode zur Veresterung von Carbonsäuren”. Angewandte Chemie International Edition in englischer Sprache. 17 (7): 522–524. doi:10.1002 / anie.197805221.
- ^ Basavaiah, Deevi; Rao, Anumolu Jaganmohan; Satyanarayana, Tummanapalli (März 2003). “Jüngste Fortschritte in der Baylis-Hillman-Reaktion und -Anwendungen”. Chemische Bewertungen. 103 (3): 811–892. doi:10.1021 / cr010043d. PMID 12630854.
- ^ “Das Aufkommen und die Entwicklung der Organokatalyse” David C. MacMillan, NATUREVol 455 | 18. September 2008| doi: 10.1038 / nature07367
- ^ ZG Hajos, DR Parrish, Deutsches Patent DE 2102623 1971
- ^ Zoltan G. Hajos; David R. Parrish (1974). “Asymmetrische Synthese bicyclischer Zwischenprodukte der Naturstoffchemie”. J. Org. Chem. 39 (12): 1615–1621. doi:10.1021 / jo00925a003.
- ^ RB Woodward; E. Logusch; KP Nambiar; K. Sakan; DE Ward; BW Au-Yeung; P. Balaram; LJ Browne; et al. (1981). “Asymmetrische Totalsynthese von Erythromcin. 1. Synthese eines Erythronolid-A-secoacid-Derivats durch asymmetrische Induktion”. Marmelade. Chem. Soc. 103 (11): 3210–3213. doi:10.1021 / ja00401a049.
- ^ B. -F. So (2015). “Totalsynthese von natürlichen und pharmazeutischen Produkten, die durch organokatalytische Reaktionen angetrieben werden”. Tetrahedron Lett. 56 (17): 2133–2140. doi:10.1016 / j.tetlet.2015.03.046.
- ^ Bertelsen, Søren (2009). “Organokatalyse – nach dem Goldrausch”. Bewertungen der Chemical Society. 38 (8): 2178–89. doi:10.1039 / b903816g. PMID 19623342.
- ^ Gaunt, MJ; Johansson, CCC; McNally, A.; Vo, NT (2007). “Enantioselektive Organokatalyse”. Drug Discovery Today. 12 (1–2): 8–27. doi:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ Kucherenko, AS; Siyutkin, DE; Maltsev, OV; Kochetkov, SV; Zlotin, SG (2013). “Asymmetrische Organokatalyse: Von Prolin zu hocheffizienten immobilisierten Organokatalysatoren”. Russisches chemisches Bulletin. 61 (7): 1313. doi:10.1007 / s11172-012-0177-4. S2CID 93168492.
- ^ Gérald Lelais; David WC MacMillan (2006). “Moderne Strategien in der organischen Katalyse: Das Aufkommen und die Entwicklung der Iminiumaktivierung” (PDF). Aldrichimica Acta. 39 (3): 79.
- ^ Erkkilä, Anniinä; Majander, Inkeri; Pihko, Petri M. (2007). “Iminiumkatalyse”. Chem. Rev.. 107 (12): 5416–5470. doi:10.1021 / cr068388p. PMID 18072802.
- ^ Nis Halland; Tore Hansen; Karl Anker Jørgensen (2003). “Organokatalytische asymmetrische Michael-Reaktion von cyclischen 1,3-Dicarbonylverbindungen und α, β-ungesättigten Ketonen – eine hochatomökonomische katalytische einstufige Bildung eines optisch aktiven Warfarin-Antikoagulans”. Angew. Chem. Int. Ed. 42 (40): 4955–4957. doi:10.1002 / anie.200352136. PMID 14579449.
- ^ Sandra Lee; David WC MacMillan (2007). “Organokatalytische Vinyl- und Friedel-Crafts-Alkylierungen mit Trifluorboratsalzen” (PDF). Marmelade. Chem. Soc. 129 (50): 15438–15439. doi:10.1021 / ja0767480. PMID 18031044.
- ^ Madarász, Ádám; Dósa, Zsolt; Varga, Szilárd; Soós, Tibor; Csámpai, Antal; Pápai, Imre (Juli 2016). “Thioharnstoffderivate als Brønsted-Säure-Organokatalysatoren” (PDF). ACS-Katalyse. 6 (7): 4379–4387. doi:10.1021 / acscatal.6b00618.

Recent Comments