UV/vis-Spectospocy-wikipedia
UV/visスペクトルスコープ は、光学的分光法の分光プロセスであり、紫外線(UV)の電磁波(UV)と可視性( 英語 見える 、vis)光。メソッドも下回っています UV/Vis-Spektralphotometrie またはとして 電子吸収分光法 [初め] 知られています。日常生活では、使用されるデバイスはしばしば不正確です 光度計 専用。

UV/visスペクトル鏡検査は、サンプルを介して可視光と紫外線の絶滅の測定に基づいています。スペクトル、つまりH.波の長さに依存して、情報は、サンプルの前の入射光の波長を選択してスキャンするか(下記の2ジェット分光計を参照)、サンプルに応じて透過光の波長を分離することによって取得できます(下記のディオデナレイ分光計を参照)。送信された光と入射光のスペクトル強度の比は、透過スペクトルを提供します。伝送の対数往復は、絶滅スペクトルになります。
基本的に、絶滅は、吸収、広がり、屈曲、およびテストでの反射に関する情報を提供します。多くの原子と分子における外部電子条件の遷移エネルギーの可視および紫外線の光子エネルギーは、紫外線/視覚鏡検査でしばしば評価されます。可視および紫外線スペクトル範囲内の光子を吸収することにより、価電子(たとえばPおよびD軌道の電子)をより高いエネルギーの状態に刺激することができます。したがって、伝送または絶滅スペクトルにより、分析物の識別と定量的決定が可能になります。
たとえば、占有(HOMO)から空いているより高い軌道(LUMO)に電子を上げるには、吸収された光子のエネルギーは、2つのエネルギーレベルのエネルギー差に正確に対応する必要があります。コンテキストについて
吸収された光の波長は、使用するエネルギーのために計算できます。
エネルギー、
プランクの行動の量、
光の速度、
頻度と
電磁波の波長。この接続は、アインシュタインドリル方程式と呼ばれることがあります。 [2] この接続は、カスタマイズされたサイズ方程式の形で簡単に表示できます。
UVエリアでのみ生地(
<400 nm)吸収、人間の目は無色に見えます。ファブリックは、可視スペクトルの領域の放射を吸収するときに色と呼ばれます。これは、興奮エネルギーが低い接続の場合に予想されます(π対π * -exit、ポリエンなどの共役π電子システム)、および不完全に満たされた電子レベルの無機イオン複合体(例:Cu 2+ – 無色のCuと比較した接続(ほとんど青みがかった – 緑) + – リンク)。接続は、隣接する粒子間で強く偏光の相互作用がある場合にも色付けされているように見えます。 Bは黄色のAGIの場合です。 1つの吸収領域のみの場合、目は吸収された放射線の相補色を認識します。 [3]

光源は、約200 nmから1100 nmの波長範囲の紫外線、目に見える透過性の近くの光線を放射します。モノクロメーターでは、測定用に選択された波長が最初に選択され、ライトビームがセクターレベルに収まります。セクターレベルは、測定ソリューションと比較ソリューションを介して交互に光をドロップします。両方のソリューションは、SO -Called Kitchenにあります。 2つの光線が検出器で受信され、アンプの強度が比較されます。次に、アンプは、測定溶液からの光ビームの強度の開口部を挿入することにより、比較溶液からの光ビームの強度を調整します。この動きは、作家またはデータ処理に渡された測定値に転送されます。

KüvettenフリーのUV/Vis-Spectrometerは、高濃度のサンプルの少量の試験容量(2マイクロリットル未満)の濃度を決定するためにますます使用されています。 [4] [5] [6] そのため、0.04 mmから2 mmの面積の層の厚さで動作します。キッチンも希釈せず、わずか0.3 µL(最小層の厚さ)の体積でサンプルを分析できますが、低層の厚さのために高い検出限界を持っています。実証済みの技術は、サンプルの圧縮に基づいているため、表面張力とサンプルの蒸発に依存しません。この方法は、核酸(DNA、RNA、オリゴヌクレオチド)およびタンパク質(280 nmでのUV吸収)の分析に使用されます。ランバートビールの法則によると、吸収と層の厚さの間には関係があります。したがって、異なる層の厚さ(0.04 mm〜2 mm)の吸収値を計算できます。低層の厚さは、サンプルの仮想希釈のように機能しますが、それに応じてより高い濃度でのみ使用できます。したがって、サンプルの手動希釈には、しばしば分配されます。
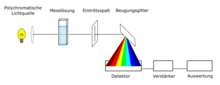

別のテクノロジーは、ダイオードアレイテクノロジーです [7] 。キッチンのサンプルには、光源の連続波長範囲(Xenon Flashライトランプ、190 nmから1100 nm)で構成される光ビームが照射されています。サンプルは、測定が発生した場合に、光源の異なる波長を吸収します。入り口の隙間に吸収されず、波長の後にお辞儀をするという平らに分割されます。スペクトルは、CCDセンサーを使用して検出され、評価されます。非自動デバイスの場合、参照テストをさらに測定する必要があります。分光計に移動可能な成分がなく、デバイスをコンパクトに構築できるため、UV/VISスペクトル全体を測定、低メンテナンスの取り組みで吸収できるため、テクノロジーの利点は短い測定時間です。
π対πは有用です * – 不飽和炭化水素の拡大(例:アルケン)。
それらは長い波の紫外線で行われ、簡単に測定できます。
分子の吸収波長、構造と色に関する情報が得られます。共役二重結合の数が長くなるほど、長い波エリアで発生します。 [8] πからπのエネルギーです * – 目に見える光の領域では、分子が色で表示されます。それは常に吸収された光の補完的な色を引き受けます。
検討中の電子遷移については、以下の選択ルールを常に遵守する必要があります(ラポートルールを含む)。
- スピンルール:合計ピンを保存する必要があります
- 異なるスピンの多様性間の遷移は禁止されています。分子の総ピンが変化しない場合にのみ提案が許可されます。つまり、提案の前後に同じ数のペアの電子と未払いの電子(スピン)が存在する場合です。
- 同じパリティの移行の禁止(ラポート禁止)
リガンデンフィールド理論によれば、ラポート禁止のために2つのクエリを作成する必要があります。
- 分子には反転中心がありますか?もしそうなら(例:八面体)、最初は提案は許可されていません。 NO(四面体など)の場合、提案は許可されます。
- 軌道のパリティ(サイン)は変わりますか?もしそうなら、提案は許可されます(例:S→P軌道からの遷移)。そうでない場合は、提案は許可されません(例:p→f-眼窩からの遷移)。したがって、遷移はまっすぐから奇数または奇数にのみ行われる場合があります(SおよびD軌道、PおよびF軌道は奇数です。
bsp。:
- 遷移3S→4Sは禁止されています
- 遷移3S→4Pが許可されています
注意:禁止されていることは、これらの遷移が発生しないという意味ではありません!複合体の弱い色は、金属中心に比べてリガンドの振動を作成します。これにより、ラポート禁止にとって重要な反転対称性が一時的にキャンセルされ、移行が行われます。
- ↑ ManfredReichenbächer、JürgenPopp: 有機および無機化合物の構造分析:練習帳 。 Springer Science&Business Media、2007、ISBN 978-3-8351-0190-6、 S. 119 ( 限られたプレビュー Google Book検索で)。
- ↑ クリストファーG.モリス、アカデミックプレス: 科学技術のアカデミックプレス辞書 。ガルフプロフェッショナルパブリッシング、1992年、ISBN 0-12-200400-0、 S. 716 ( 限られたプレビュー Google Book検索で)。
- ↑ 著者の交差点、フェデファーズ著者:K。ダーニーズ、R。グレイヤー: 分析 – 分析化学とその理論的基礎の方法 。 8.エディション。基本的な材料産業のためのVeb Deutscher Verlag、ライプツィヒ1990、ISBN 3-342-00191-7、 S. 259 ff 。
- ↑ H. Stranneheim、J。Lundeberg: DNAシーケンスの踏み石。 の: Biotechnology Journal。 バンド7、ナンバー9、2012年9月、 ISSN 1860-7314 、S。1063–1073、 2:10.1002/biot.201200153 、 PMID 22887891 、 PMC 3472021 (無料の全文)。
- ↑ P. Och the Mygle、C。Come、M。Malva、D。M。M. M’la: 動物細胞の懸濁液培養の生存率低下を迅速に決定するためのナノドロップベースの方法。 の: 分析生化学。 バンド430、ナンバー2、2012年11月、 ISSN 1096-0309 、S。138–140、 doi:10.1016/j.ab.2012.08.028 、 PMID 22960013 。
- ↑ M. T. Kelliher、M。S。Piraino、M。E。Gemoules、C。A。Southern: ナノドロップ蛍光測定のためのフェルスター共鳴エネルギー伝達分析アプローチの比較。 の: 分析生化学。 バンド441、ナンバー1、2013年10月、 ISSN 1096-0309 、S。44–50、 doi:10.1016/j.ab.2013.06.009 、 PMID 23811157 。
- ↑ トニー・オーウェン: 現代の紫外線分光法の基礎:プライマー 。 1996、OCLC 918510068 。
- ↑ ジョセフ・B・ランバート、スコット・グロナート、ハーバート・F・シャーベル、デビッド・A・ライトナー: 分光法 – 有機化学の構造教育 第2版、ピアソンドイツ、ミュンヘン2012、ISBN 978-3-86894-146-3、pp。591–653。

 エネルギー、
エネルギー、  プランクの行動の量、
プランクの行動の量、  光の速度、
光の速度、  頻度と
頻度と  電磁波の波長。この接続は、アインシュタインドリル方程式と呼ばれることがあります。 [2] この接続は、カスタマイズされたサイズ方程式の形で簡単に表示できます。
電磁波の波長。この接続は、アインシュタインドリル方程式と呼ばれることがあります。 [2] この接続は、カスタマイズされたサイズ方程式の形で簡単に表示できます。 
 <400 nm)吸収、人間の目は無色に見えます。ファブリックは、可視スペクトルの領域の放射を吸収するときに色と呼ばれます。これは、興奮エネルギーが低い接続の場合に予想されます(π対π * -exit、ポリエンなどの共役π電子システム)、および不完全に満たされた電子レベルの無機イオン複合体(例:Cu 2+ – 無色のCuと比較した接続(ほとんど青みがかった – 緑) + – リンク)。接続は、隣接する粒子間で強く偏光の相互作用がある場合にも色付けされているように見えます。 Bは黄色のAGIの場合です。 1つの吸収領域のみの場合、目は吸収された放射線の相補色を認識します。 [3]
<400 nm)吸収、人間の目は無色に見えます。ファブリックは、可視スペクトルの領域の放射を吸収するときに色と呼ばれます。これは、興奮エネルギーが低い接続の場合に予想されます(π対π * -exit、ポリエンなどの共役π電子システム)、および不完全に満たされた電子レベルの無機イオン複合体(例:Cu 2+ – 無色のCuと比較した接続(ほとんど青みがかった – 緑) + – リンク)。接続は、隣接する粒子間で強く偏光の相互作用がある場合にも色付けされているように見えます。 Bは黄色のAGIの場合です。 1つの吸収領域のみの場合、目は吸収された放射線の相補色を認識します。 [3]
Recent Comments