ディボラン – ウィキペディア
| 構造式 | |
|---|---|
 |
|
| 全般的 | |
| 名前 | ディボラン |
| 他の名前 | |
| マッシュフォーミュラ | b 2 h 6 |
| 簡単な説明 |
反発的な甘い匂いのない無色のガス [初め] |
| 外部識別子/データベース | |
| 特性 | |
| モル質量 | 27.67 g・mol -1 |
| 総状態 |
気体 |
| 密度 |
1,17 kg・m -3 (15°C、1バー) [初め] |
| 融点 |
-164,85°C [初め] |
| 沸点 |
-92,5°C [初め] |
| 蒸気圧 |
2,8 MPa(0°C) [初め] |
| 安全についての案内 | |
| 夫人 |
スイス:0.1 ml・m -3 または0.1 mg・m -3 [2] |
| 熱力学的特性 | |
| ΔH f 0 |
36.4 kj / times [3] |
| 可能な限り一般的に、SIユニットが使用されます。特に明記しない限り、提供されたデータは標準条件に適用されます。 | |
ディボラン 要素ホウ素と水素からの化学的接続です。合計式bがあります 2 h 6 ホウ素水素化合物(ボラン)の生地クラスからの最も単純な接続です。
ジボランは、金属ホウ素の加水分解により19世紀に初めて合成されましたが、詳細には検査されませんでした。 1912年から1936年まで、ボロヒドイドアルフレッドストックの化学の偉大な先駆者は、これらの化合物を研究し、非常に反応性があり、揮発性があり、しばしば毒性のあるボリドリドの合成と取り扱いの方法をもたらしました。彼は最初にイーサンに似たディボランの構造を提案しました。 [4] S.H.による試行後の電子光線の曲がりバウアーは彼によって提案された構造を支持した。 [5] [6]
H. I. SchlesingerとL. Pauling(エタン構造も受け入れた)とのコミュニケーションでは、1940年代初頭の古典的なレビューの3センターの絆は明示的に議論されていませんでした。 [7] ただし、レビューではチェックについて説明しました 2V – 深く構造:「この仮定がジボランの多くの化学的特性を簡単に説明していることがわかります…」。
1943年、学士号の学生は、オックスフォードクリストファーロングエットヒギンズのR. P. P.ベルと今日ディボランの構造を発表しました。 [8] しかし、これは1921年に当時のソビエト連邦ですでに説明されていました。 [9] [十] [11] Longuet-Higgins/Bellの提案の数年後、適切な構造について広範な議論がありました。議論は、1951年にK. HedbergとV. Schomakerによるエレクトロン屈曲測定で終了しました。これは、これまで認識されていたディボランの構造を確認しました。 [12番目]
ウィリアム・ヌン・リップスコム・ジュニア彼は後に、炭水化物の構造を含む同様の問題に同じ方法を使用しました。 Lipscombは、1976年に彼の努力のために化学のノーベル賞を受賞しました。
ディボランは自然に発生しません。
ディボランの生産にはいくつかのオプションがあります。 [13]
水素化リチウムとホウモリの反応:
テトラヒドロアルミネートリチウムとホウモリとジエチルエーテルへの反応:
ボラン酸ナトリウムとボルトリフルオリドとジエチルエングリコルディメチエーテルへの反応: [14]
- [15]
- [16] :
- [16] :
技術制作 [ 編集 | ソーステキストを編集します ]
ボランは技術的にはジボルトリオキシドの水素化を通じて技術的には 2 o 3 )150°Cを超え、750 barの水素圧力で還元剤として金属アルミニウムと塩化アルミニウムで作られています。
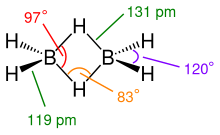
構造 [ 編集 | ソーステキストを編集します ]
モノメアボラン以来、ディボランはボランの生地クラスからの最も簡単な接続です(ブラジャー 3 )安定しておらず、メタスト可能な付加物はディボランです。ボーカーは、4つの水素核に囲まれたテトラ編集です。 2つの粉砕水素核は、ボーカーの電子の不足を補うために2電子-3中心結合を形成します。 2つの電子は、3つの原子に分布した軌道に配置されています。

物理的特性 [ 編集 | ソーステキストを編集します ]
ディボランは、刺すような甘い、嫌な匂いを備えた無色の、可燃性、非常に有毒なガスです。これは、標準条件での交換可能な接続です。接続の融点は-164.9°C、-92.6°Cでの通常の圧力下の沸点です。 [14] 沸点での蒸発エンタルピーは14.2 kJ・molです -1 。 [17] それに応じて、彼はアントワーヌに応じて蒸気圧力機能をもたらします 十 (p)= a – (b/(t+c))(bar in bar、t in k)a = 3,78156、b = 598.39およびc = −22.175の温度範囲は118.3から180.8 kの範囲です。 [18]
化学的特性 [ 編集 | ソーステキストを編集します ]
50°Cを超えると、水素と高温のボラン(テトラボラン、ペンタボラン、ヘキサボラン、デカボランなど)への分解は50°Cを超えて始まります。純粋なディボランのリネン温度は145°Cです。より高いボランの痕跡が含まれている場合、それは自発的に空気で発火し、強い熱発達の下で燃焼する可能性があります。
実際には、約45°Cで点火します。 0.8〜88%の空気量含有量で、爆発的な混合物を形成します。したがって、ガスは慎重に処理できるため、通常はアミンを残します(
)ボラザン反応などのアミノボラン複合体へ。 [19]
ディボランは、水に緩むとこれに反応します。実験室の規模では、ディグリムス中のヨウ素とヨウ素の酸化によりディボランを表すことができます。
ディボランのホウ素は、2つの橋の水素原子への2電子三角形結合により、電子が不足しています。その結果、ディボランは単一品質のルイス酸であり、モノメアボランに分割されたルイスベース(アンモニアとして)との協調的な結びつきと反応します。気体アンモニアでは、それに応じてボラザンBHが形成されます 3 NH 3 。 [20]
ジボラン塩には、モノボラン酸/テトラヒドロボラネート/テトラヒドロイドボラン酸イオンブラが含まれています 4 – モノボラン酸塩/テトラヒドロボラネートと呼ばれています。重要な代表者は、ジボランに水素化ナトリウムを実装することにより生成されたボラン酸ナトリウムです。
安全性 – 技術的パラメーター [ 編集 | ソーステキストを編集します ]
ディボランは、点火源なしで0.5 vol。%の濃度から空気中を自然発生させることができます。 [14] 爆発範囲は、爆発制限が低い(UEG)と98 Vol。として0.9 vol。%です。 [21] [22] 酸素濃度は1.3%です。 [22] 10%のディボランを含む混合物の爆発圧は11バーです。 [22] 78〜98%の濃度範囲の空気との混合物は、爆発することができます。 [14]
ディボランは水植生のための最も重要な試薬であり、それによりアルケン(r remnant)がB-H結合を介してトライアルキルボランに接続されています。
この反応は局所的であり、結果として得られるトライアルキルボレーンは、他の有用な有機誘導体に簡単に変換できます。
ディボランは、たとえば、リチウムアルミニウム水素化物の反応性の補足として、還元剤としても使用されます。この接続は、カルボン酸を対応するアルコールに容易に減らします。また、ロケット燃料とも見なされていましたが、燃焼のエンジンをブロックするホウモリを形成するため、完全に不適切であることが判明しました。ディボランは、ゴム製イブラン化に引き続き使用されています。 BOR化合物は、一般に、炭化水素の重合または抗マルコウニコウ製品の製造における触媒として使用されます。
ディボランの吸入は、咳、喉の痛み、めまい、呼吸困難、吐き気、疲労につながります。それは非常に毒性があり、炎症性です。
- ↑ a b c d そうです f g へのエントリ ディボラン 2021年1月8日にアクセスしたIFAのGestisファブリックデータベース。 (JavaScriptが必要)
- ↑ スイス事故保険機関(SUVA): 値を制限 – 現在のMAKおよびBAT値 (検索する 19287-45-7-7 また。 ディボラン )、2015年11月2日アクセス。
- ↑ W. M.ヘインズ(hrsg。): CRC化学と物理学ハンドブック 。 97. auflage。 (インターネットバージョン:2016)、CRC Press/ Taylor and Francis、Boca Raton FL、 化学物質の標準的な熱力学的特性 、S。5-13。
- ↑ A.ストック: ホウ素とシリコンの水素化物 。コーネル大学出版局、ニューヨーク1933年。
- ↑ S. H.バウアー: ジボランの構造 。の: Journal of the American Chemical Society 。 バンド 59 、1937年、 S. 1096 、doi: 10.1021/JA01285A041 。
- ↑ S. H.バウアー: ホウ素とその誘導体の水素化物の構造と物理的特性 。の: 化学レビュー 。 バンド 最初に30 、1942年、 S. 43–75 、doi: 10.1021/CR60098A001 。
- ↑ H. I.シュレシンガー、A。B。バーグ: ホウ素水素化物の化学における最近の発展 。の: 化学レビュー 。 バンド 最初に30 、1942年、 S. 1–41 、doi: 10.1039/jr9430000250 。
- ↑ H. C. Longuet-Higgins、R。P。Bell: ホウ素水素化物の構造 。の: 化学協会のジャーナル 。 1943年、 S. 250–255 、doi: 10.1039/jr9430000250 。
- ↑ W.ディルテイ: 固体ガス供給を備えたロータリーバーナー 。の: 応用化学のための雑誌 。 バンド 34 、1921年、 S. 594 、doi: 10.1002/ange.19210349504 。
- ↑ B. V.ネクラソフ: J Gen Chem SOSSR 。 バンド 十 、1940年、 S. 1021 。
- ↑ B. V.ネクラソフ: J Gen Chem SOSSR 。 バンド 十 、1940年、 S. 1056 。
- ↑ K. Hedberg、V。Schomaker: 電子回折によるジボランとエタンの構造の再調査 。の: Journal of the American Chemical Society 。 バンド 七十三 、1951年、 S. 1482–1487 、doi: 10.1021/JA01148A022 。
- ↑ F. A.コットン、G。ウィルキンソン: 無機化学:高度な要約表現。 以上。 v。ハインツP.フリッツ。 4番目、完全に新しい。版。最初の再版。 VCH、Weinheim 1985。
- ↑ a b c d R.J.ブラザートン、C.J。ウェーバー、C.R。ギバート、J.L。リトル: ホウ素化合物 、 の: ウルマンの技術化学百科事典 、Wiley-VCH Verlag GmbH&Co。Kgaa、Weinheim 2012; doi: 10.1002/14356007.A04_309 。
- ↑ A. S. B. Prasad、J。V。B. Kanth、M。Periasamy: 四面体。 1992、48、S。4623–4628。
- ↑ アーランD.ノーマンとウィリアムL.ジョリー: ディボラン 。 In:William L. Jolly(hrsg。): 無機合成 。 バンド 11 。 McGraw-Hill Book Company、Inc.、1968、 S. 15–19 (英語)。
- ↑ パリドン、レオJ。;マクウッド、ジョージE。; Hu、jih-heng: ジボランの蒸発の熱 J. Phys。化学。 53(1959)1998–1999、doi: 10.1021/J150582A004 。
- ↑ Ditter、J.F。; Perrine、J.C。;シャピロ、イサドール: デュテロジボランの蒸気圧 J. Chem。 Eng。データ6(1961)271-271、doi: 10.1021/JE60010A026 。
- ↑ ジェームズアーサーキャンベル: 一般化学:化学システムのエネルギー、ダイナミクス、構造。 2番目、エディションを通じて。 Verlag Chemie(VCH)、Weinheim 1985。
- ↑ A. F.ホレマン、E。ウィバーグ、N。ウィバーグ: 無機化学の教科書。 102.エディション。 Walter de Gruyter、Berlin 2007、ISBN 978-3-11-017770-1、p。1066。
- ↑ 爆発保護における安全制御のためのChem Safeデータベース、PTB Braunschweig/Bam Berlin、2022年10月2日アクセス。
- ↑ a b c S. Horiguchi; K. Tokuhashi; Y. Urano; M. Iwasaka; H. Ohtani; S. Kondo: Koatsu Gasu 25 (1988) 863-869.
![mathrm{6 LiH + 8 BF_3 rightleftharpoons 6 Li[BF_4] + B_2H_6}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c91c9fcb9a12fe5af77b0b149f10bd89c4027da)
![mathrm{3 Li[AlH_4] + 4 BCl_3 rightleftharpoons 3 Li[AlCl_4] + 2 B_2H_6}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98f9563bf7a712573f1cbb04f54198062c828d72)
 [15]
[15]
 [16] :
[16] :



 )ボラザン反応などのアミノボラン複合体へ。 [19]
)ボラザン反応などのアミノボラン複合体へ。 [19] 




Recent Comments