L-Lactatdehydrogenase – ウィキペディア
l -Lactatdehydrogenase または短い ラクタトデヒドロゲナーゼ ( LDH )の形成が酵素です l -LactatとNad + PyruvatとNadhから触媒。反応は可逆的です。 LDHは、ほとんどすべての生物のすべての細胞で発生します。乳酸発酵の一部です。高等動物では、LDHは細胞から引退しました。これも、大きな安定性のために溶血性と血液です。そこで、細胞の損傷を示す実験室パラメーターとして使用できます。非常に似ています d -Lactatdehydrogenase 下部動物、微生物、植物でのみ発生します。 [初め]

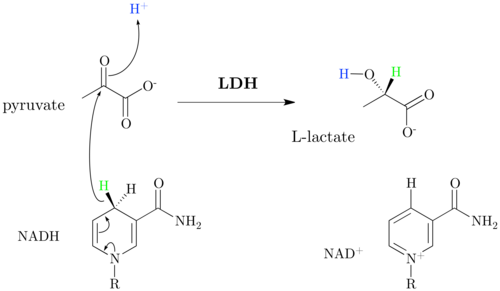
LDHおよび補因子NADHによる乳酸へのピルバットの還元は、酸素消費なしでグルコースからのエネルギーが得られる乳酸発酵の特徴です。乳酸形成はNADにつながります + GAPDHの解糖で必要な再生。乳酸自体は発酵プロセスでは使用できず、細胞によって血液または細胞への細胞に渡されます。人間と高等動物では、乳酸が血流を介して肝臓に輸送されます。 NADの存在下で実行されます + 反対の反応。乳酸はピルバット用に酸化されるため、代謝に再びアクセスできます。反応は、nadの場合、一部の筋肉組織でも流れます + 利用可能です。
PyruvatからLactatへの削減は強力なエクセルゴンです(ΔG 0 ‘= -25 kj / times)。
LDHのさまざまなアイソザイムは、人体に見られます。 LDHは常に4つのサブユニットで構成されています。
クラシックは、サブユニットLDH-Hおよび/またはLDH-Mから構築される5つのフォームLDH-1からLDH-5です。これら2つのタイプの組成の種類に応じて、5つの可能な組み合わせがあります。以下では、それぞれの臓器で支配的なイソ酵素が示されています。
- LDH-1(4H) – 心臓、赤血球、腎臓で
- LDH-2(3H1M) – 赤血球、腎臓、心臓、肺
- LDH-3(2H2M) – 肺、血小板、リンパ系の細胞で
- LDH-4(1H3M) – 異なる臓器で
- LDH-5(4M) – 肝臓とクロス拘束された筋肉の中
他のLDH等酵素も言及された臓器で発生することに注意する必要があります。LDH-2(およびTraces LDH-3)も心臓に見られることがあります。 LDH-1は主要な形状です。
1950年代の古典的なLDHサブユニットの識別以来、さらにLDH等酵素が発見されており、これもテトラマーとして入手できます。
LDHCは1960年代に発見されました。これは主にLDHCサブユニットから構築されており、test丸でのみ表現されています。
LDHBXは2010年代に発見されました。 LDHBXは、ペルオキシソーマ固有のサブユニットです。 LDHBXはLDHB mRNAの翻訳中に作成されますが、ストップコドンはアミノ酸をコードするコドンとして解釈されます。したがって、翻訳は次のStopCodonに続きます。これは、LDHBXが古典的なLDH-H(LDHB)タンパク質よりも長い7つのアミノ酸であることを意味します。結果の拡張には、ペルオキシソームシグナルシーケンスが含まれているため、LDHBXがペルオキソーマにインポートされます。 [2]
ラクタトデヒドロゲナーゼ (LDH)は、細胞への損傷の増加を検出する診断パラメーターとして使用されます。 Lyse細胞は酵素を放出します。安定性が大きいため、LDHは細胞外室に残り、病理学的細胞損傷の血液中に囲まれています。 ITまたは血漿/血清では、LDH活性が測定されます。生理学的条件下では、LDHの血清活性は最大240 U/Lです。この値を超えて増加すると、これは細胞の減衰の増加によるものです。 LDH等酵素の測定に基づいて、どの臓器が酵素の増加の起源に起因するかを理解できることも理解できます。 LDHのすべてのアイソフォームは、血清内で実証でき、LDH -1および-2が優勢です。 LDH-1およびLDH-2の増加は、心筋細胞または血液細胞の細胞死の増加を示す可能性がありますが、LDH-5の増加は肝臓の損傷があることを示唆します。最終的に、診断はいくつかの調査結果の要約でのみ行うことができます。
特に、血液疾患、筋肉疾患、および肝臓および胆道疾患の場合、Labordignostic LDH検査は、発生した損傷に関する情報を提供できます。過去には、LDHの活性も心筋疾患で決定されましたが、これは新しい測定変数(心臓トロポニン)のおかげで絶対に必要ではなくなりました。しかし、T。はまだ実行されています。特に、もはや新鮮ではない心臓発作の証拠に関しては。他の心筋特異的壊死性市場または酵素星座と比較して、LDH-1およびLDH-2は比較的長いままです。発生した細胞損傷は、最大20日後も実証できます。
参照エリア [ 編集 | ソーステキストを編集します ]
IFCCCに従って、37°Cでの測定の参照範囲 [3]
解釈 [ 編集 | ソーステキストを編集します ]
LDHはすべての組織で発生するため、組織の損傷が発生した値を増やして声明のみを作成できます。
値の増加は、次の疾患に関連して最も一般的です。 [4]
- 消化管の(例:胆嚢または十二指腸の障害による後毛皮のイクテルス)、
- 肝臓(肝障害、例:肝細胞のイクテルス)、
- 心臓(心筋症)、
- 骨格筋(筋炎など)
- 肺(血管障害、肺塞栓症)、
- 腎臓(腎症、例:腎臓梗塞)、
- 血液(貧血、例えば溶血)、
- ホルモン系(内分泌障害、例えば甲状腺機能低下症または甲状腺炎)、
- 系疾患(癌、またはサルコイドーシス、コネクティティ炎または単核球症など)。
拡張値は、以前の放射線療法に関連して見つけることができます。
LDHのユビキタリアスが発生しているため、この酵素とそのアイソフォームは有機的に特異的ではないため、診断の地形ガイドシムとしては機能しません。
原因 [ 編集 | ソーステキストを編集します ]
LDHは、赤血球(赤血球)で大量に利用できます。したがって、溶血サンプルは、この溶血も誤って検査結果をもたらす可能性があります。 試験管内で 誤ったストレージ、誤った減少、またはサンプルの長い輸送によって引き起こされる可能性があります。
生物科学および薬理学では、細胞外LDHは、毒物学的検査などで発生した細胞損傷のマーカーとして使用されます。培地でリリースされたLDHは、とりわけ、ホルマザン染料への反応によって実証できます。
- B. Neumeister、I。Besenthal、H。Liebich、O。Böhm: 実験室診断クリニックガイド。 アーバン&フィッシャー、ミュンヘン/イエナ2003、ISBN 3-437-22231-7。
- Lothar Thomas: 実験室と診断。 Th-Books、Frankfurt Am Main 2005、ISBN 3-9805215-5-9。
- ↑ ブレンダ – EC 1.1.1.28に関する情報 – D乳酸デヒドロゲナーゼ 。
- ↑ F. Schueren、T。Lingner、R。George、J。Hofhuis、J。Gartner、S。Thoms: ペルオキシソーム乳酸デヒドロゲナーゼは、哺乳類のトランスレーショナルリードスルーによって生成されます 。の: エリーフ 。 バンド 3 、2014年、 S. E03640 、doi: 10.7554/Elife.03640 、 PMID 25247702 。
- ↑ IFCC
- ↑ フィリップ・ファーガー: 「労働迅速」 – A -Z、鑑別診断、実験室医学からの実験室の価値と検査所見。 第2版。 Thieme 2014、ISBN 978-3-147522-0、p。87。
Recent Comments