
Trong hóa học hữu cơ, nhóm carbonyl là một nhóm chức gồm một nguyên tử carbon liên kết đôi với một nguyên tử oxy: C = O . Nó là phổ biến cho một số loại hợp chất hữu cơ, như là một phần của nhiều nhóm chức lớn hơn. Một hợp chất chứa một nhóm carbonyl thường được gọi là một hợp chất carbonyl.
Thuật ngữ carbonyl cũng có thể gọi carbon monoxide như một phối tử trong phức hợp vô cơ hoặc organometallic (một carbonyl kim loại, ví dụ niken carbonyl).
Phần còn lại của bài viết này liên quan đến định nghĩa hóa học hữu cơ của carbonyl, trong đó carbon và oxy có chung một liên kết đôi.
Các hợp chất cacbonyl [ chỉnh sửa ]
Một nhóm carbonyl đặc trưng cho các loại hợp chất sau:
Lưu ý rằng các nhãn cụ thể nhất thường được sử dụng. Ví dụ, cấu trúc R (CO) O (CO) R 'được gọi là anhydrid axit chứ không phải là este chung hơn, mặc dù có họa tiết este.

Các carbonyl hữu cơ khác là urê và carbamate, dẫn xuất của acyl clorua cloroformat và phosgene, este carbonate, thioesters, lactones, lactam, hydroxamate và isocyanate. Ví dụ về các hợp chất carbonyl vô cơ là carbon dioxide và carbonyl sulfide.
Một nhóm các hợp chất carbonyl đặc biệt là Các hợp chất 1,3-dicarbonyl có các proton axit trong đơn vị methylene trung tâm. Ví dụ như axit Meldrum, diethyl malonate và acetylacetone.
Tính phản ứng [ chỉnh sửa ]
Hóa học cộng hưởng carbonyl [ chỉnh sửa ]
Bởi vì oxy có độ âm điện cao hơn so với carbon cấu trúc có ảnh hưởng đến phản ứng của họ. Độ âm điện tương đối này rút mật độ electron ra khỏi carbon, làm tăng tính phân cực của liên kết, do đó làm cho carbon trở thành một điện di (tức là hơi dương). Carbon sau đó có thể bị tấn công bởi các nucleophile (ví dụ: các ion tích điện âm, như ion xyanua) hoặc một phần mang điện tích âm của một phân tử khác (ví dụ, các cặp electron đơn độc của nitơ trong phân tử amoniac). Trong quá trình phản ứng, liên kết đôi carbon-oxy bị phá vỡ, và nhóm carbonyl có thể gặp phản ứng bổ sung. Phản ứng này được gọi là loại bỏ bổ sung (vì một phân tử nước thường bị mất) hoặc ngưng tụ. [1] Oxy điện từ cũng có thể phản ứng với một điện di; ví dụ một proton trong dung dịch axit hoặc với axit Lewis để tạo thành ion oxocarbenium.

Tính phân cực của oxy cũng làm cho alpha hydrogens của các hợp chất carbonyl có tính axit cao hơn (khoảng 10 30 nhiều axit hơn so với sp điển hình 3 , chẳng hạn như những người trong mêtan. Ví dụ: giá trị pK a của acetaldehyd và acetone lần lượt là 16,7 và 19, [2] trong khi giá trị của pK của metan được ngoại suy là xấp xỉ 50. [3] là bởi vì một carbonyl là cộng hưởng tautomeric với một enol. Sự khử hóa của enol với một bazơ mạnh tạo ra một enolate, đó là một nucleophile mạnh và có thể kiềm hóa các điện di như các carbonyl khác.
Amit là chất ổn định nhất trong các khớp nối carbonyl do sự ổn định cộng hưởng cao giữa các liên kết nitơ-carbon và carbon-oxy.
Giảm cacbonyl [ chỉnh sửa ]
Các nhóm carbonyl có thể bị giảm do phản ứng với thuốc thử hydride như NaBH 4 và LiAlH 4 với men của thợ làm bánh, hoặc bằng quá trình hydro hóa xúc tác. Ketone cho rượu bậc hai trong khi aldehyd, este và axit cacboxylic cho rượu nguyên chất.
Phản ứng cacbonyl hóa [ chỉnh sửa ]
Carbonyl có thể được kiềm hóa trong các phản ứng cộng nucleophin bằng các hợp chất organometallic như thuốc thử organolithium, thuốc thử Grignard, hoặc thuốc thử acetyl. Carbonyl cũng có thể bị kiềm hóa bởi enolate như trong các phản ứng aldol. Carbonyl cũng là nhóm nguyên mẫu có phản ứng vinylogous (ví dụ: phản ứng Michael trong đó carbon không bão hòa trong liên hợp với carbonyl được kiềm hóa thay vì chính carbonyl).
Tính chất hóa học carbonyl [ chỉnh sửa ]
Trong trường hợp có nhiều loại carbonyl trong một phân tử, người ta có thể mong đợi carbon carbon điện nhất sẽ phản ứng trước. Acyl clorua và carboxylic anhydrides phản ứng nhanh nhất, tiếp theo là aldehyd và ketone. Este phản ứng chậm hơn nhiều và amit gần như hoàn toàn không hợp lý do sự cộng hưởng của nitơ amide đối với nhóm carbonyl. Sự khác biệt về độ phản ứng này cho phép tính chất hóa học khi một chất phản ứng có chứa nhiều nhóm carbonyl. Một ví dụ hướng dẫn được tìm thấy trong phần cuối cùng của tổng hợp monensin bởi Kishi năm 1979: [4]

Chất phản ứng tay trái có hai vị trí điện di tiềm năng: một aldehyd (chỉ màu xanh lam) và este (chỉ màu xanh lá cây). Chỉ có aldehyd, là chất điện di hơn, sẽ phản ứng với enolate của methyl ketone trong phần khác của phân tử. Các este methyl vẫn còn nguyên. Tất nhiên, các hiệu ứng khác có thể đóng một vai trò trong quá trình chọn lọc này, bao gồm các hiệu ứng điện tử, hiệu ứng không gian và điều khiển phản ứng nhiệt động so với động học.
Phản ứng đặc biệt của Carbonyl [ chỉnh sửa ]
Các phản ứng quan trọng khác bao gồm:
α, β-Các hợp chất cacbonyl không bão hòa [ chỉnh sửa ]
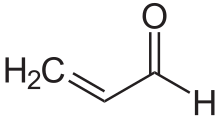
α,-chưa bão hòa của các hợp chất cacbonyl có cấu trúc chung (O = CR) −C α = C β -R; ví dụ enones và enals. Trong các hợp chất này, nhóm carbonyl được liên hợp với một anken (do đó tính từ không bão hòa ), từ đó chúng có được các tính chất đặc biệt. Không giống như trường hợp đối với các carbonyl đơn giản, các hợp chất carbonyl không bão hòa thường bị tấn công bởi các nucleophile tại β carbon. Mô hình phản ứng này được gọi là vinylogous. Ví dụ về carbonyl không bão hòa là acrolein (propenal), mesityl oxide, axit acrylic và axit maleic. Carbonyl không bão hòa có thể được điều chế trong phòng thí nghiệm trong phản ứng aldol và trong phản ứng Perkin.
Nhóm carbonyl hút các electron ra khỏi anken và do đó, nhóm kiềm bị khử hoạt tính đối với một điện di, như brom hoặc axit clohydric. Như một quy luật chung với các điện di không đối xứng, hydro tự gắn vào vị trí α trong một bổ sung điện di. Mặt khác, các hợp chất này được kích hoạt hướng tới nucleophile trong bổ sung liên hợp nucleophilic.
Vì các hợp chất không bão hòa là các điện di, nhiều hợp chất cacbonyl,-không bão hòa là độc hại, gây đột biến và gây ung thư. DNA có thể tấn công β carbon và do đó bị kiềm hóa. Tuy nhiên, hợp chất scavenger nội sinh glutathione tự nhiên bảo vệ khỏi các điện di độc hại trong cơ thể. Một số loại thuốc (amifostine, N -acetylcystein) có chứa các nhóm thiol có thể bảo vệ các phân tử sinh học khỏi sự kiềm hóa có hại như vậy.
Quang phổ [ chỉnh sửa ]
- Quang phổ hồng ngoại: liên kết đôi C = O hấp thụ ánh sáng hồng ngoại ở khoảng cách giữa khoảng 1600 16001919 −1 đến 6250nm). Vị trí chính xác của sự hấp thụ được hiểu rõ đối với hình dạng của phân tử. Sự hấp thụ này được gọi là "sự kéo dài carbonyl" khi được hiển thị trên phổ hấp thụ hồng ngoại. [5] Ngoài ra, quang phổ cực tím của propanone trong nước tạo ra sự hấp thụ carbonyl ở bước sóng 257nm. [6]
- Cộng hưởng từ hạt nhân: C = O liên kết đôi thể hiện các cộng hưởng khác nhau tùy thuộc vào các nguyên tử xung quanh, thường là sự dịch chuyển xuống phía dưới. 13 C NMR của carbon carbon nằm trong khoảng 160-220 ppm.
Xem thêm [ chỉnh sửa ]
Tài liệu tham khảo chỉnh sửa ]
- ^ "giới thiệu về aldehyd và ketone". www.oolguide.co.uk .
- ^ Ouellette, R.J. và Rawn, J.D. "Hóa học hữu cơ" 1st Ed. Prentice-Hall, Inc., 1996: New Jersey. ISBN 0-02-390171-3
- ^ Claden, Johnathan; et al. Hóa học hữu cơ . Nhà xuất bản Đại học Oxford. Sê-ri 980-0-19-850346-0.
- ^ Nicolaou, Kyriacos Costa; E. J. Sorensen (1996). Kinh điển trong tổng hợp: Mục tiêu, chiến lược, phương pháp . Wiley-VCH. tr 230 230 232. ISBN 3-527-29231-4.
- ^ Mayo D.W., Miller F.A và Hannah R.W Khóa học Ghi chú về việc giải thích hồng ngoại và Raman Spectra đấm 1st Ed. John Wiley & Sons Inc, 2004: New Jersey. ISBN 0-471-24823-1.
- ^ "Bản sao lưu trữ" (PDF) . Được lưu trữ từ bản gốc (PDF) vào ngày 2015-08-24 . Truy xuất 2015-07-11 . CS1 duy trì: Bản sao lưu trữ dưới dạng tiêu đề (liên kết)