
Microdialysis là một kỹ thuật lấy mẫu xâm lấn tối thiểu được sử dụng để đo liên tục nồng độ chất phân tích không liên kết trong dịch ngoại bào. Các phân tích có thể bao gồm các phân tử nội sinh (ví dụ: chất dẫn truyền thần kinh, hormone, glucose, v.v.) để đánh giá các chức năng sinh hóa của chúng trong cơ thể hoặc các hợp chất ngoại sinh (ví dụ: dược phẩm) để xác định sự phân phối của chúng trong cơ thể. Kỹ thuật vi lọc đòi hỏi phải đặt một ống thông tiểu vi lọc nhỏ (còn được gọi là đầu dò siêu nhỏ) vào mô quan tâm. Đầu dò siêu nhỏ được thiết kế để mô phỏng mao mạch máu và bao gồm một trục có màng sợi rỗng bán định hình ở đầu của nó, được nối với ống đầu vào và đầu ra. Đầu dò được liên tục tưới máu bằng dung dịch nước (perfusate) gần giống với thành phần (ion) của dịch mô xung quanh với tốc độ dòng chảy thấp khoảng 0,1-5μL / phút. [1] Sau khi đưa vào mô hoặc (cơ thể) chất lỏng quan tâm, các chất hòa tan nhỏ có thể đi qua màng bán kết bằng cách khuếch tán thụ động. Hướng của dòng phân tích được xác định bởi độ dốc nồng độ tương ứng và cho phép sử dụng các đầu dò vi phân làm mẫu cũng như các công cụ phân phối. [1] Giải pháp rời đầu dò (thẩm tách) được thu thập tại các khoảng thời gian nhất định để phân tích.
Lịch sử [ chỉnh sửa ]
Nguyên tắc vi lọc được áp dụng lần đầu tiên vào đầu những năm 1960, khi các công thức kéo đẩy [2] và túi lọc máu [3] được cấy vào mô động vật, đặc biệt là vào bộ não của loài gặm nhấm, để nghiên cứu trực tiếp sinh hóa của các mô. [1] Mặc dù các kỹ thuật này có một số nhược điểm thử nghiệm, chẳng hạn như số lượng mẫu trên mỗi động vật hoặc độ phân giải không giới hạn thời gian để khắc phục một số hạn chế này. [4] Cải thiện hơn nữa khái niệm dialytrode dẫn đến việc phát minh ra "sợi rỗng", một màng bán kết hình ống có đường kính ~ 200-300μm, vào năm 1974. [5] Hình dạng phổ biến nhất hiện nay , đầu dò kim, bao gồm một trục có một sợi rỗng ở đầu của nó và có thể được đưa vào bằng ống dẫn hướng vào não và các mô khác.
Đầu dò phân tích vi mô [ chỉnh sửa ]
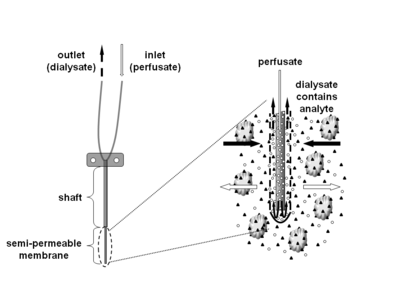
Có nhiều loại đầu dò khác nhau với các kết hợp màng và trục khác nhau. Mức cắt trọng lượng phân tử của các đầu dò siêu nhỏ có bán trên thị trường có phạm vi rộng khoảng 6 – 100kD, nhưng cũng có sẵn 1MD. Mặc dù các hợp chất hòa tan trong nước thường khuếch tán tự do qua màng vi lọc, nhưng tình hình không rõ ràng đối với các phân tích lipophilic cao, trong đó cả hai thí nghiệm thành công (ví dụ như corticosteroid) và các thí nghiệm vi lọc không thành công (ví dụ: estradiol, axit fusidic) đã được báo cáo. , sự phục hồi của các hợp chất hòa tan trong nước thường giảm nhanh nếu trọng lượng phân tử của chất phân tích vượt quá 25% trọng lượng phân tử của màng.
Phương pháp phục hồi và hiệu chuẩn [ chỉnh sửa ]
Do tưới máu liên tục của đầu dò vi lọc với perfusate tươi, có thể thiết lập trạng thái cân bằng tổng thể. [1] thấp hơn so với các điểm được đo tại vị trí lấy mẫu ở xa. Để tương quan nồng độ được đo trong phương pháp thẩm tách với nồng độ có mặt tại vị trí lấy mẫu ở xa, cần có hệ số hiệu chuẩn (độ thu hồi). Sự phục hồi có thể được xác định ở trạng thái ổn định bằng cách sử dụng tốc độ trao đổi chất phân tích không đổi trên màng vi lọc. Tốc độ mà một chất phân tích được trao đổi qua màng bán kết thường được biểu thị bằng hiệu suất trích xuất của chất phân tích. Hiệu suất trích ly được định nghĩa là tỷ lệ giữa tổn thất / tăng của chất phân tích trong quá trình đi qua đầu dò (C trong C ra ) và sự khác biệt về nồng độ giữa lấy mẫu nước hoa và lấy mẫu xa trang web (C trong mẫu −C ).
Về lý thuyết, hiệu suất trích ly của đầu dò vi lọc có thể được xác định bằng cách: 1) thay đổi nồng độ thuốc trong khi giữ tốc độ dòng không đổi hoặc 2) thay đổi tốc độ dòng trong khi vẫn giữ nồng độ thuốc tương ứng. Ở trạng thái ổn định, thu được giá trị hiệu suất chiết tương tự, bất kể chất phân tích được làm giàu hoặc cạn kiệt trong nước hoa. [1] Do đó, các đầu dò vi phân có thể được hiệu chuẩn bằng cách đo độ mất của chất phân tích bằng cách sử dụng perfusate hoặc thu được chất phân tích sử dụng dung dịch mẫu chứa thuốc. Cho đến nay, các phương pháp hiệu chuẩn được sử dụng thường xuyên nhất là phương pháp tốc độ dòng chảy thấp, phương pháp thông lượng không có mạng, [7] phương pháp không thông lượng động (mở rộng), [8] và phương pháp phân tích ngược. 19659026] Việc lựa chọn đúng phương pháp hiệu chuẩn thích hợp là cực kỳ quan trọng cho sự thành công của một thí nghiệm vi phân. Do đó, các thí nghiệm hỗ trợ in vitro trước khi sử dụng ở động vật hoặc người được khuyến nghị. [1] Ngoài ra, sự phục hồi được xác định trong ống nghiệm có thể khác với sự phục hồi ở người. Do đó, giá trị thực của nó cần phải được xác định trong mọi thử nghiệm in vivo. [6]
Phương pháp tốc độ dòng chảy thấp [ chỉnh sửa ]
Phương pháp tốc độ dòng chảy thấp dựa trên thực tế hiệu suất khai thác phụ thuộc vào tốc độ dòng chảy. Ở tốc độ dòng chảy cao, lượng thuốc khuếch tán từ vị trí lấy mẫu vào phương pháp thẩm tách trên mỗi đơn vị thời gian nhỏ hơn (hiệu suất chiết thấp) so với tốc độ dòng chảy thấp hơn (hiệu suất chiết cao). Ở tốc độ dòng bằng 0, tổng trạng thái cân bằng giữa hai vị trí này được thiết lập (C out = C mẫu ). Khái niệm này được áp dụng cho phương pháp tốc độ dòng chảy (thấp), trong đó đầu dò được tưới máu với nước hoa trắng ở các tốc độ dòng chảy khác nhau. Nồng độ tại vị trí lấy mẫu có thể được xác định bằng cách vẽ các tỷ lệ chiết so với tốc độ dòng chảy tương ứng và ngoại suy thành dòng chảy bằng không. Phương pháp tốc độ dòng chảy thấp bị hạn chế bởi thực tế là thời gian hiệu chuẩn có thể khá lâu trước khi thu được một khối lượng mẫu đủ. [ cần trích dẫn ]
Không có thông lượng mạng phương pháp [ chỉnh sửa ]
Trong quá trình hiệu chuẩn với phương pháp không có mạng lưới, đầu dò vi phân được sử dụng với ít nhất bốn nồng độ chất phân tích khác nhau (C trong ) và nồng độ trạng thái ổn định của chất phân tích rời khỏi đầu dò được đo trong phương pháp thẩm tách (C ra ). [7] Sự phục hồi cho phương pháp này có thể được xác định bằng cách vẽ C C trong trên C trong và tính độ dốc của đường hồi quy. Nếu nồng độ chất phân tích trong perfusate bằng với nồng độ tại vị trí lấy mẫu, sẽ xảy ra thông lượng không có mạng. Nồng độ tương ứng tại điểm không có mạng được thể hiện bằng giao thoa x của đường hồi quy. Điểm mạnh của phương pháp này là, ở trạng thái ổn định, không có giả định nào về hoạt động của hợp chất trong vùng lân cận của đầu dò phải được thực hiện, vì trạng thái cân bằng tồn tại ở một thời điểm và địa điểm cụ thể. [6] Tuy nhiên, trong điều kiện nhất thời (ví dụ sau khi thử thách thuốc), sự phục hồi của đầu dò có thể bị thay đổi dẫn đến ước tính sai lệch về nồng độ tại vị trí lấy mẫu. Để khắc phục hạn chế này, một số phương pháp đã được phát triển cũng được áp dụng trong các điều kiện không ổn định. Một trong những cách tiếp cận này là phương pháp không có mạng động. [8]
Phương pháp không có lưới động [ chỉnh sửa ]
Trong khi một đối tượng / động vật được tưới máu với nhiều nồng độ trong phương pháp không có mạng, nhiều đối tượng được tưới máu với một nồng độ duy nhất trong phương pháp không có mạng động (DNNF) động. [8] Dữ liệu từ các đối tượng / động vật khác nhau được kết hợp tại mỗi thời điểm để phân tích hồi quy cho phép xác định sự phục hồi theo thời gian. Thiết kế của phương pháp hiệu chuẩn DNNF đã được chứng minh rất hữu ích cho các nghiên cứu đánh giá phản ứng của các hợp chất nội sinh, chẳng hạn như dẫn truyền thần kinh, đối với thách thức thuốc. [8]
Retrodialysis chỉnh sửa ]
, đầu dò vi phân được tưới máu bằng dung dịch chứa chất phân tích và sự biến mất của thuốc khỏi đầu dò được theo dõi. Sự phục hồi của phương pháp này có thể được tính là tỷ lệ thuốc bị mất trong quá trình đi qua (C trong C trong ) và thuốc đi vào đầu dò siêu nhỏ (C trong ). Về nguyên tắc, phân tích retrodialysis có thể được thực hiện bằng cách sử dụng chính chất phân tích (retrodialysis bằng thuốc) hoặc một hợp chất tham chiếu (retrodialysis bằng hiệu chuẩn) gần giống với cả đặc tính hóa lý và tính chất sinh học của chất phân tích. [9] không thể được sử dụng cho các hợp chất nội sinh vì nó không cần chất phân tích từ vị trí lấy mẫu, phương pháp hiệu chuẩn này được sử dụng phổ biến nhất cho các hợp chất ngoại sinh trong môi trường lâm sàng. [1]
Ứng dụng [ chỉnh sửa ]
Kỹ thuật vi phân đã trải qua nhiều sự phát triển kể từ lần đầu tiên sử dụng vào năm 1972, [4] khi nó lần đầu tiên được sử dụng để theo dõi nồng độ của các phân tử sinh học nội sinh trong não. [10] Khu vực ứng dụng ngày nay đã mở rộng để theo dõi nồng độ nội sinh miễn phí. các hợp chất ngoại sinh trong hầu như bất kỳ mô. Mặc dù microdialysis vẫn được sử dụng chủ yếu trong các nghiên cứu động vật tiền lâm sàng (ví dụ như động vật gặm nhấm trong phòng thí nghiệm, chó, cừu, lợn), nhưng hiện nay nó được sử dụng ngày càng nhiều ở người để theo dõi nồng độ mô thuốc tự do, không liên kết cũng như nồng độ của các cytokine điều hòa và chuyển hóa để đáp ứng với các rối loạn cân bằng nội môi như cho ăn và / hoặc tập thể dục. [11]
Khi được sử dụng trong nghiên cứu não bộ, microdialysis thường được sử dụng để đo các chất dẫn truyền thần kinh (ví dụ như dopamine, serotonin, norepinephrine, acetyl chất chuyển hóa của chúng, cũng như các chất điều chế thần kinh nhỏ (ví dụ cAMP, cGMP, NO), axit amin (ví dụ glycine, cysteine, tyrosine) và chất nền năng lượng (ví dụ glucose, lactate, pyruvate). Các loại thuốc ngoại sinh được phân tích bằng phương pháp vi phân bao gồm thuốc chống trầm cảm mới, thuốc chống loạn thần, cũng như thuốc kháng sinh và nhiều loại thuốc khác có vị trí tác dụng dược lý của chúng trong não. Chất không chuyển hóa đầu tiên được phân tích bằng microdialysis in vivo trong não người là rifampicin. [12] [13] [14] trong các cơ quan khác bao gồm da (đánh giá khả dụng sinh học và tương đương sinh học của các sản phẩm thuốc da liễu bôi ngoài da), [15] và theo dõi nồng độ glucose ở bệnh nhân tiểu đường (đặt đầu dò dưới da hoặc dưới da). Sau này thậm chí có thể được kết hợp vào một hệ thống tuyến tụy nhân tạo để quản lý insulin tự động.
Microdialysis cũng đã tìm thấy ứng dụng ngày càng tăng trong nghiên cứu môi trường, [16] lấy mẫu đa dạng các hợp chất từ nước thải và dung dịch đất, bao gồm sacarit, [17] ion kim loại, [18] axit hữu cơ, [19] và phân tử thấp nitơ trọng lượng. [20] Do tính chất phá hủy của các phương pháp lấy mẫu đất thông thường, [21] vi phân có khả năng ước lượng dòng ion của đất phản ánh tốt hơn môi trường đất không bị xáo trộn.
Phân tích quan trọng [ chỉnh sửa ]
Ưu điểm [ chỉnh sửa ]
- Cho đến nay, microdialysis là kỹ thuật lấy mẫu in vivo duy nhất có thể liên tục theo dõi nồng độ thuốc hoặc chất chuyển hóa trong dịch ngoại bào của hầu như bất kỳ mô nào. Tùy thuộc vào ứng dụng chính xác, nồng độ chất phân tích có thể được theo dõi trong vài giờ, vài ngày hoặc thậm chí vài tuần. Nồng độ mô ngoại bào tự do, không liên kết trong nhiều trường hợp được quan tâm đặc biệt vì chúng giống với nồng độ hoạt động dược lý tại hoặc gần với vị trí tác dụng. Kết hợp vi phân với các kỹ thuật hình ảnh hiện đại, chụp cắt lớp phát xạ positron như vậy, cho phép xác định thêm nồng độ nội bào.
- Đặt đầu dò vào vị trí chính xác của mô được chọn tiếp tục cho phép đánh giá độ dốc nồng độ ngoại bào do hoạt động của chất vận chuyển hoặc khác các yếu tố, chẳng hạn như sự khác biệt tưới máu. Do đó, nó đã được đề xuất là kỹ thuật thích hợp nhất được sử dụng cho các nghiên cứu phân phối mô.
- Trao đổi chất phân tích qua màng bán định và thay thế liên tục chất lỏng lấy mẫu bằng perfusate tươi ngăn ngừa thoát dịch từ vị trí lấy mẫu, trong đó cho phép lấy mẫu mà không mất chất lỏng. Do đó, microdialysis có thể được sử dụng mà không làm xáo trộn các điều kiện mô bởi sự mất chất lỏng hoặc áp lực cục bộ, có thể xảy ra khi sử dụng các kỹ thuật khác, chẳng hạn như microinjection hoặc tưới máu kéo đẩy.
- Màng bán kết hợp ngăn chặn các tế bào, mảnh vụn tế bào và protein từ đi vào biện chứng. Do thiếu protein trong thẩm tách, nên việc làm sạch mẫu trước khi phân tích là không cần thiết và sự suy giảm enzyme không phải là vấn đề đáng lo ngại.
Hạn chế [ chỉnh sửa ]
- những tiến bộ trong việc làm cho các đầu dò vi phân nhỏ hơn và hiệu quả hơn, bản chất xâm lấn của kỹ thuật này vẫn đặt ra một số hạn chế thực tế và đạo đức. Ví dụ, người ta đã chứng minh rằng việc cấy đầu dò vi lọc có thể làm thay đổi hình thái mô dẫn đến vi tuần hoàn bị xáo trộn, tốc độ chuyển hóa hoặc tính toàn vẹn của các rào cản sinh lý, chẳng hạn như hàng rào máu não. [22] vì chấn thương cấy ghép, cần có đủ thời gian phục hồi, các yếu tố bổ sung, như hoại tử, phản ứng viêm, [11] hoặc quá trình chữa lành vết thương phải được xem xét để lấy mẫu lâu dài vì chúng có thể ảnh hưởng đến kết quả thí nghiệm. Từ góc độ thực tế, nó đã được đề xuất để thực hiện các thí nghiệm vi phân trong một cửa sổ thời gian tối ưu, thường là 24 tháng 48 giờ sau khi chèn đầu dò. [23] [24]
- có độ phân giải không gian và thời gian tương đối thấp so với, ví dụ, cảm biến sinh hóa điện hóa. Mặc dù độ phân giải thời gian được xác định bởi độ dài của các khoảng thời gian lấy mẫu (thường là vài phút), độ phân giải không gian được xác định bởi kích thước của đầu dò. Kích thước đầu dò có thể khác nhau giữa các khu vực ứng dụng khác nhau và bao gồm một phạm vi vài milimét (ứng dụng nội sọ) có chiều dài đến vài cm (ứng dụng dưới da) và đường kính vài trăm micromet. [ cần trích dẫn ]
- Việc áp dụng kỹ thuật vi phân thường bị giới hạn bởi việc xác định độ thu hồi của đầu dò, đặc biệt đối với các thí nghiệm in vivo. Việc xác định sự phục hồi có thể tốn thời gian và có thể yêu cầu thêm đối tượng hoặc thí nghiệm thí điểm. Sự phục hồi chủ yếu phụ thuộc vào tốc độ dòng chảy: tốc độ dòng chảy càng thấp thì khả năng phục hồi càng cao. Tuy nhiên, trong thực tế, tốc độ dòng chảy không thể giảm quá nhiều do thể tích mẫu thu được để phân tích sẽ không đủ hoặc độ phân giải thời gian của thí nghiệm sẽ bị mất. Do đó, điều quan trọng là tối ưu hóa mối quan hệ giữa tốc độ dòng chảy và độ nhạy của xét nghiệm phân tích. Tình hình có thể phức tạp hơn đối với các hợp chất lipophilic vì chúng có thể dính vào ống hoặc các thành phần thăm dò khác, dẫn đến sự phục hồi thấp hoặc không có chất phân tích. [ cần trích dẫn ]
Tài liệu tham khảo [ chỉnh sửa ]
- ^ a b c d e f , Müller M, Bashaw ED, Benfeldt E, Bolinder J, Bullock R, Bungay PM, DeLange EC, Derendorf H, Elmquist WF, Hammarlund-Udenaes M, Joukhadar C, Kellogg DL, Lunte CE, Nordstrom , Cheung BW, Shah VP, Stahle L, Ungerstedt U, Welty DF, Yeo H (tháng 5 năm 2007). "Sách trắng hội thảo của AAPS-FDA: nguyên tắc vi phân, ứng dụng và quan điểm pháp lý". Nghiên cứu dược phẩm . 24 (5): 1014 Ảo25. doi: 10.1007 / s11095-006-9206-z. PMID 17458685.
- ^ "Kỷ yếu của Hội sinh lý học". Tạp chí Sinh lý học . 155 : 1 Ảo28. 1961. doi: 10.1113 / jphysiol.1961.sp006651.
- ^ Bito L, Davson H, Levin E, Murray M, Snider N (tháng 11 năm 1966). "Nồng độ axit amin tự do và các chất điện giải khác trong dịch não tủy, thẩm tách in vivo của não và huyết tương của chó". Tạp chí hóa học thần kinh . 13 (11): 1057 Tiết67. doi: 10.111 / j.1471-4159.1966.tb04265.x. PMID 5924657.
- ^ a b Delgado JM, DeFeudis FV, Roth RH, Ryugo DK, Mitruka BM. "Dialytrode cho tưới máu nội sọ dài hạn ở những con khỉ tỉnh táo". Lưu trữ quốc tế De Pharmacodynamie Et De Therapie . 198 (1): 9 Tái21. PMID 4626478.
- ^ Ungerstedt U, Pycock C (tháng 7 năm 1974). "Tương quan chức năng của dẫn truyền thần kinh dopamine". Bản tin Der Schweizerischen Akademie Der Medizinischen Wissenschaften . 30 (1 Lỗi3): 44 Tắt55. PMID 4371656.
- ^ a b c [659090] V (tháng 6 năm 2002). "Vi phân người". Công nghệ sinh học dược phẩm hiện tại . 3 (2): 165 Tái78. doi: 10.2174 / 1389201023378373. PMID 12022259.
- ^ a b Lönnroth P, Jansson PA, Smith U (tháng 8 năm 1987). "Một phương pháp vi phân cho phép mô tả đặc trưng của không gian nước giữa các tế bào ở người". Tạp chí Sinh lý học Hoa Kỳ . 253 (2 Pt 1): E228 Từ31. doi: 10.1152 / ajpendo.1987.253.2.E228. PMID 3618773.
- ^ a b c [19459029 Olson RJ, Công lý JB (2002). "Phân tích vi lượng định lượng trong điều kiện thoáng qua". Hóa học phân tích . 65 (8): 1017 Tiết1022. doi: 10.1021 / ac00056a012.
- ^ a b Wang Y, Wong SL, Sawchuk RJ (tháng 10 năm 1993). "Hiệu chuẩn vi phân bằng cách sử dụng phương pháp retrodialysis và zero-net: ứng dụng vào nghiên cứu phân phối zidovudine vào dịch não tủy và đồi thị của thỏ". Nghiên cứu dược phẩm . 10 (10): 1411 Tắt9. doi: 10.1023 / A: 1018906821725. PMID 8272401.
- ^ Benveniste H, Hüttemeier PC (1990). "Microdialysis – lý thuyết và ứng dụng". Tiến bộ trong sinh học thần kinh . 35 (3): 195 Chiếc215. doi: 10.1016 / 0301-0082 (90) 90027-E. PMID 2236577.
- ^ a b Carson BP, McCormack WG, Conway C, Cooke J, Saunders J, O ' Tháng 2 năm 2015). "Một đặc tính của vi phân in vivo về sự thay đổi thoáng qua về nồng độ của chất chuyển hóa xen kẽ của các chất chuyển hóa và cytokine trong cơ xương người để đáp ứng với đầu dò của vi lọc". Cytokine . 71 (2): 327 Từ33. doi: 10.1016 / j.cyto.2014.10.022. PMID 25528289.
- ^ Mindermann T, Zimmerli W, Gratzl O (tháng 10 năm 1998). "Nồng độ rifampin trong các khoang khác nhau của não người: một phương pháp mới để xác định nồng độ thuốc trong không gian ngoại bào não". Đại lý kháng khuẩn và hóa trị . 42 (10): 2626 Ảo9. PMC 105908 . PMID 9756766.
- ^ Müller M, dela Peña A, Derendorf H (tháng 5 năm 2004). "Các vấn đề về dược động học và dược lực học của các chất chống nhiễm trùng: phân phối trong mô". Đại lý kháng khuẩn và hóa trị . 48 (5): 1441 Tiết53. PMC 400530 . PMID 15105091.
- ^ Đầu bếp VI, Thompson AC, Zapata A, Shippenberg TS (tháng 4 năm 2009). "Tổng quan về vi lọc não". Các giao thức hiện tại trong khoa học thần kinh . Chương 7: Bài7.1. doi: 10.1002 / 0471142602.ns0701s47. PMC 2953244 . PMID 19340812.
- ^ Schmidt S, Banks R, Kumar V, Rand KH, Derendorf H (tháng 3 năm 2008). "Vi phân lâm sàng ở da và mô mềm: một bản cập nhật". Tạp chí dược lâm sàng . 48 (3): 351 Tiết64. doi: 10.1177 / 0091270007312152. PMID 18285620.
- ^ Miro M, Frenzel W (2005). "Tiềm năng của vi phân như một kỹ thuật xử lý mẫu tự động cho nghiên cứu môi trường". Xu hướng Trac trong hóa học phân tích . 24 (4): 324 Công viên. doi: 10.1016 / j.trac.2004.10.004.
- ^ Torto N, lobelo B, Gorton L (2000). "Xác định sacarit trong nước thải từ ngành công nghiệp nước giải khát bằng cách lấy mẫu vi phân, sắc ký trao đổi anion hiệu suất cao và phát hiện điện hóa xung tích hợp". Nhà phân tích . 125 (8): 1379 Tiết1381. doi: 10.1039 / b004064i.
- ^ Torto N, Mwatseteza J, Sawula G (2002). "Một nghiên cứu về lấy mẫu vi phân của các ion kim loại". Phân tích Chimica Acta . 456 (2): 253 Công261. doi: 10.1016 / S0003-2670 (02) 00048-X.
- ^ Sulyok M, Miró M, Stingeder G, Koellensperger G (tháng 8 năm 2005). "Tiềm năng của quá trình vi phân dòng chảy để thăm dò các anion hữu cơ có trọng lượng phân tử thấp trong dung dịch đất hình thoi". Phân tích Chimica Acta . 546 (1): 1 Ảo10. doi: 10.1016 / j.aca.2005.05.027. PMID 29569545.
- ^ Inselsbacher, Erich; Öhlund, Jonas; Jämtgård, Sandra; Huss-Danell, Kerstin; Näsholm, Torgny (2011). "Tiềm năng của vi phân để theo dõi các hợp chất nitơ hữu cơ và vô cơ trong đất". Sinh học đất và hóa sinh . 43 (6): 1321 Ảo1332. doi: 10.1016 / j.soilbio.2011.03.003.
- ^ Inselsbacher, Erich (2014). "Phục hồi các dạng nitơ đất riêng lẻ sau khi sàng và khai thác". Sinh học đất và hóa sinh . 71 : 76 Thần86. doi: 10.1016 / j.soilbio.2014.01.009.
- ^ Morgan ME, Singhal D, Anderson BD (tháng 5 năm 1996). "Đánh giá định lượng tổn thương hàng rào máu não trong quá trình vi phân". Tạp chí dược lý và liệu pháp thí nghiệm . 277 (2): 1167 Điêu76. PMID 8627529.
- ^ Di Chiara G, Tanda G, Carboni E (tháng 11 năm 1996). "Ước tính giải phóng chất dẫn truyền thần kinh in-vivo bằng phương pháp vi lọc não: vấn đề về tính hợp lệ". Dược lý hành vi . 7 (7): 640 Hóa657. doi: 10.1097 / 00008877-199611000-00009. PMID 11224460.
- ^ Damsma G, Westerink BH, Imperato A, Rollema H, de Vries JB, Horn AS (tháng 8 năm 1987). "Lọc máu tự động acetylcholine ở chuột di chuyển tự do: phát hiện acetylcholine cơ bản". Khoa học đời sống . 41 (7): 873 Ảo6. doi: 10.1016 / 0024-3205 (87) 90695-3. PMID 3613848.